Das PDF dient ausschließlich dem persönlichen Gebrauch! - Weitergehende Rechte bitte anfragen unter: nutzungsrechte@asu-arbeitsmedizin.com.
MdE due to renal dysfunction
Renal dysfunction is a common disease in the general population, affecting around 10%–13% of the population. It can also be the result of occupational exposure to substances that are toxic to the kidneys or a consequence of treatment for a disease recognised as an occupational disease, such as urinary bladder cancer. The Kidney Disease Improving Global Outcomes (KDIGO) has published an updated and generally recognised staging of renal dysfunction for many years. To date, however, no values for the reduction in earning capacity (MdE) have been published for the legal field of statutory accident insurance for the assessment of occupational renal dysfunction. Therefore, the authors present a MdE table for the assessment of occupational renal dysfunction based on the KDIGO stage classification.
Keywords: expert opinion – renal dysfunction – glomerular filtration rate (GFR) – cystatin C – reduction in earning capacity (MdE)
MdE bei Nierenfunktionsstörung
Eine Nierenfunktionsstörung (Niereninsuffizienz) ist in Deutschland mit rund 10–13 % in der Allgemeinbevölkerung eine häufige Erkrankung. Sie kann unter anderem Folge eines Arbeitsunfalls, einer beruflichen Exposition gegen nierentoxische Arbeitsstoffe oder Therapiefolge bei einer als Berufskrankheit anerkannten Erkrankung zum Beispiel einem Tumor der harnableitenden Wege sein. Seit vielen Jahren liegt eine von der Kidney Disease Improving Global Outcomes (KDIGO) publizierte, aktualisierte und allgemein anerkannte Stadieneinteilung der Nierenfunktionsstörung vor. Bislang wurden jedoch für die Bewertung einer beruflich bedingten Nierenfunktionsstörung keine Werte zur Einschätzung der Minderung der Erwerbsfähigkeit (MdE) für das Rechtsgebiet der gesetzlichen Unfallversicherungen (GUV) publiziert. Daher stellen die Autorinnen und Autoren eine MdE-Tabelle zur Einschätzung einer beruflich bedingten Nierenfunktionsstörung vor, die auf der Stadieneinteilung der Kidney Disease Improving Global Outcomes (KDIGO) basiert.
Schlüsselwörter: Begutachtung – Niereninsuffizienz – Nierenfunktionsstörung – glomeruläre Filtrationsrate (GFR) – Cystatin C – Minderung der Erwerbsfähigkeit (MdE)
Einleitung
Die Nierenfunktionsstörung (Niereninsuffizienz) ist in Deutschland mit 10–13 % (Weckmann et al. 2020) eine in der Allgemeinbevölkerung häufige Erkrankung. Mit zunehmendem Alter nimmt die Prävalenz zu. So berichteten Zhang et al. (2009) in der Altersgruppe der 50- bis 74-Jährigen in Deutschland über eine Prävalenz von 17%. Neuere Untersuchungen liegen nicht vor. In den USA waren im Jahre 2008 die häufigsten Ursachen einer terminalen Niereninsuffizienz diabetische Nephropathie (44 %), vaskulär-bedingte Ursachen (AVK, arterieller Hypertonus; 27 %), Glomerulopathien (7 %), polyzystische Nierenerkrankungen (3 %), tubulointerstitielle Erkrankungen und andere Ursachen (19 %; Manski 2024). In Deutschland sind sowohl die Anzahl Neuerkrankter als auch die Gesamtzahl im letzten Jahrzehnt stark steigend, bedingt vor allem durch eine Zunahme in den Altersgruppen der über 65- und über 75-Jährigen (Schöps et al. 2024). Für das Jahr 2021 (Deutsche Rentenversicherung Bund 2022) machten die nephrologischen Erkrankungen in Deutschland insgesamt ca. 1 % der Rentenneuzugänge wegen Erwerbsunfähigkeit aus.
Eine Nierenfunktionsstörung kann traumatisch, beispielsweise nach Unfall, medikamentös-toxisch (z. B. durch Chemotherapie, nicht-steroidale Antirheumatika, diverse Antibiotika und andere nephrotoxische Substanzen), infektiös oder durch eine Harnabflussstörung bedingt sein und sukzessiv zum vollständigen Verlust der Nierenfunktion führen.
In der Arbeitsmedizin sind Nierenerkrankungen durch Metalle und Schwermetalle, zum Beispiel Cadmium, Blei und Quecksilber, bekannt, ebenso durch Arsen und durch verschiedene organische Lösungsmittel wie Trichlorethylen (Synonyme: Trichlorethen, TRI) und früher auch durch Herbizide wie Paraquat. Die meisten arbeitsmedizinisch relevanten Nierenerkrankungen treten als chronisch interstitielle Nephropathien zu Tage. Die Beurteilung dieser berufsbedingten Zusammenhänge liegen im Kompetenzbereich der Arbeitsmedizinerinnen und -mediziner in Zusammenarbeit mit Nephrologen (Schöps et al. 2024).
Beruflich verursachte Nierenfunktionsstörungen müssen im Rahmen der Begutachtung für die GUV gegenüber einer nicht versicherten Einschränkung der Nierenfunktion abgegrenzt werden und dann nachvollzieh- und reproduzierbar durch Einschätzung einer MdE bewertet werden. Da bislang für das Rechtsgebiet der GUV keine MdE-Werte für die verschiedenen Stadien der Nierenfunktionsstörung publiziert wurden, stellen die Autorinnen und Autoren die von ihnen erarbeiteten MdE-Werte zur Diskussion.
Kreatinin
Da Kreatininwerte im Serum die obere Normgrenze erst dann überschreiten, wenn die glomeruläre Filtrationsrate (GFR) bereits um mehr als 50 % vermindert ist, sind sie, nicht nur in der Begutachtungssituation, ein zu ungenauer Parameter für die Erfassung der Nierenfunktion. Klinisch manifest wird eine eingeschränkte GFR erst, wenn die GFR auf etwa 25 % der Norm abgesunken ist. Dann allerdings reichen bereits kleine zusätzliche Verminderungen der GFR, um einen deutlichen weiteren Anstieg der harnpflichtigen Substanzen zu bewirken (Brenner u. Hebert 1994; Kuhlmann et al. 1998; Grosser et al. 2001). Erschwerend für die Begutachtung kommt hinzu, dass eine Nierenfunktionsstörung bei den sich noch gesund fühlenden Patientinnen und Patienten lange keine Beschwerden verursacht, obwohl sie mit geeigneten Laboruntersuchungen bereits erkennbar wäre.
Daher ist eine alleinige Bestimmung der Kreatininkonzentration im Serum zumindest bei Werten, die im oberen Normwertbereich liegen, sowie bei älteren Patientinnen und Patienten – wegen der geringeren Muskelmasse –, nicht sinnvoll. Da die rechnerischen eGFR-Werte auf der Kreatininkonzentration beruhen, versagen auch diese im „kreatininblinden“ Bereich. In kritischen Fällen wird daher bis heute immer noch die Bestimmung im 24-h-Sammelurin empfohlen (Galle 2016; Shafi et al. 2022).
Cystatin C
Vor allem im gutachtlichen Kontext bietet sich als verlässlichere Alternative zum Serum-Kreatinin zur Abschätzung der GFR ein bislang wenig gebräuchlicher Laborparameter an, die Cystatin-C-Konzentration.
Cystatin C (CC) ist ein niedermolekulares Protein (120 Aminosäuren; MG 13000), das in konstanter Menge von allen Körperzellen gebildet wird. Dieses Protein wird fast ausschließlich durch glomeruläre Filtration aus dem Kreislauf eliminiert, anschließend tubulär rückresorbiert und abgebaut. Cystatin C ist unabhängig von Alter, Geschlecht, Muskelmasse und Ernährung. Zudem ist dieser Test kaum fehleranfällig, umfassend verfügbar und in hohem Maße genau (National Kidney Foundation 2002). Cystatin C wird schnell aus dem Blut ausgeschieden und ist daher ein wesentlich empfindlicherer Marker für die Nierenfunktion als Kreatinin (Shlipak et al. 2013). Auch zeigt sich keine Beeinträchtigung durch Ikterus oder Hämolyse.
Die Bestimmung von Cystatin C im Serum und der daraus berechneten GFR empfiehlt sich daher zur Erfassung einer eingeschränkten glomerulären Filtrationsrate bei akuten und chronischen Nierenerkrankungen sowie beim Screening auf Nierenerkrankungen und sollte der Standard-Laborparameter nach einseitigem Nierenverlust sein (Werneburg et al. 2023).
In der Begutachtungssituation sollte aus den zuvor genannten Gründen ein Vergleich des Cystatin-C-Werts mit den bereits dokumentierten Retentionswerten (Kreatinin, eGFR) erfolgen, um zu einer überzeugenderen, wissenschaftlich begründeten Beurteilung der Nierenfunktionsstörung zu gelangen und vor allem die Verlaufsbeurteilung zu erleichtern.
Glomeruläre Filtrationsrate (GFR)
Das am häufigsten bei Patientinnen und Patienten angewendete Maß zur Bestimmung der Nierenfunktion ist die GFR aus dem 24-h-Sammelurin. Allerdings birgt das Sammeln des Urins methodische Unsicherheiten. So ist insbesondere eine Sammelmenge von unter 1,5 l kritisch zu hinterfragen. Nur wenn der GFR-Wert aus dem Sammelurin in der Streubreite des mittels anerkannter Formeln (z. B. Cockroft-und-Gault-Formel, CKD-EPI-Formel, MDRD-Formel, Counahan-Barratt-Formel, BIS-1 Formel, im Internet als Online-Rechner verfügbar) aus dem Kreatininwert errechneten Werts (eGFR) liegt, kann er als präzisere Grundlage für die MdE-Einschätzung dienen.
Nierenfunktionsstörung
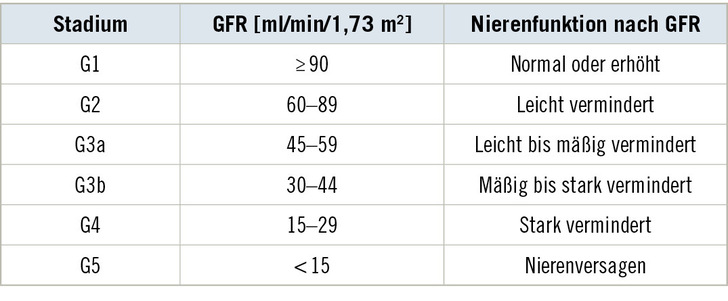
Eine über drei Monate hinaus bestehende (chronische) Nierenfunktionsstörung beziehungsweise chronische Niereninsuffizienz (nach alter Nomenklatur) wird von der Kidney Disease Improving Global Outcomes (KDIGO) in sechs Stadien eingeteilt (KDIGO 2013, 2024; s. ➥ Tabelle 1). Die Stadieneinteilung der Nierenfunktionsstörung durch die KDIGO ist seit vielen Jahren international akzeptiert und wurde daher von den Autorinnen und Autoren als Grundlage für die Erstellung einer MdE-Bewertung herangezogen. Die Albuminurie, die in der KDIGO-Klassifikation als zweiter Parameter neben der GFR zur Beschreibung der Nierenfunktionsstörung herangezogen wird, sagt weniger über den aktuellen Funktionszustand der Niere als über die strukturelle Schädigung und damit über die Prognose der Erkrankung aus. Da die Prognose nicht MdE-relevant ist, beschränkt sich die Darstellung hier auf den Teilbereich der GFR in der KDIGO-Klassifikation.
Nach der Kidney Disease Outcome Quality Initiative (KDOQI) (Patel u. Singh 2009) ist ein altersbezogenes Nachlassen der glomerulären Filtrationsrate (GFR) die Regel. Der durchschnittliche Verlust beträgt ca. 1 ml/min/1,73 m2 pro Jahr, beginnend im dritten
Lebensjahrzehnt (Waas et al. 2021). Allerdings existieren bislang keine KDIGO-Werte für Erkrankte in höherem Lebensalter.
Daher darf der reine GFR-Wert bei 80-Jährigen, der bei 20-Jährigen eindeutig pathologisch wäre, keinesfalls als Beweis einer Nierenfunktionsstörung angesehen werden.
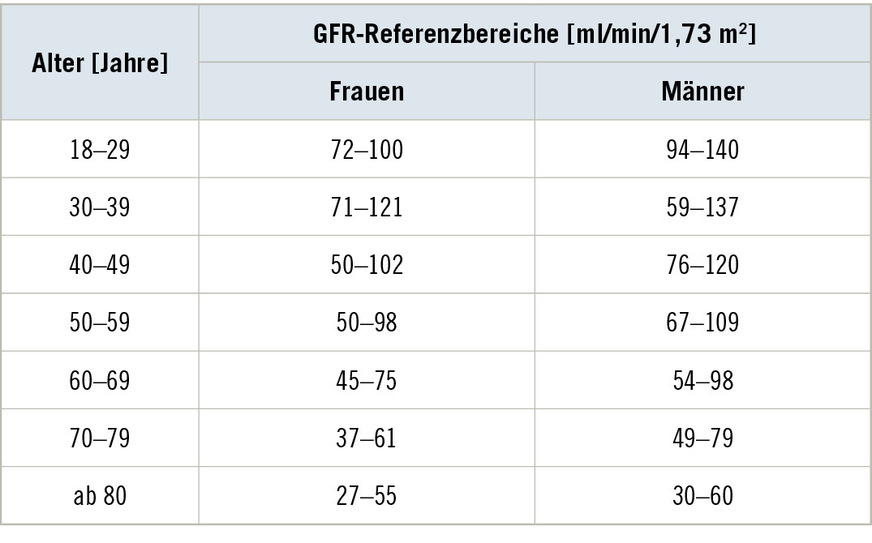
Table 2: Age-adapted reference ranges of the GFR (according to Wisplinghoff 2025)
Sonderfall einseitige Nierenfunktionsstörung
Die Objektivierung einer Nierenfunktionsstörung gelingt in diesem Fall ausschließlich durch eine nuklearmedizinische Untersuchung mit Berechnung der seitengetrennten Funktion. Diese Untersuchung wird (wegen der Strahlenbelastung) allerdings als nicht mitwirkungspflichtig angesehen (Deutsche Rentenversicherung Bund 2011; Zellner et al. 2018). Da auf sie in der Begutachtung und MdE-Einschätzung nicht verzichtet werden kann, erfordert diese Untersuchung eine besonders intensive Aufklärung, die entsprechend zu dokumentieren ist. Eine seitengetrennte Funktionsverteilung von 100 % zu 0 % ist wie ein Nierenverlust mit einer MdE von 20 v. H., eine Verteilung von 75 % zu 25 % mit einer MdE von 10 v. H. einzuschätzen.
Stadienbezogene MdE bei Nierenfunktionsstörung
Aufgrund einer verlässlich bestimmten Filtrationsleistung zum Beispiel durch Cystatin C und eGFRCC, ist zunächst die Schädigung der Nierenfunktion einzuschätzen. Dies erfolgte in Tabelle 1 zunächst ohne Berücksichtigung der sich mit zunehmendem Alter reduzierenden Norm- beziehungsweise Referenzwerte (s. ➥ Tabelle 2).
Danach erfolgt die Zuordnung der stadienbezogenen MdE (➥ Tabelle 3). Diese reicht von einer MdE von 0 v. H. bei normaler Nierenfunktion bis zu einer MdE von 100 v. H. bei einer GFR von weniger als 15 ml/min/1,73 m2.
In Konsequenz zu den Publikationen der KDIGO (KDIGO 2013, 2024) sollte der Verlust einer Niere bis zu einer GFR ≥ 45 ml/min (leicht bis mäßig verminderte Funktionseinschränkung) mit einer MdE von
20 v. H. eingeschätzt werden. Bei geringerer Restfunktion, das heißt GFR < 45 ml/min, ist die MdE entsprechend der Ausprägung der (chronischen) Nierenfunktionsstörung höher einzuschätzen.
Diese Werte in Tabelle 3 sind bei der individuellen Betrachtung der/des Versicherten abschließend mit den altersadaptierten Referenzwerten aus Tabelle 2 in Bezug zu setzen, um nicht eine physiologische Abnahme der Filtrationsleistung im Alter fehlerhaft als MdE-relevante Funktionsminderung zu interpretieren. Als Beispiel sei hier der Mittelwert des Referenzbereichs für Männer über 80 Jahre von 45 ml/min genannt, der nicht ohne weitere Plausibilitätsprüfung (z. B. Korrelation mit Vorwerten) oder ergänzende Untersuchungen (Albumin/Kreatinin-Ratio (ACR) im Spontanurin/Gesamteiweiß im 24-h-Sammelurin, Differenzierung der Markerproteine) als moderate bis starke Funktionseinschränkung gesehen werden darf. Gegebenenfalls ist in solchen Fällen ein nephrologisches Zusatzgutachten zu erwägen.
Fazit
Mit der vorgestellten MdE-Tabelle wurde die Basis für eine einheitliche Bewertung der (chronischen) Nierenfunktionsstörung geschaffen. Dadurch wird eine nachvollziehbare, für alle Versicherten gleiche Beurteilung der MdE bei Nierenfunktionsstörungen ermöglicht.▪
Interessenkonflikt: Das Autorenteam gibt an, dass keine Interessenkonflikte vorliegen.
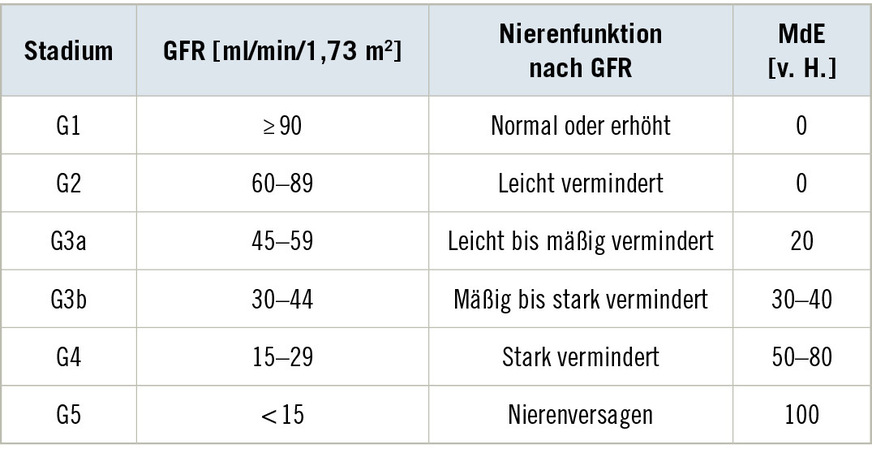
Table 3: Stage-related MdE of (chronic) renal dysfunction without age adjustment (KDIGO 2013, 2024, supplemented by Schöps et al. 2013). Nomenclature according to Eckardt et al. (2022)
Literatur
Deutsche Rentenversicherung Bund: Jahresbericht 2021. https://www.deutsche-rentenversicherung.de/SharedDocs/Downloads/DE/Stat… (abgerufen am 29.04.2024).
Brenner BM, Hebert SC: Disturbances of renal function. In: Isselbacher KJ, Braunwald E, Wilson JD, Martin JB, Fauci AS, Kasper DL (Hrsg.): Harrison’s principles
of internal medicine. New York: McGraw-Hill, 1994, S. 1259–1265.
Eckardt KU, Binet I, de Groot K, Floege J, Galle JC, Jordans I, Kribben A, Oberbauer R, Pavenstädt H, Rosenkranz A, Säemann M, Winkelmayer WC: Nomenklatur für Nierenfunktion und Nierenkrankheiten – Durch Präzision und Verständlichkeit zu besserer Erfassung und Prognose. Dtsch Med Wochenschr 2022; 147: 1398–1406. doi:10.1055/a-1908-5163 (Open Access).
Galle J: Glomeruläre Filtrationsrate: Fallstricke der Berechnung. Dtsch Arztebl 2016; 113: 4–6. doi:10.3238/PersUro.2016.08.22.01.
Grosser V,·Wenzl M, Kiene J, Jürgens C: Folgezustände nach abdominaler Verletzung. Trauma Berufskrankh 2001; 3 [Suppl 3]: S400–S403. https://doi.org/10.1007/PL00014754 (Open Access).
Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group: KDIGO 2012 clinical practice guideline for the evaluation and management of chronic kidney disease. Kidney Int 2013; Suppl. 3: 1–150.
Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group: KDIGO 2024 Clinical Practice Guideline for the evaluation and management of chronic kidney disease. Kidney Int 2024; 105: S117–S314.
Kuhlmann U, Walb D, Luft FC: Nephrologie. Pathophysiologie – Klinik – Praxis. Stuttgart, New York, Tokyo: Thieme, 1998.
Manski D: Urologielehrbuch.de. 17. Aufl. 2024; https://www.urologielehrbuch.de/ (abgerufen am 19.03.2025).
Millerick-May ML, Schrauben S, Reilly MJ, Rosenman KD: Silicosis and chronic renal disease. Am J Ind Med 2015; 58: 730–736. doi:10.1002/ajim.22465.
National Kidney Foundation: K/DOQI clinical practice guidelines for chronic kidney disease: evaluation, classification, and stratification. Am J Kidney Dis 2002; 39 (2 Suppl 1): S1–266. www.kidney.org/sites/default/files/2024-08/ckd_evaluation_classificatio… (abgerufen am 12.05.2025).
Patel TV, Singh AK: Kidney disease outcomes quality initiative guidelines for bone and mineral metabolism: emerging questions. Semin Nephrol 2009; 29: 105–112.
https://doi.org/10.1016/j.semnephrol.2009.01.003.
Rosenman KD, Moore-Fuller M, Reilly MJ: Kidney disease and silicosis. Nephron 2000; 85: 14–19. doi:10.1159/000045624.
Schöps W, Jungmann O, Zumbe J, Zellner M, Hengstler JG, Golka K: Assessment criteria for compensation of occupational bladder cancer. Front Biosci (Elite Ed) 2013; 5: 653–661. https://doi.org/10.2741/E646.
Schöps W, Janssen U, Böthig R, Jungmann OP, Kaufmann A, Proff U, Stahl L, Zellner M, Golka K: Erkrankungen der Niere. In: Obermeyer C, Gaidzik PW, Forchert M (Hrsg.): Kursbuch der medizinischen Begutachtung. 2. Ergänzungslieferung. Landsberg am Lech: ecomed Medizin, 2024.
Shafi T, Zhu X, Lirette ST, Rule AD, Mosley T, Butler KR, Hall ME, Vaitla P, Wynn JJ, Tio MC, Dossabhoy NR, Guallar E, Butler J: Quantifying individual-level inaccuracy in glomerular filtration rate estimation: a cross-sectional study. Ann Intern Med 2022; 175: 1073–1082. doi:10.7326/M22-0610.
Shlipak MG, Matsushita K, Ärnlöv J, Inker LA, Katz R, Polkinghorne KR, Rothenbacher D, Sarnak MJ, Astor BC, Coresh J, Levey AS, Gansevoort RT; CKD Prognosis Consortium: Cystatin C versus creatinine in determining risk based on kidney function. N Engl J Med 2013; 369: 932–943. doi:10.1056/NEJMoa1214234.
Waas T, Schulz A, Lotz J, Rossmann H, Pfeiffer N, Beutel ME, Schmidtmann I, Münzel T, Wild PS, Lackner KJ: Distribution of estimated glomerular filtration rate and determinants of its age dependent loss in a German population-based study.
Sci Rep 2021; 11: 10165. doi:10.1038/s41598-021-89442-7 (Open Access).
Weckmann G, Chenot JF, Stracke S: Versorgung von Patienten mit chronischer nichtdialysepflichtiger Nierenerkrankung in der Hausarztpraxis. Dtsch Arztebl Int 2020; 117: 745–751. doi:10.3238/arztebl.2020.0745 (Open Access).
Werneburg GT, Hettel D, Jeong S, Nemunaitis G, Taliercio JJ, Wood HM: Estimated glomerular filtration rate using cystatin C is a more sensitive marker for kidney dysfunction in nonweight-bearing individuals. J Urol 2023; 209: 391–398. doi:10.1097/JU.0000000000003070.
Wisplinghoff U: Formelsammlung. Niere: GFR nach CKD-EPI-Formel (Chronic Kidney Disease Epidemiology Collaboration), 2025. https://www.wisplinghoff.de/fuer-aerzte/formelsammlung/niere-gfr-nach-c… (abgerufen 19.03.2025).
Zellner M, Schöps W, Jungmann OP, Böthig R, Kadhum T, Golka K: Voraussetzungen für ein überzeugendes (neuro)urologisches Gutachten. Urologe A 2018; 57: 804–810. doi:10.1007/s00120-018-0663-x.
Zhang QL, Koenig W, Raum E, Stegmaier C, Brenner H, Rothenbacher D: Epidemiology of chronic kidney disease: results from a population of older adults in Germany. Prev Med 2009; 48: 122–127. doi:10.1016/j.ypmed.2008.10.026.
Kontakt
Olaf P. Jungmann
Urologische Gutachten Köln/Bonn
In den Weingärten 21, 53127 Bonn
o.jungmann@web.de