Flüchtige Verbindungen – in Atemgas und anderen biologischen Medien
Die Atemgasanalytik bietet sich als patientenfreundliche Alternative zu Blutuntersuchungen an; sie ist nicht-invasiv und die Analyse kann direkt erfolgen, so dass die Ergebnisse umgehend vorhanden sind (Pham u. Beauchamp 2021).
Die „Analyse“ der Ausatemluft gehört zu den ältesten Formen diagnostischer Methoden. Schon im antiken Griechenland berichteten Mediziner von Zusammenhängen zwischen dem Geruch der Ausatemluft einer betroffenen Person und verschiedenen Erkrankungen. So deutet beispielsweise ein süßlicher Geruch auf diabetische Ketoazidose hin, während ein fischartiger Geruchseindruck auf Lebererkrankungen hinweist. Die benannten Geruchseindrücke werden durch das Vorkommen von geruchsaktiven flüchtigen organischen Verbindungen (VOCs; engl. „volatile organic compounds“) bedingt, die durch biochemische Prozesse im Körper entstehen, über die Blutbahnen in die Lunge gebracht und von dort mit der Ausatmung aus dem Körper ausgeschieden werden. In den genannten Beispielen dienen Aceton, das nach vergorenem Apfel beziehungsweise Nagellackentferner riecht, zur Erkennung der Ketoazidose und Trimethylamin, das einen fischartigen Geruch hat, als Indikator für eine beeinträchtigte Leber, was auch „Fish Odor Syndrome“ genannt wird.
Im Allgemeinen werden diese flüchtige Stoffe vom menschlichen Körper ausgeschieden, wobei die Bestandteile der VOCs den Stoffwechselzustand einer Person als Biomarker widerspiegeln (Drabińska et al. 2021). Obwohl die Zusammensetzung der VOCs in der Ausatemluft mit der im Blutkreislauf größtenteils korreliert, muss berücksichtigt werden, dass manche Verbindungen, wie zum Beispiel Stickstoffmonoxid (FeNO), aus den Atemwegen und nicht aus dem Blutkreislauf stammen.
In der medizinischen Diagnostik werden mithilfe biologischer Medien wie Blut, Urin, Speichel und Fäzes organische Verbindungen als Biomarker untersucht, um Rückschlüsse auf den Gesundheitszustand und Krankheiten von Menschen ziehen zu können. Am Arbeitsplatz wird Biomonitoring, das heißt die Untersuchung biologischen Materials der Beschäftigten, zur Bestimmung von Gefahrstoffen, deren Metaboliten oder deren biochemischen beziehungsweise biologischen Effektparametern eingesetzt.
Chancen und Hürden der Atemgasanalyse
Atemgas steht für die Probenahme einfach zur Verfügung und kann sowohl von Personen, die bei Bewusstsein sind und eine spontane Atmung aufweisen, als auch in Fällen von beatmeten Patienteninnen und Patienten (kontinuierlich) entnommen werden
(Kim et al. 2012). Somit bietet die Analyse von flüchtigen Verbindungen in der Ausatemluft die Möglichkeit schnellerer Diagnosen und ermöglicht zudem auch eine potenzielle (Langzeit-)Überwachung bei Expositionen mit Gefahrenstoffen, sowie zur Früherkennung von Erkrankungen.
Die Atemgasanalytik steht allerdings vor einigen Herausforderungen, die einer Nutzung von Atemgas in betriebsärztlicher Praxis bisher entgegenstanden. So bietet das Konzept des Atems als biologisches Medium für Analysen zwar Vorteile, eine weitreichende Etablierung der Atemgasdiagnostik im medizinischen Umfeld beziehungsweise im Biomonitoring zeichnete sich dennoch auch nach jahrzehntelanger Atemgasforschung nicht ab. Eine große Herausforderung der Atemgasanalytik stellt das Fehlen von Standardverfahren für die Probenahme und -analyse dar, mit denen größere Abweichungen der Ergebnisse vermieden werden könnten (Beauchamp u. Miekisch 2020). Andere Limitierungen werden dadurch bedingt, dass VOCs in der Ausatemluft sämtliche chemische Stoffgruppen umfassen, sowie in Spurenkonzentrationen enthalten sind, wodurch eine Notwendigkeit für selektive und sensitive technologische Analysesysteme gefordert wird. Bei Betrachtung verschiedener Erkrankungen wird zudem deutlich, dass unterschiedliche Krankheitsbilder mutmaßlich dieselben putativen Biomarker besitzen, wodurch eine eindeutige Unterscheidung zwischen ihnen erschwert wird (Herbig u. Beauchamp 2014). Ungeachtet dieser Herausforderungen hat die Atemgasforschung in der jüngeren Geschichte stetige Fortschritte in gesundheitsbezogenen Anwendungen gemacht. Im arbeitsmedizinischen Kontext stellt Tetrachlorethen, ein Lösemittel in der Textil- und Metallreinigung, als Expositionsmarker ein gutes Beispiel für die Entwicklung eines Atemgastests dar, das eine routinemäßige Anwendung ermöglicht. Speziell entwickelte Gassammelröhren erlauben eine eigenständige Beprobung zu bestimmten kritischen Zeitpunkten und Versendung über öffentliche Briefkästen durch die exponierte Person, wobei die Analyse und Qualitätssicherung der Proben durch das Analyselabor automatisiert ist. Damit wurde demonstriert, dass Nutzungsbarrieren von Atemtests in der Routineanalytik hinsichtlich nutzungsfreundlicher Probenahme ohne die Einbindung von fachlich geschultem Personal, einfachem Probentransport, und automatisierter Probenanalytik überwunden werden können (Ziener 2014). Des Weiteren erhielten mehrere atembasierte Tests eine medizinische oder behördliche Zulassung, etwa von der US-amerikanischen Food and Drug Administration (US FDA) oder von der European Medicines Association der Europäischen Union (EU EMA) oder werden von Berufsgenossenschaften empfohlen beziehungsweise befürwortet und sind mittlerweile routinemäßig im Einsatz. Einen Einblick in diese Atemtests wird im Folgenden gegeben.
Im Praxistest – Angewandte Methoden in der klinischen Diagnostik
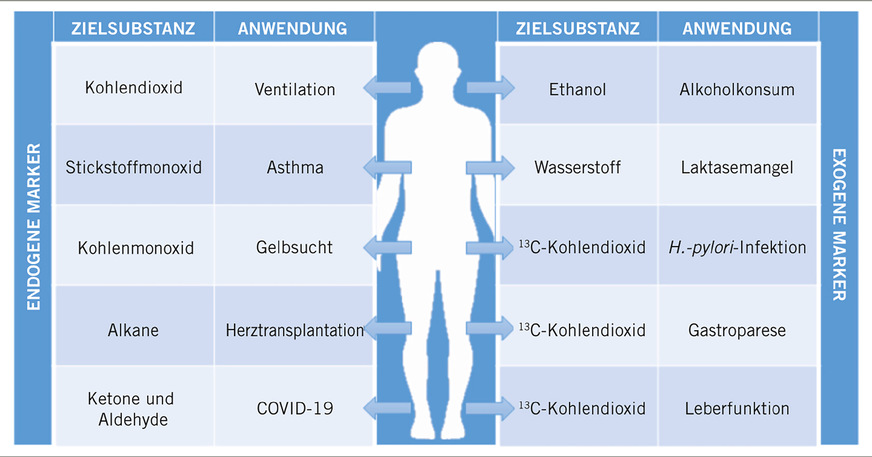
Mit Blick auf zugelassene atemgasanalytische Methoden kann zwischen Tests, die auf endogenen oder exogenen VOCs basieren, unterschieden werden. Endogene Verbindungen (s. Definitionen) reflektieren den physiologischen Zustand des Menschen und dienen somit als potenzielle Biomarker (Pleil et al. 2013; Beauchamp et al. 2020). Der normale Stoffwechsel eines gesunden Menschen entscheidet über die Produktion, Verteilung und Verbleib der endogenen Verbindungen im Körper. Nachteilige Vorgänge hingegen können diese metabolischen Prozesse hoch- oder herabregulieren, wobei die damit verbundenen Veränderungen der körpereigenen VOCs über die Luftwege ausgeschieden und daher in der Ausatemluft detektiert werden können (Basanta et al. 2010; Ibrahim et al. 2011). Im Gegensatz dazu können exogene VOCs (s. Definitionen) durch Einatmen von Umweltbestandteilen beziehungsweise Schadstoffen, durch die Einnahme von Nahrungsmitteln oder Medikamenten oder über die dermale Absorption in den Körper gelangen (Davis et al. 2019).
Endogene Biomarker – von Atemwegserkrankungen zu Gelbsucht
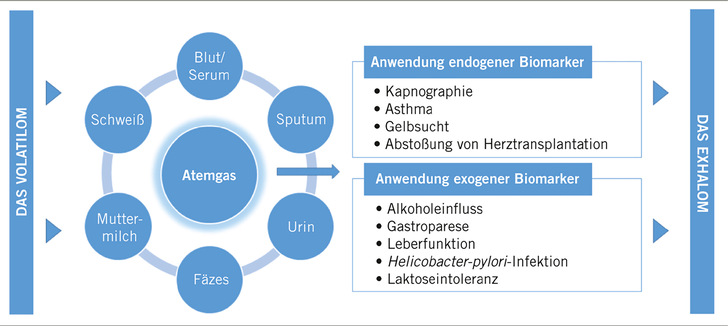
Endogene Marker in der Ausatemluft werden in einer Vielzahl von Anwendungen gemessen, die sowohl Routineanwendungen, wie beispielsweise die Kapnographie, also das Messen von Kohlendioxid zur Überwachung der Respiration, als auch gezielte, symptomatische Einsätze umfassen (➥ Abb. 1). Ein wichtiges Problemfeld der letzteren Kategorie stellen Atemwegserkrankungen wie zum Beispiel Asthma dar. Seit der Jahrtausendwende wird FeNO in der ausgeatmeten Luft erfolgreich als Biomarker für das Screening von Asthma sowie dessen Behandlung genutzt.
Stickoxid hat im Körper verschiedene Funktionen, wie die Entspannung der glatten Muskulatur der Atemwege oder die Vasodilatation von Blutgefäßen. Finden jedoch Entzündungsreaktionen statt, werden bestimmte Enzymexpressionen verstärkt induziert, die wiederum zu erhöhten Stickoxidwerten bei Personen mit Asthma führen (Aktan 2004; Chibana et al. 2008).
Stickoxid hat im Körper verschiedene Funktionen, wie die Entspannung der glatten Muskulatur der Atemwege oder die Vasodilatation von Blutgefäßen. Finden jedoch Entzündungsreaktionen statt, werden bestimmte Enzymexpressionen verstärkt induziert, die wiederum zu erhöhten Stickoxidwerten bei Personen mit Asthma führen (Aktan 2004; Chibana et al. 2008).
Bereits in frühen Studien wurde deutlich, dass das fraktionierte exhalierte FeNO abhängig von der Flussrate der Ausatemluft ist (Hogman et al. 1997; Silkoff et al. 1997). Somit muss unter definierten und gut kontrollierten Bedingungen FENO in der Ausatemluft gemessen werden, um Entzündungen der Atemwege verlässlich zu erfassen (Grob u. Dweik 2008). Diese
Erkenntnisse führten zur Entwicklung umfassender Richtlinien für den genauen Nachweis von FENO, die unentbehrlich für die Etablierung eines zuverlässigen Atemtests für Asthma und ausschlaggebend für den Erfolg des Tests waren und noch heute gelten. Heute gibt es kommerzielle, zielgerichtete Geräte – wie zum Beispiel das NIOX®-System von Aerocrine AB (Solna, Sweden) – zur Erfassung von FENO als quantitatives, nichtinvasives und unkompliziertes Verfahren zur Messung von Atemwegsentzündungen in Bezug auf Asthma und zur Therapiekontrolle.
In der Pädiatrie ermöglichen endogene Marker im Atemgas eine Früherkennung und dadurch eine zeitnahe Therapie von schwerem Neugeborenenikterus. Beim Abbauprozess von Häme entstehen in gleichen Mengen Kohlenstoffmonoxid (CO) und Bilirubin. Um die neurotoxischen Wirkungen des Bilirubins zu vermeiden, ist eine Früherkennung nötig. Neben der klassischen Diagnostik kann das endtidale Kohlenmonoxid (ETCO) in der Atemluft mit kommerziellen Geräten wie dem CoSense® Kohlenmonoxid Monitor (Capnia, Inc., Redwood City, CA, USA) gemessen werden (Bhatia et al. 2020).
Exogene Biomarker – isotopenmarkierte Substrate als In-vivo-Sonden
Im Gegensatz zu endogenen Substanzen stellen Substanzen exogenen (körperfremden) Ursprungs den Großteil in der Ausatemluft dar. Zu den bedeutsamsten Quellen gehören dabei Bestandteile der Umgebungsluft und aus der Nahrung sowie Bestandteile von Arzneimitteln, die eingenommen oder verabreicht werden. Neben dem weitverbreiteten Alkoholtest sowie dem Wasserstoffatemtest für die Bestimmung von Laktoseintoleranz gibt eine Reihe Atemtests, die auf Basis der Verabreichung isotopenmarkierter Kohlenstoff-(13C)-Substrate medizinische Anwendung finden. Sie besitzen das Potenzial, als klinisch relevante diagnostische Methode zu dienen, insbesondere bei der Bewertung von Enzymaktivitäten und Polymorphismen (Modak 2010).
Die verbreitetste Anwendung des isotopenmarkierten Substrat-Tests stellt der 13C-Harnstoff-Atemtest dar. Mindestens 50% der Weltbevölkerung sind von einer gastroduodenalen H. pylori-Infektion betroffen, wobei große Mengen des Enzyms Urease produziert werden, das wiederum Harnstoff im Magen hydrolysiert.
Zusätzlich befinden sich 13C-Atemtests zur Messung von Insulinresistenz, bakterieller Überbesiedlung, Pankreasinsuffizienz und weiterer gastrointestinaler Funktionen in der Forschungs- und Entwicklungsphase, deren klinische Wertigkeit und Zulassung noch nicht abgeschätzt werden kann (Modak 2020).
Ausblick – Zeitabhängige Veränderungen im Atemprofil
Ausatemluft enthält eine Vielzahl endogener und exogener Biomarker, die ein großes Potenzial für medizinisches Screening und therapeutisches Monitoring bieten. Aktuell sind nur wenige Anwendungen medizinisch oder behördlich zugelassen (➥ Abb. 2). Neben den genannten Beispielen sind mehrere vielversprechende Ansätze derzeit Gegenstand der Forschung. Im Zuge des „severe acute respiratory syndrome coronavirus type 2“ (SARS-CoV-2) Ausbruchs und der damit verbundenen Coronavirus- (COVID-19-)Pandemie ist die Atemgasforschung in das Zentrum der Aufmerksamkeit gerückt. Dabei besitzt Ausatemluft das Potenzial zur direkten Detektion des luftübertragbaren Virus oder zur Bestimmung einer Infektion, was aktuell als Alternative zu bestehenden Methoden der nasopharyngealen beziehungsweise oropharyngealen Schleimsekretabstriche oder zu serologischen Proben untersucht wird (Sawano u. Beauchamp 2022). Erwähnenswert ist der kürzlich von der FDA zugelassene COVID-19-Atemgastest: Das InspectIR COVID-19 Breathalyzer Gerät (InspectIR Systems, LLC, TX, USA) ist ein qualitativer Assay für den Nachweis von fünf Atemgasmetaboliten, die in Verbindung mit einer COVID-19-Infektion stehen. Dennoch bleibt abzuwarten, ob das Gerät eine ausreichend hohe Robustheit besitzt, um zukünftig routinemäßig Anwendung in der Arbeitsmedizin zu finden.
Der Fokus in der Atemgasanalytik richtet sich vermehrt auf die Untersuchung von zeitabhängigen beziehungsweise dynamischen Konzentrationsänderungen von flüchtigen Verbindungen in Atemprofilen, die das Potenzial haben, Rückschlüsse auf physiologische Zustände zu erlauben, anstelle einer Identifizierung eines bestimmten Biomarkers im Atemgas. Somit ist die Atemgasanalytik eine vielversprechende Methode, um in Echtzeit Veränderungen des Exhaloms direkt zu monitoren und um Informationen über Therapiewirksamkeit beziehungsweise Krankheitsverslauf oder -diagnostik zu ermöglichen (➥ Abb. 3)
Interessenkonflikt: Das Autorenteam gibt an, dass keine Interessenkonflikte vorliegen.

Foto: IONICON Analytik Ges.m.b.H, Innsbruck, AT
Literatur
Aktan F: iNOS-mediated nitric oxide production and its regulation. Life Sci 2004; 75: 639–653.
Basanta M, Ibrahim B, Dockry R, Douce D, Morris M, Singh D, Woodcock A, Fowler SJ: Exhaled volatile organic compounds for phenotyping chronic obstructive pulmonary disease: a cross-sectional study. Respir Res 2012; 13: 72.
Basanta M, Jarvis RM, Xu Y et al.: Non-invasive metabolomic analysis of breath using differential mobility spectrometry in patients with chronic obstructive pulmonary disease and healthy smokers. Analyst 2010; 135: 315–320.
Beale DJ, Jones OA, Karpe AV, Dayalan S, Oh DY, Kouremenos KA, Ahmed W, Palombo EA: A review of analytical techniques and their application in disease diagnosis in breathomics and salivaomics research. Int J Mol Sci 2016; 18 (1).
Beauchamp JD, Miekisch W 2020. Breath sampling and standardization. In: Beauchamp JD, Davis C, Pleil J (Hrsg.): Breathborne biomarkers and the human volatilome. Amsterdam, Netherlands: Elsevier, 2020, S. 23–41.
Beauchamp JD, Davis C, Pleil J (Hrsg.): Breathborne biomarkers and the human volatilome. Amsterdam, Netherlands: Elsevier, 2020.
Bhatia A, Chua MC, dela Puerta R, Rajadurai VS: Noninvasive detection of hemolysis with ETCOc measurement in neonates at risk for significant hyperbilirubinemia. Neonatology: 2020; 1–7.
Chibana K, Trudeau JB, Mustovitch AT, Hu H, Zhao J, Balzar S, Chu HW, Wenzel SE: IL-13 induced increases in nitrite levels are primarily driven by increases in inducible nitric oxide synthase as compared with effects on arginases in human primary bronchial epithelial cells. Clin Exp Allergy 2008; 38: 936–946.
Crowe SE: Helicobacter pylori infection. N Engl J Med 2019; 380: 1158–1165.
Davis MD, Fowler SJ, Montpetit AJ: Exhaled breath testing – A tool for the clinician and researcher. Paediatr Respir Rev 2019; 29: 37–41.
Drabińska N, Flynn C, Ratcliffe N et al.: A literature survey of all volatiles from healthy human breath and bodily fluids: the human volatilome. J Breath Res 2021; 15: 034001.
Grob NM, Dweik RA: 2008. Exhaled nitric oxide in asthma: from diagnosis, to monitoring, to screening: are we there yet? Chest 2008; 133: 837–839.
Herbig J, Beauchamp JD: Towards standardization in the analysis of breath gas volatiles. J Breath Res 2014; 8: 037101.
Hogman M, Stromberg S, Schedin U, Frostell C, Hedenstierna G, Gustafsson LE: Nitric oxide from the human respiratory tract efficiently quantified by standardized single breath measurements. Acta Physiol Scand 1997; 159: 345–346.
Ibrahim B, Basanta M, Cadden P, Singh D, Douce D, Woodcock A, Fowler SJ: Non-invasive phenotyping using exhaled volatile organic compounds in asthma. Thorax 2011; 66: 804–809.
Kim K-H, Jahan SA, Kabir E: A review of breath analysis for diagnosis of human health. TrAC Trends in Analytical Chemistry 2012; 33: 1–8.
Malfertheiner P, Megraud F, O’Morain C et al.: Current concepts in the management of Helicobacter pylori infection: the Maastricht III Consensus Report. Gut 2007; 56: 772–781.
Modak AS: Breath biomarkers for personalized medicine. Person Med 2010; 7: 643–653.
Modak AS: 13C breath tests. In: Beauchamp JD, Davis C, Pleil J (Hrsg.): Breathborne biomarkers and the human volatilome. Amsterdam, Netherlands: Elsevier, 2020, S. 273–287.
Nathan C, Xie Q: Nitric oxide synthases: roles, tolls, and controls. Cell 1994; 78: 915–918.
Nocon M, Kuhlmann A, Leodolter A, Roll S, Vauth C, Willich SN, Greiner W: Efficacy and cost-effectiveness of the 13C-urea breath test as the primary diagnostic investigation for the detection of Helicobacter pylori infection compared to invasive and non-invasive diagnostic tests. GMS Health Technology Assessment 2009; 5.
Pham Y Lan, Beauchamp J: Breath Biomarkers in Diagnostic Applications. Molecules 2021; 26: 5514.
Pijnenburg MWH, De Jongste JC: Exhaled nitric oxide in childhood asthma: a review. Clin Exp Allergy 2008; 38: 246–259.
Pleil JD, Stiegel MA, Risby TH: 2013. Clinical breath analysis: discriminating between human endogenous compounds and exogenous (environmental) chemical confounders. J Breath Res 2013; 7: 017107.
Sawano M, Beauchamp JD (Hrsg.): Breath Research on COVID-19 and Related Applications: Developments, Discoveries and Deliberations. 2022 (Aus: https://iopscience.iop.org/journal/1752-7163/page/Breath_Research_on_CO…).
Silkoff PE, McClean PA, Slutsky AS et al.: Marked flow-dependence of exhaled nitric oxide using a new technique to exclude nasal nitric oxide. Am J Respir Crit Care Med 1997; 155: 260–267.
doi:10.17147/asu-1-204744
Kernaussagen
Definitionen
Koautor
Kontakt
Das PDF dient ausschließlich dem persönlichen Gebrauch! - Weitergehende Rechte bitte anfragen unter: nutzungsrechte@asu-arbeitsmedizin.com.