COVID-19 is vaccine-preventable – but it depends on the right vaccine strategy. A narrative review
Objective: The article gives an overview of the effectiveness of available COVID-19 vaccines, as well as vaccination willingness and vaccine breakthrough infections among health care workers during the Delta wave. It also presents the relevant study findings that justify a recommendation for a COVID-19 booster vaccination, along with the latest research on the current spread of the Omicron variant.
Methods: Several databases (PubMed, MedRxiv), search engines (Google Scholar, Google) and the websites of the Robert Koch Institute and the German Medical Journal were searched for relevant publications covering the period July to December 2021.
Results: COVID-19 vaccines licensed in Germany provide reliable protection against severe courses and deaths. However, protection against SARS-CoV-2 infection decreases significantly over time. Booster jabs restore vaccine protection and may also protect against infection with the Omicron variant in the first few months after immunisation. Vaccination readiness among health care workers (HCW) is high; secondary infections after breakthrough infection with the Delta variant are rare among HCW.
Conclusion: Vaccination, along with other measures, is a key strategy for pandemic containment. Vaccine efficacy and effectiveness should be constantly monitored and reassessed in the face of new variants.
Keywords: vaccine effectiveness – COVID-19 booster jabs – Delta variant – Omicron variant – health care workers
ASU Arbeitsmedizin Sozialmedizin Umweltmedizin 2022; 57: 163–169
doi:10.17147/asu-1-174363
COVID-19 ist impfpräventabel – aber es kommt auf die richtige Impfstrategie an. Ein narratives Review
Zielstellung: Im Folgenden wird ein Überblick über die Impfeffektivität der verfügbaren COVID-19-Impfstoffe sowie über die Impfbereitschaft und Impfdurchbrüche bei Beschäftigten im Gesundheitswesen während der Delta-Welle gegeben. Außerdem werden die relevanten Studienergebnisse vorgestellt, die eine Empfehlung für eine COVID-19-Booster-Impfung begründen, sowie die jüngsten Untersuchungen zu der sich aktuell ausbreitenden Omikron-Variante.
Methode: Für den Zeitraum Juli bis Dezember 2021 wurden mehrere Datenbanken (PubMed, MedRxiv), Suchmaschinen (Google Scholar, Google) sowie die Websites des Robert Koch-Instituts und des Deutschen Ärzteblatts nach relevanten Veröffentlichungen durchsucht.
Ergebnisse: Die in Deutschland zugelassenen COVID-19-Impfstoffe schützen zuverlässig vor schweren Verläufen und Todesfällen. Der Schutz vor einer
SARS-CoV-2-Infektion nimmt jedoch mit der Zeit signifikant ab. Booster-Impfungen stellen den Impfschutz wieder her und können womöglich in den ersten Monaten nach der Immunisierung auch vor einer Infektion mit der Omikron-Variante schützen. Die Impfbereitschaft bei Beschäftigten im Gesundheitsdienst (BiG) ist hoch; Sekundärinfektionen nach Impfdurchbruch bei der Delta-Variante sind bei BiG selten.
Schlussfolgerung: Die Impfung ist, neben anderen Maßnahmen, eine Schlüsselstrategie zur Eindämmung der Pandemie. Die Wirksamkeit und Effektivität der Impfstoffe sollte angesichts neuer Varianten ständig überwacht und neu geprüft werden.
Schlüsselwörter: Impfeffektivität – COVID-19-Booster-Impfungen – Delta-Variante – Omikron-Variante – Beschäftigte im Gesundheitswesen
Einleitung
In den Sommermonaten Juni und Juli 2021 wurde ein Anstieg der COVID-19-Fälle in mehreren Ländern beobachtet, hauptsächlich hervorgerufen durch die Variance of Concern (VOC) B.1.617.2 (Delta) des „Severe Acute Respiratory Syndrome Coronavirus 2“ (SARS-CoV-2), die gegen Ende des Jahres das Infektionsgeschehen dominiert hat. Auch in Ländern mit hoher Durchimpfungsrate verursachte die Delta-Variante weiterhin eine hohe Zahl von SARS-CoV-2-Infektionen. Das Vorhandensein von Mutationen wie L452R und P681R in der Rezeptorbindungsdomäne des SARS-CoV-2-Spike-Proteins der Delta-Variante ist nachweislich mit einer höheren Übertragbarkeit assoziiert (Cherian et al. 2021). Die Delta-Variante weist eine kürzere Inkubationszeit, eine größere Viruslast, eine längere Dauer der Virusausscheidung, eine geringere Empfindlichkeit gegenüber neutralisierenden Antikörpern und ein größeres Risiko für schwere Verläufe, Hospitalisierung und Mortalität auf (Fisman et al. 2021; Luo et al. 2021; Tenforde et al. 2021; Wang et al. 2021). Da bei keinem der verfügbaren Impfstoffe die Impfeffektivität (IE) 100 % beträgt, war zu erwarten, dass die Anzahl der Impfdurchbrüche steigt, weil immer mehr Menschen gegen SARS-CoV-2 geimpft sind. Dennoch stellt sich die Frage, wie sich die Ausbreitung der Delta-Variante und inzwischen auch der Omikron-Variante (B.1.1.529), die erstmals am 11. und 14. November 2021 in Botswana und Südafrika entdeckt wurde, auf die Wahrscheinlichkeit von Impfdurchbrüchen auswirkt (Viana et al. 2021).
Zielstellung
Ziel der Arbeit ist es, einen Überblick über die Impfeffektivität (IE) der verfügbaren COVID-19-Impfstoffe sowie über die Impfbereitschaft und Impfdurchbrüche bei Beschäftigten im Gesundheitswesen während der Delta-Welle zu geben. Außerdem werden Daten aufgezeigt, die den Effekt der COVID-19-Booster-Impfung untersuchen. Um auch aktuelle Entwicklungen zu berücksichtigen, werden anschließend die verfügbaren Studien zur IE bezüglich der sich derzeit verbreitenden Omikron-Variante vorgestellt.
Methoden
Relevante Veröffentlichungen wurden durch eine Suche in PubMed, dem Preprint-Server MedRxiv, über die Suchmaschinen Google Scholar und Google sowie auf den Webseiten des Robert Koch-Instituts und des Deutschen Ärzteblatts (Juli bis Dezember 2021) ermittelt. Berücksichtigt wurden deutsch- und englischsprachige Publikationen mit Volltextzugang. Folgende Begriffe wurden (in englischer Sprache) verwendet: Impfeffektivität, Impfwirksamkeit, COVID-19-Impfstoffe, SARS-CoV-2, Impfbereitschaft, Beschäftigte im Gesundheitswesen, Booster-Impfung, Delta-Variante, Omikron-Variante. Eine Vielzahl von Manuskripten wurde geprüft, aber nur eine ausgewählte Anzahl wird hier zitiert, um Wiederholungen zu vermeiden und dem begrenzten Platz gerecht zu werden. Die Manuskripte wurden nach Relevanz, Größe der untersuchten Population und zeitlichem Zusammenhang mit der Delta- beziehungsweise Omikron-Welle ausgewählt.
Ergebnisse
Impfeffektivität gegenüber Delta-Variante und Viruslast bei Durchbruchinfektionen
Vor der Zulassung eines Impfstoffs wird seine Schutzwirkung in klinischen Wirksamkeitsstudien unter kontrollierten Bedingungen geprüft. Nach der (bedingten) Zulassung werden aus ethischen und logistischen Gründen zur Überwachung der Impfstoffeffektivität in der Regel Beobachtungsstudien unter realen Bedingungen durchgeführt, so genannte Effektivitätsstudien. Dabei wird geprüft, wie gut und langfristig der Impfstoff unter anderem in bestimmten Populationen gegen symptomatische und asymptomatische Infektionen, Hospitalisierungen oder Tod schützt. Dabei kommen verschiedene Studiendesigns zur Anwendung (CDC 2021). Test-negative Fall-Kontroll-Studien stellen einen besonders effizienten Ansatz dar, da sie schnell und kostengünstig sind. Sie weisen allerdings auch einige Limitationen auf (z. B. die Auswahl der richtigen Kontrollen), die bei der Interpretation der Ergebnisse berücksichtigt werden müssen (Chua et al. 2020). Mehrere weitere Faktoren können die Einschätzungen der IE beeinflussen, wie zum Beispiel die Entstehung von neuen Varianten, nachlassende Immunität, unterschiedliches Ansprechen auf die Impfung und/oder Infektion, die Gesundheitspolitik der einzelnen Länder, das Verhalten sowie die Demografie der Bevölkerung oder weitere nicht näher bekannte Aspekte.
Im Folgenden wird über einzelne Studien berichtet, die die IE unter realen Bedingungen untersucht haben. Der Begriff Impfwirksamkeit wird verwendet, wenn es sich um kontrollierte klinische Studien handelt. Die hier vorgestellten Studien beziehen sich hauptsächlich auf die Delta-Variante.
Mehrere Studien zeigen, dass im Vergleich zu Prä-Delta-Varianten die IE bei der Vorbeugung von SARS-CoV-2-Infektionen und der Verringerung der Spitzenviruslast seit der Verbreitung der Delta-Variante nachgelassen hat, Impfdurchbrüche also wahrscheinlicher geworden sind. Je nach Studie und Impfstoff war die IE bei der Delta-Variante (53–88 %) insgesamt geringer als bei Prä-Delta-Varianten (74–94 %) (Fowlkes et al. 2021; Lopez Bernal et al. 2021; Tartof et al. 2021). Beispielsweise ist die Schutzwirkung vor Infektionen mit einer hohen Virusausscheidung (Ct-Wert < 30; IE ≥ 14 d nach der zweiten Dosis) bei BNT162b2 (BioNTech/Pfizer) von 94 % auf 84 % und bei AZD1222 (AstraZeneca) von 86 % auf 70 % zurückgegangen. Die Anzahl derjenigen, die bei einer Durchbruchinfektion größere Virusmengen ausscheiden, hat also zugenommen. Allerdings war die Wahrscheinlichkeit für einen positiven Reverse-Transcriptase-Polymerase-Chain-Reaction (RT-PCR)-Test bei Geimpften mit vorangegangener Infektion signifikant geringer als bei Geimpften ohne frühere Infektion (Pouwels et al. 2021).
Untersuchung der Viruslasten von 16.553 infizierten geimpften und ungeimpften Personen mittels RT-PCR-Test zeigen, dass die Viruslast bei vollständig geimpften Personen mit Delta-Durchbruchinfektionen innerhalb der ersten zwei Monate um das Zehnfache (95%-KI 4–30) reduziert war gegenüber den Ungeimpften. Allerdings beginnt dieser Effekt nach drei Monaten nachzulassen und ist nach sechs Monaten nicht mehr nachweisbar, das heißt, Geimpfte, die mit der Delta-Variante infiziert sind, haben dann eine ähnliche Spitzenviruslast wie Ungeimpfte (Levine-Tiefenbrun et al. 2021).
Der Ct-Wert eines PCR-Tests ist ein Maß für die vorhandene Menge der viralen RNA, die so genannte Viruslast. Die Viruslast allein reicht aber nicht aus, um die Ansteckungsfähigkeit einer positiv getesteten Person zu beurteilen. Genesene oder geimpfte Personen bilden nach dem Kontakt mit dem Erreger oder dem Impfstoff in der Regel schützende Antikörper und Immunzellen, die das Virus neutralisieren und damit die Wahrscheinlichkeit verringern, dass es weiterhin vermehrungsfähig bleibt. Zwar kann die Viruslast bei initialen Durchbruchinfektionen genauso hoch sein wie bei ungeimpften Personen mit Primärinfektion, aber die Viruslast bei Geimpften nimmt schneller ab und das ausgeschiedene Virus ist mit geringerer Wahrscheinlichkeit vermehrungsfähig als das von ungeimpften Personen ausgeschiedene Virus (Chia et al. 2021; Shamier et al. 2021). Die Ergebnisse einer Analyse (90 % Delta-Variante) von Viruslast und Virusreplikation in Zellkulturen bei 161 Durchbruchinfektionen von Beschäftigten im Gesundheitswesen deuten darauf hin, dass sich das Virus trotz gleicher Viruslast in 85 % der Proben von ungeimpften Personen mit primärer SARS-CoV-2-Infektion, aber nur in 67 % der Proben von geimpften Personen replizieren lässt. Ein positiver Impfstatus verringerte die Wahrscheinlichkeit einer Kulturpositivität signifikant. Das legt nahe, dass Geimpfte bei gleicher Viruslast weniger ansteckend sein dürften als ungeimpfte Personen (Shamier et al. 2021).
Impfeffektivität in Abhängigkeit von der Zeit nach der Impfung
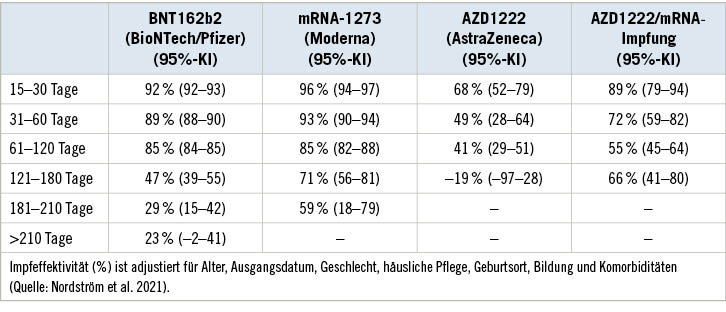
Eine nachlassende Immunität ist ein wesentlicher Grund für die mit der Zeit abnehmende IE gegen die SARS-CoV-2-Infektionen. Ein Vergleich der Infektionsraten zeigt in allen Altersgruppen eine deutliche Abnahme des Schutzes mit zunehmenden zeitlichen Abstand zur Impfung (Goldberg et al. 2021). In einer retrospektiven Kohortenstudie wurde die IE von COVID-19-Impfungen (BNT162b2, mRNA-1273, AZD1222 sowie AZD1222 und mRNA) in den ersten neun Monaten nach der zweiten Impfdosis untersucht. Das Autorenteam hat für mehr als 840.000 vollständig geimpfte Personen im Verhältnis 1:1 ungeimpfte Personen nach Geburtsjahr, Geschlecht und Wohnort zufällig ausgewählt. Die Analysen basieren auf Daten aus zwei landesweiten Registern, in denen alle Impfungen und Erkrankungen gemeldet werden müssen. Die Zeit bis zum Auftreten der Ereignisse (symptomatische Infektion/schwere Erkrankung) in Abhängigkeit vom Impfstatus wurde anhand von proportionalen Risikomodellen dargestellt und Hazard Ratios (HR) berechnet. Die IE wurde mit folgender Formel berechnet: (1 – adjustierte HR) x 100. Die IE gegen symptomatische COVID-19-Infektionen erreichte ihren Höhepunkt im ersten Monat nach der Impfung (92 %; 95%-KI 91–93 %), sank dann nach zwei Monaten geringfügig auf 89 % (95%-KI 88–89 %), ab dem dritten Monat wurde der Rückgang deutlich ausgeprägter. Ab dem 7. Monat war kein Schutz mehr nachweisbar (23 %; 95%-KI 2–41 %). Die IE war insgesamt geringer und nahm besonders schnell bei Männern (nach 180 Tagen: 17 vs. 34 % bei Frauen) und Personen über 80 Jahre (nach 120 Tagen: 50 %) ab. In Abhängigkeit des Impfstoffs und des Impfschemas verringerte sich die IE in unterschiedlichem Maße (➥ Tabelle 1). Für Ereignisse wie Hospitalisierung oder Tod lag die IE bis zu vier Monate nach der vollständigen Impfung um die 90 % und fiel nach sechs Monaten auf 42 %, wobei eine deutliche Abnahme bei Männern (52 % vs. 73 % bei Frauen), gebrechlichen Personen über 80 Jahre (51 %) und Personen mit Komorbiditäten (58 %) beobachtet wurde (Nordström et al. 2021).
Eine weitere groß angelegte Studie zum Impfschutz vor symptomatischen Infektionen zeigt, dass die Schutzwirkung für BNT162b2 nach fünf Monaten auf 70 % (95%-KI 69–71 %) und für AZD1222 auf 47 % (95%-KI 45–50 %) zurückgeht, wobei die Abnahme bei über 65-Jährigen deutlich stärker ausgeprägt ist als in der Gruppe der 40- bis 64-Jährigen (BNT162b2: 55 vs. 76 % und AZD1222: 37 vs. 58 %). Hingegen schützten die Impfstoffe auch nach fünf Monaten weiter zuverlässig vor einer Hospitalisierung. Dabei schützt BNT162b2 zu 93 % und AZD1222 zu 77 %. Insbesondere bei Personen mit einem sehr großen Risiko für Komplikationen durch eine COVID-19-Infektion nahm die IE vor der Hospitalisierung mit der Zeit signifikant ab. Personen über 65 Jahre und klinisch hochgefährdete Gruppen sollten nach Ansicht der Autoren bei Booster-Impfungen bevorzugt werden (Andrews et al. 2021b). Dies bestätigt eine bevölkerungsbezogene Kohortenstudie aus Schottland und Brasilien, die den Zusammenhang zwischen der Zeit nach zwei Dosen des Impfstoffs AZD1222 und dem Risiko einer schweren COVID-19-Erkrankung untersuchte. Verglichen zum Zeitraum des größten Schutzes,
etwa 2 bis 3 Wochen nach der zweiten Dosis, stieg das Risiko einer schweren Erkrankung nach 10 bis 11 Wochen um das Zweifache und nach 18 bis 19 Wochen auf das Fünffache. Das Autorenteam schlussfolgert, dass Schutz vor schweren Verläufen unabhängig von der Virusvariante mit der Zeit deutlich abnimmt (Katikireddi et al. 2022).
Für den mRNA-Impfstoff von Moderna (mRNA-1273) wird ebenfalls ein Rückgang der IE gegen die Delta-Variante nach fünf bis sechs Monaten bei Doppelgeimpften beobachtet: von 94 % (95%-KI 91–96 %) nach 14–60 Tagen auf 80 % (95%-KI 70–87 %) nach 151–180 Tagen (Bruxvoort et al. 2021). Hingegen wurde der hohe Schutz vor einer Hospitalisierung im Zusammenhang mit der Delta-Variante (92–98 %) in mehreren Untersuchungen bestätigt (Bruxvoort et al. 2021; Grannis et al. 2021; Self et al. 2021).
Die COVID-19-Vakzine Ad26.COV2.S von Janssen (Johnson & Johnson) erzielte in den Zulassungsstudien eine IE von 66 % gegen symptomatische Infektionen und 85 % gegen schwere Verläufe (Higdon et al. 2021). Daten aus der Praxis zeigen, dass die IE gegen eine Hospitalisierung während der Delta-Welle auf 60–68 % gesunken ist (Grannis et al. 2021; Self et al. 2021).
Verlauf bei hospitalisierten Patientinnen und Patienten mit einem Impfdurchbruch
Bei geimpften Patientinnen und Patienten, die wegen eines Impfdurchbruchs ins Krankenhaus eingeliefert wurden, war die Wahrscheinlichkeit für einen schwerwiegenden Krankheitsverlauf wie invasive Beatmung oder Tod deutlich geringer als bei ungeimpften COVID-19-Patientinnen und -Patienten (12 % gegenüber 25%; aOR = 0,33; 95%-KI 0,19–0,58). Diese Studie über hospitalisierte Erkrankte in 21 US-amerikanischen Kliniken von März bis August 2021 zeigt, dass mRNA-Impfstoffe auch bei Impfdurchbrüchen mit einer Hospitalisierung zuverlässig vor schwerwiegenden Folgen schützen. Im Vergleich zu ungeimpften Patientinnen und Patienten waren diejenigen mit Impfdurchbrüchen älter und hatten häufiger chronische Erkrankungen (Tenforde et al. 2021). Da die IE vor allem bei der Vorbeugung milder Infektionen abnimmt, kann sich auch der Schutz vor einer Hospitalisierung mit der Zeit verringern. Die Daten des Robert Koch-Instituts (RKI) zeigen, dass der Schutz vor Hospitalisierung für die Altersgruppe der über 60-Jährigen in der 28. KW noch bei etwa 90 % lag, in der 43. KW jedoch auf 80 % abfiel und inzwischen (Stand 09.12.21) nun wieder bei 90 % liegt, was darauf hinweist, dass die Booster-Impfung wirksam ist. Der Schutz vor einer Verlegung auf die Intensivstation blieb jedoch mit etwa 90 % hoch (RKI 2021b).
Antikörpertiter als möglicher Indikator für Impfeffektivität
Der Spiegel an neutralisierenden Antikörpern nach einer Infektion oder Impfung könnte ein zuverlässiger Indikator für den Immunschutz sein. Ein Team um Earle et al. (2021) stellte eine robuste Korrelation zwischen der Effektivität der COVID-19-Impfstoffe und neutralisierenden Titern (q = 0,79) sowie den bindenden Antikörpertitern (q = 0,93) fest, trotz unterschiedlicher Populationen, Assays oder Rekonvaleszenten-Seren.
Einer Schätzung zufolge sinkt der Anteil neutralisierender Antikörper in den ersten 250 Tagen nach der Immunisierung bei verschiedenen Impfstoffen kontinuierlich ab und erweist sich generell als ein signifikanter Prädiktor für den nachlassenden Immunschutz vor einer symptomatischen SARS-CoV-2-Infektion. Der Schutz vor schweren Infektionen könnte jedoch wesentlich dauerhafter ausfallen. Das Ausmaß des Schutzes hängt von der anfänglichen Wirksamkeit des Impfstoffs ab. Bei einem Impfstoff mit einer anfänglichen Wirksamkeit von 95 % wäre beispielsweise zu erwarten, dass er nach 250 Tagen noch zu 77 % wirksam ist (Khoury et al. 2021a). So wiesen Personen, die einmal mit Ad26.COV2.S geimpft worden waren (Impfwirksamkeit 66 %), 12 Wochen nach der Impfung insgesamt niedrigere Anti-SARS-CoV-2-Antikörperspiegel auf als jene die mRNA-Impfstoffe erhielten (Atmar et al. 2021; Self et al. 2021). In einem Laborexperiment wurden neutralisierende Antikörper aus Serumproben von geimpften Personen untersucht, deren Impfung drei Monate zurücklag. Die mRNA-basierten Impfstoffe BNT162b2 und mRNA-1273 erzielten 7-fach höhere Titer gegen die Delta-Variante als der Ad26.COV2.S-Impfstoff von Janssen (191 beziehungsweise 208 vs. 30 IC50 Titers) (Tada et al. 2021). Die schwächere neutralisierende Wirkung im Labor könnte auch mit einem verminderten Schutz gegen symptomatische Erkrankungen und Hospitalisierungen zusammenhängen. So ist der prozentuale Anteil von COVID-19-Durchbruchinfektionen nach einer Impfung bei den Personen am höchsten, die mit Ad26.COV2.S geimpft wurden, was auf einen mangelhaften primären Impfschutz hindeutet. In der aktualisierten Impfempfehlung der Ständigen Impfkommission (STIKO) vom 18.10.21 wird diesen Personen, unabhängig vom Alter, eine zweite Impfung mit einem mRNA-Impfstoff bereits nach der vierten Woche empfohlen (STIKO 2021).
Impfbereitschaft bei Beschäftigten im Gesundheitsdienst
Die hohe Übertragbarkeit und Virulenz der Delta-Variante sowie der zeitliche Abstand zur Impfung stellen ein erhebliches Problem für die Exposition im Gesundheitswesen dar. Erfreulicherweise ist die Impfbereitschaft der Beschäftigten im Gesundheitswesen im vergangenen Jahr deutlich gestiegen. Je nach Studie, Berufsgruppe und Befragungszeitraum gaben zu Beginn der Impfkampagne noch 57–84 % an, sich impfen lassen zu wollen (Janssens et al. 2021; Kozak et al. 2021; Nohl et al. 2021). Nach einer repräsentativen krankenhausbasierten Onlinebefragung zur COVID-19-Impfung (KROCO), die das RKI zwischen dem 18. Oktober und 15. November 2021 mit insgesamt 16.069 Teilnehmenden aus 104 Einrichtungen durchgeführt hat, sind inzwischen 92 % des Personals vollständig, 4 % unvollständig und 4 % nicht geimpft. Zum Befragungszeitpunkt gaben 16 % an, bereits eine Booster-Impfung erhalten zu haben. Vom ärztlichen Personal waren 95 % und vom Pflegepersonal 89 % vollständig geimpft. 83 % der ungeimpften Beschäftigten (n = 626) hatten eine ablehnende Haltung gegenüber der COVID-19-Impfung. Die Impfbereitschaft für eine Booster-Impfung war mit 82 % bei den vollständig geimpften Personen (n = 12.181) hingegen hoch. Die häufigsten Gründe für eine ablehnende oder zögernde Haltung waren aufgetretene Impfreaktionen und Nebenwirkungen, die Antikörpertiter wurden als ausreichend eingeschätzt oder die Notwendigkeit einer Booster-Impfung wurde hinterfragt. Zum Befragungszeitpunkt gab es jedoch keine allgemeine Empfehlung für eine Booster-Impfung (RKI 2022a).
Bisher gibt es wenige Veröffentlichungen über die Impfbereitschaft für eine Booster-Impfung bei Beschäftigten im Gesundheitswesen. Eine Studie aus den USA gibt die allgemeine Bereitschaft mit 84 % an (Pal et al. 2021). Weitere Studien aus der Tschechischen Republik und Saudi-Arabien weisen eine Impfbereitschaft von 71 % beziehungsweise 55 % auf (Alhasan et al. 2021; Klugar et al. 2021).
Durchbruchinfektionen bei Beschäftigten in Gesundheitsberufen während der Delta-Welle
Mit zunehmender Durchimpfung der Beschäftigten im Gesundheitswesen wird der Anteil der geimpften Personen an den COVID-19-Fällen steigen, insbesondere in Regionen mit hohen SARS-CoV-2-Übertragungsraten. Zudem nimmt der Infektionsschutz mit zunehmendem Abstand zur zweiten Impfdosis nachweislich ab. Folglich werden vermehrt Durchbruchinfektionen in diesem Berufsfeld beobachtet. Viele Einrichtungen bieten ihren Beschäftigten inzwischen eine Booster-Impfung an, um den ursprünglich hohen Infektionsschutz wiederherzustellen. Im Folgenden wird eine Übersicht zu Durchbruchinfektionen in Gesundheitsberufen während der Delta-Welle präsentiert, um die Häufigkeit und Schwere dieser Durchbrüche besser einordnen und daraus entsprechende Maßnahmen ableiten zu können.
In einer als Preprint veröffentlichten Metaanalyse errechneten die Autoren für vollständig geimpfte und ungeimpfte Beschäftigte im Gesundheitswesen eine Inzidenz von 1,3 % (95%-KI 0,6–2,9 %) beziehungsweise 10 % (95%-KI 4,5–19,5 %) (Chandan et al. 2021). Es wurden jedoch Studien berücksichtigt, die hauptsächlich zu Beginn der Impfkampagne und in der Zeit vor der Delta-Welle durchgeführt worden waren.
Eine laufende Untersuchung der HEROES-RECOVER-Kohorten aus sechs US-Bundesstaaten ergab, dass die IE während der Delta-Periode 66 % (95%-KI 26–84 %) und in den Monaten vor der Delta-Prävalenz 91 % (95%-KI 81–96 %) betragen hatte (Fowlkes et al. 2021). Eine weitere Untersuchung aus Massachusetts mit 4615 Beschäftigten im Gesundheitswesen zeigte, dass im Zeitraum von Juli bis September die Inzidenzrate bei geimpften und ungeimpften Personen 1,3 beziehungsweise 5,8 pro 10.000 Personentage betrug. Dies entsprach einer IE von 77 % (95%-KI 41–91 %). Es wurden keine sekundären Infektionen bei Genesenen festgestellt, was auf eine robuste natürlich erworbene Immunität hindeutet. Darüber hinaus wurden keine Durchbruchinfektionen bei Beschäftigten festgestellt, die zuvor infiziert und anschließend durch eine Impfung immunisiert worden waren (Lan et al. 2021).
Mit zeitlichem Abstand sinkt auch der Impfschutz vor Neuinfektionen bei Beschäftigten im Gesundheitswesen. Vorläufige Ergebnisse einer Kohortenstudie aus Finnland zwischen Dezember 2020 und Oktober 2021 zeigen, dass der Impfschutz nach sechs Monaten für mRNA-Empfänger auf 53 % (95%-KI 43–62 %) und für Empfänger heterologer Impfung (vier bis sechs Monate) auf 62 % (95%-KI 30–79 %) zurückgeht (Poukka et al. 2021).
Schweregrad der Erkrankung bei Beschäftigten im Gesundheitswesen
Impfstoffe verringern nicht nur die Übertragung, sondern auch den Schweregrad der Erkrankung bei infizierten Beschäftigten während der Delta-Periode. In mehreren Berichten wurde bestätigt, dass die Krankheit in fast allen untersuchten Fällen mild oder asymptomatisch verlief, was die Wirksamkeit der verabreichten Impfstoffe beim Schutz vor schwerer Krankheit unterstreicht (Chau et al. 2021; Shamier et al. 2021; Susky et al. 2021). In einer registergestützten Kohortenstudie aus Finnland, die alle Beschäftigten des Gesundheitswesens umfasste, wurde festgestellt, dass der Schutz vor Hospitalisierung in der Delta-Periode für die mRNA- beziehungsweise Vektor- und mRNA-Impfung 98 % und 100 % beträgt (Poukka et al. 2021).
Sekundärfälle nach Impfdurchbruch bei Beschäftigten im Gesundheitswesen
Es gibt wenige epidemiologische Untersuchungen zur Übertragung der SARS-CoV-2-Delta-Variante unter überwiegend vollständig geimpften Beschäftigten sowie Patientinnen und Patienten in Gesundheitseinrichtungen. Diese Daten sind aber wichtig, um weitere Maßnahmen zur Infektionskontrolle in diesen Settings zu planen und durchzuführen. Hier werden exemplarisch einige wenige Studien zum Ausbruchsgeschehen in der Delta-Welle vorgestellt.
Während der Delta-Welle wurden zwischen Juni und Juli im Bundestaat Kalifornien 11.836 Beschäftigte von vier großen medizinischen Zentren (Impfquoten zwischen 72 und 91 %) auf SARS-CoV-2 getestet. Von den getesteten Personen wiesen 3,7 % (440/11.836) eine bestätigte SARS-CoV-2-Infektion auf, wobei die Gesamtdurchbruchsrate bei den geimpften Beschäftigten 0,43 % (309/72.624) betrug. Insgesamt 535 Personen in vier Krankenhäusern wurden durch Nachverfolgung als Kontaktpersonen von infizierten geimpften Beschäftigten identifiziert. Der Gesamtanteil der Sekundärfälle, die auf eine Durchbruchinfektion hindeuten, lag bei 0,75 % (4/535) und zwar hauptsächlich dann, wenn die Beschäftigten in geschlossenen Räumen ohne Maske zusammen gegessen hatten (Waldman et al. 2021).
Weitere Ausbruchsuntersuchungen im Gesundheitssektor mit der Delta-Variante legen nahe, dass nosokomiale Transmissionen ausgehend von geimpften Beschäftigten zwar vorkommen, aber selten sind. Sie fanden in Räumen statt, die wenig belüftet waren oder während der Pausen beim Essen. In den meisten dokumentierten Fällen wurden die Ausbrüche überwiegend durch Patientinnen und Patienten verursacht (Chau et al. 2021; Hetemäki et al. 2021; Susky et al. 2021).
Frühere Infektion und Impfung bei Beschäftigten im Gesundheitswesen
Beschäftigte im Gesundheitsdienst mit einer früheren SARS-CoV-2-Infektion konnten ihren Immunschutz durch eine vollständige Impfung mit dem mRNA-Impfstoff verstärken und verlängern. Sie entwickelten signifikant höhere IgG-Spike-Antikörperwerte als Personen, die lediglich die zweifache Impfung erhalten hatten. Nach einem, drei und sechs Monaten waren die Titer um 14 %, 19 % beziehungsweise 56 % höher (Zhong et al. 2021). In einer weiteren Untersuchung wurden die Antikörperantworten auf zwei Dosen des BNT162b2-Impfstoffs zwischen genesenen Beschäftigten und solchen ohne frühere Infektion verglichen. Die Genesenen wiesen zehn Monate nach der Diagnose eine robuste Antikörperantwort auf die erste Impfdosis auf: 126-facher Anstieg der Antikörperspiegel. Dies galt sogar für diejenigen, die vor der Impfung keine Antikörper hatten. Eine zweite Dosis führte nicht zu einer signifikanten Verbesserung der Antikörperreaktion bei Genesenen. Die „immunnaiven“ Beschäftigten benötigten dagegen die zweite Dosis, um den Spitzenwert an Anti-Spike-IgG-Titer zu erreichen (16-facher Anstieg). Ihre Antikörperspiegel waren auch zwei Monate nach Abschluss des Impfprotokolls niedriger als die Spitzenwerte der geimpften Genesenen (6595 AU/ml vs. 25.003 AU/ml; p < 0,001) (Ontañón et al. 2021). Eine ähnliche Beobachtung machten auch Gray et al. (2021a), mit dem Unterschied, dass 25 % der Immunkompetenten nach der ersten Dosis den Schwellenwert für hohe neutralisierende Anti-Spike-IgG-Titer von 3950 AU/ml nicht erreicht hatten und erst nach der zweiten Impfdosis den Schwellenwert erreichten. Bereits eine einzige Dosis des mRNA-Impfstoffs kann bei seropositiven Personen eine schnelle und robuste Immunreaktion auslösen. Eine weitere Dosis ist ebenfalls sinnvoll, weil nicht alle eine hohe Antikörperkonzentration nach der ersten Dosis erreichen.
Effekt der COVID-19-Booster-Impfung
Das wirksamste Impfschema gegen COVID-19 ist noch nicht bekannt, da sich die Daten aufgrund der nachlassenden Immunität im Laufe der Zeit und des Auftretens neuer Varianten ständig weiterentwickeln. In einem Interview mit dem SPIEGEL stellt der Immunologe Carsten Watzl, Generalsekretär der Deutschen Gesellschaft für Immunologie (DGfl), klar, dass die Immunisierung nach der zweiten Impfung noch nicht abgeschlossen ist. Seiner Einschätzung nach ist die Grundimmunisierung erst nach einer Dreifachimpfung erreicht. Er verweist auf das Impfschema anderer Impfungen, etwa gegen Diphterie oder Tetanus, bei denen auf die erste Impfung die zweite nach ein bis zwei Monaten und die dritte nach einem halben Jahr folgt. Weiter führte er aus, dass „in einer Pandemie man nicht die Zeit hat, um jahrelang nach dem allerbesten Impfschema zu suchen, wie wir es normalerweise tun würden“ (SPIEGEL 2021). Mehrere übereinstimmende Analysen aus klinischen Studien zur Immunogenität der Booster-Impfung haben gezeigt, dass alle hier zugelassenen Impfstoffe die humorale Reaktion verbessern. Dadurch wurden sowohl die Antikörperantwort als auch die T-Zell-Reaktion verstärkt (Atmar et al. 2021; Choi et al. 2021; Falsey et al. 2021). Abhängig von der Geschwindigkeit, mit der sich das Virus ändert, könnten ähnlich wie bei der Influenza jährliche Impfungen notwendig sein.
Aufgrund zunehmender SARS-CoV-2 Fälle, auch bei vollständig Geimpften, deren Impfung länger zurücklag, und angesichts der sich rasch ausbreitenden Delta-Variante hat Israel als erstes Land der Welt bereits im Juli 2021 mit einer Auffrischungsimpfung für Menschen über 60 Jahre begonnen. Für den Zeitraum von Juli bis Oktober analysierten Bar-On und Kollegen Daten des israelischen Gesundheitsministeriums, die mehr als 4,5 Millionen Menschen betrafen. Sie stellten fest, dass bereits 12 Tage nach der Booster-Impfung die Rate der PCR-bestätigten Infektionen um den Faktor 10 niedriger war als in der Gruppe ohne Booster. Bei den über 60-Jährigen und den 40- bis 60-Jährigen war die Rate der schweren Erkrankungen um das 19- und 22-fache niedriger. Die Rate der COVID-19-assoziierten Todesfälle war bei den über 60-Jährigen um das 15-fache gesunken (Bar-On et al. 2021). In einer weiteren populationsbasierten Fall-Kontroll-Studie in Israel mit mehr als 1,5 Millionen Versicherten wurde die IE der Booster-Impfungen für den Zeitraum Juli bis Ende September ermittelt. In der Booster-Gruppe traten nach sieben Tagen 514 symptomatische Infektionen auf, in der Kontrollgruppe, deren Impfung mindestens fünf Monate zurücklag, wurden 3345 Fälle registriert, was einer IE von 91 % (95%-KI 89–92 %) entspricht. Der Schutz vor Hospitalisierung (93 %), schweren Erkrankungen (92 %) und COVID-19-bedingten Todesfällen (81 %) war ebenfalls deutlich erhöht. Der stärkste positive Effekt wurde vor allem bei den über 70-Jährigen beobachtet. Bei Personen mit Booster-Impfung war die Wahrscheinlichkeit geringer, dass sie während des Follow-up-Zeitraums (bis zu 21 Tage) positiv auf SARS-CoV-2 getestet wurden (Barda et al. 2021). In der Gruppe der Geboosterten lag die Viruslast bei den Durchbruchinfektionen im Schnitt um den Faktor 5 niedriger als bei Personen ohne Booster-Impfung (Levine-Tiefenbrun et al. 2021). Eine Studiengruppe aus England berichtet ebenfalls über eine hohe IE der Booster-Impfung gegen symptomatische Infektionen bei Personen über 50 Jahren, sie lag bei 86 % beziehungsweise 83 % nach vollständiger Impfserie mit AZD1222 und BNT162b2. Gegenüber ungeimpften Personen betrug die IE sogar 93 % beziehungsweise 94 % (Andrews et al. 2021a).
Diese Studien weisen jedoch einige Limitationen auf. So wurden potenzielle Confounder wie eine frühere COVID-19-Infektion nicht berücksichtigt. Außerdem war der Nachbeobachtungszeitraum kurz, so dass zum jetzigen Zeitpunkt keine Schlussfolgerungen möglich sind, wie lange der Immunitätsschub anhält oder wie er sich auf den Langzeitschutz in Bezug auf die B- und T-Zell-Reaktionen auswirkt. Laut Watzl kann die dritte Impfung aber vor allem die T-Gedächtniszellen stimulieren, die sich im Falle einer Infektion schnell vermehren und B-Zellen aktivieren, um erneut viele Antikörper zu produzieren. Darüber hinaus findet ein Selektionsprozess statt, indem nur die Zellen erhalten bleiben, die das Spike-Protein am besten erkennen. Watzl zufolge wird dadurch die Immunantwort weiter verbessert (SPIEGEL 2021).
Nebenwirkungen nach der COVID-19-Booster-Impfung
In klinischen Studien weisen die mRNA-Booster-Impfungen ein ähnliches Nebenwirkungsprofil wie die Zweitimpfungen auf. Lokale Reaktionen und systemische Ereignisse nach der dritten Dosis sind überwiegend leicht bis mäßig. Zu den häufigsten lokalen Reaktionen zählt Schmerzempfindlichkeit an der Einstichstelle; die häufigsten systemischen Reaktionen sind Unwohlsein, Müdigkeit, Kopfschmerzen, Muskel- und Gelenkschmerzen. In den ersten Wochen traten keine schwerwiegenden Nebenwirkungen auf (Atmar et al. 2021; Choi et al. 2021; Falsey et al. 2021). Ähnliche Nebenwirkungen zeigten sich bei dem Impfstoff AZD1222, wobei die dritte Dosis weniger reaktogen ist als die erste (Flaxman et al. 2021). Auf der V-safe-Plattform der US-Infektionsschutzbehörde CDC werden unerwünschte Reaktionen von Personen gemeldet, die die Booster-Impfung erhalten hatten. Zwischen dem 12. August und dem 19. September wurden keine unerwarteten Nebenwirkungen bei 22.191 Teilnehmenden bis zu sieben Tage nach der Impfung gemeldet. Die häufigsten dort gemeldeten Reaktionen entsprachen denen aus den klinischen Studien. Für beide mRNA-Impfstoffe wurden lokale Reaktionen häufiger und systemische Reaktionen seltener nach der dritten Dosis als nach der zweiten angegeben. Lediglich 1,8 % gaben an, dass sie medizinische Behandlung benötigt hätten (Hause et al. 2021).
Omikron-Variante und COVID-19-Booster-Impfung
Die VOC B.1.1.529 mit dem Namen Omikron wurde erstmals am 11. und 14. November 2021 in Botswana und Südafrika entdeckt und breitet sich seitdem rasant auf der ganzen Welt aus (Viana et al. 2021). In einer Metaanalyse unter Verwendung der ersten Daten zu Neutralisationstests berechneten die Autoren einen 9,7-fachen (95%-KI 5,5–17,1) Rückgang der Neutralisationstiter gegen Omikron-Variante. Basierend auf Modellberechnungen hat die Booster-Impfung mit einem mRNA-Impfstoff jedoch das Potenzial, den Schutz gegen Omikron auf 86 % (95%-KI 73–94 %) gegen symptomatische Infektionen und 98 % (90–100 %) gegen schwere Infektionen zu erhöhen. Ohne Booster liegt der Schutz vor einer symptomatischen Infektion nach 6 Monaten je nach Impfstoff zwischen 8 und 40 % (Khoury et al. 2021b). Mit dem Neutralisationstest wird die inhibitorische Wirkung neutralisierender IgG-Antikörper im Blutserum von genesenen oder geimpften Personen nachgewiesen. Diese Antikörper verhindern, dass sich das Virus über die Rezeptorbindungsdomäne des Spike-Proteins an den ACE-Rezeptor der Körperzellen anheftet und diese infiziert.
Erste Analysen einer Test-negativen Fall-Kontroll-Studie aus dem Vereinigten Königreich zeigen, dass BNT162b2 in den ersten 2–9 Wochen nach der zweiten Impfung einen Schutz von 88 % (95%-KI 66–96 %) gegen Omikron erreicht. Nach 10–14 Wochen und nach 15 Wochen sinkt die Schutzwirkung auf 49 % beziehungsweise 37 %. Personen, die mit AZD1222 geimpft wurden, hatten nach 15 Wochen keinen Schutz gegen Omikron. Allerdings, zwei Wochen nach der Booster-Impfung mit BNT162b2 stieg die IE bei AZD1222-geimpften Personen auf 71 % (95%-KI 42–86 %) und bei BNT162b2-geimpften Personen auf 76 % (95%-KI 56–86 %). Es ist jedoch zu beachten, dass nur 581 Omikron-Fälle in die Analyse einbezogen wurden. Alle Omikron-Schätzungen sind mit erheblichen Unsicherheiten behaftet und weisen große Konfidenzintervalle auf (Andrews et al. 2021c).
Eine Booster-Impfung mit dem mRNA-1273-Impfstoff von Moderna (50 µg) zeigte nach zwei Wochen ebenfalls deutlich ausgeprägte Omikron-Neutralisationstiter (12-fache Verbesserung beobachtet). Die Autoren kommen zu dem Schluss, dass diese Immunreaktion das Infektionsrisiko verringern oder das Risiko schwerer Verläufe minimieren kann (Doria-Rose et al. 2021).
Weitere vorläufige Daten zur Booster-Impfung 6–9 Monate nach der Grundimmunisierung mit dem Vektorimpfstoff Ad26.COV.2 weisen auf eine hohe IE in Bezug auf Hospitalisierung aufgrund einer Omikron-Infektion hin. In einer Test-negativen Fall-Kontroll-Studie wurden zwischen dem 15. November und dem 20. Dezember 2021 mehr als 69.000 BiG mit einer Gruppe von ungeimpften Personen verglichen. Die berechnete IE lag 14–27 Tage nach der zweiten Dosis bereits bei 84 % (95%-KI 67–92 %) und blieb zwei Monate nach der Auffrischung auf diesem hohen Niveau (85 %; 95%-KI 54–95 %) (Gray et al. 2021b).
Trotz der starken Übertragbarkeit der Omikron-Variante mehren sich Hinweise, dass sie im Vergleich zur Delta-Variante weniger schwere Verläufe verursacht. So wurden beispielsweise in Ontario Hospitalisierungen und Todesfälle im Zusammenhang mit der Omikron-Variante (n = 11.622) mit Delta-infizierten Fällen (n = 14.181) in einer gematchten Kohortenstudie verglichen. Gegenüber Delta-Fällen war das Risiko für eine Hospitalisierung oder Tod um 65 % verringert (HR 0,35; 95%-KI 0,26–0,46) und das Risiko einer Verlegung auf die Intensivstation oder Tod um 83 % (HR 0,17; 95%-KI 0,08–0,37) verringert (Ulloa et al. 2022). Auch eine Untersuchung aus Südafrika bestätigt, dass das Risiko für eine Hospitalisierung um etwa 80 % geringer war als bei Personen, die sich mit anderen Varianten infiziert hatten. Die Autoren vermuten, dass die hohe Immunität in der Bevölkerung aufgrund früherer Infektionen oder Impfungen wahrscheinlich für den Rückgang der schweren Erkrankungen ausschlaggebend ist (Wolter et al. 2021).
Schlussfolgerung
Die Impfung bleibt eine Schlüsselstrategie zur Bekämpfung der COVID-19-Pandemie. Angesicht der hohen Delta-Infektiosität und der nachlassenden Immunität sowie der Entstehung neuer besorgniserregender Varianten wie Omikron müssen Wirksamkeit und Effektivität der zugelassenen Impfstoffe ständig überwacht und neu bewertet werden. Der erwartete Rückgang der Impfstoffeffektivität sollte von einer weiteren Impfkampagne zu Auffrischungsimpfungen und gegebenenfalls wirksamen Eindämmungsstrategien begleitet werden.
Es zeigt sich, dass der Impfschutz durch die mRNA-Impfstoffe sowie durch heterologe Impfserien besser und länger anhaltend ist als bei den Vektorimpfstoffen. Der mRNA-1273-Impfstoff von Moderna scheint auch über längere Zeit zuverlässig gegen Infektionen zu schützen und einen langanhaltenden hohen Schutz vor Hospitalisierung zu bieten. Womöglich liegt es an einem höheren mRNA-Gehalt und einem größeren Dosisintervall als bei BNT162b2-Impfungen, deren Wirksamkeit nach drei Monaten stärker abzunehmen scheint. Eine durchgemachte Infektion scheint die Wirksamkeit der Impfung zu erhöhen, schützt aber allein nicht zuverlässig gegen eine zweite Infektion.
Angesicht der erhöhten Übertragbarkeit und Virulenz der Delta-Variante sowie des zeitlichen Abstands zur zweiten Impfung sind Booster-Impfungen für Beschäftigte im Gesundheitswesen notwendig. Es ist anzunehmen, dass die Bereitschaft für eine Booster-Impfung beim Personal mit der Zeit zunehmen wird oder bereits groß ist. Durch die Wiederherstellung des Eigenschutzes kann auch die Virusübertragung maßgeblich gehemmt werden und der Schutz anderer wird dadurch gesteigert.
Mehrere epidemiologische Studien zeigen, dass der Impfschutz und der Schutz vor Reinfektionen gegenüber der Omikron-Variante im Vergleich zu anderen Varianten reduziert ist, das heißt, symptomatische Infektionen nehmen zu. Eine dritte Dosis erhöht den Schutz, zumindest vorläufig.
Nosokomiale Transmissionen zwischen geimpften Beschäftigten kommen vor, aber sie beschränken sich auf einzelne Fälle. Allerdings ist die Datenlage zum Ausbruchsgeschehen in der Delta-Periode noch zu dünn, um daraus konkrete Maßnahmen ableiten zu können. Es gilt aber nach wie vor, dass weitere Präventivmaßnahmen wie die Verwendung persönlicher Schutzausrüstung, umsichtiges Verhalten innerhalb und außerhalb der Gesundheitseinrichtung, regelmäßiges Lüften sowie häufiges Testen nach Auftreten von Symptomen oder bekannter Exposition gegenüber infizierten Kontaktpersonen unabdingbar sind, um das Infektionsgeschehen in den Einrichtungen zu mitigieren.
Schließlich ist eine hohe Impfquote nicht nur wichtig, um Transmissionen, schwere Verläufe und Todesfälle zu verhindern, sondern auch, um die Mutationsfähigkeit des Virus zu verringern. Einer Untersuchung zufolge besteht ein negativer Zusammenhang zwischen Durchimpfungsrate und der Mutationshäufigkeit des gesamten Genoms (R2 = 0,878) und des Spike-Gens (R2 = 0,829) der SARS-CoV-2-Delta-Varianten in 16 Ländern. Die Autoren schlussfolgern, dass eine vollständige Immunisierung gegen COVID-19 zusammen mit anderen Maßnahmen entscheidend ist, um neu auftretende Mutationen zu unterbinden (Yeh et al. 2021).
Zusammenfassend ist festzuhalten, dass die IE von der Impfstoffart, dem Impfschema, dem Intervall zwischen den Impfungen sowie der Virusvariante abhängt. Ein Teil der hier vorgestellten Literatur umfasst Peer-reviewed-Veröffentlichungen, einige jedoch nur als Preprint, bei denen eine Begutachtung noch aussteht. Daher sollten die hier vorgestellten Ergebnisse mit Vorsicht interpretiert werden. Zusammengenommen liefern diese Berichte jedoch richtungsweisende Erkenntnisse für die derzeitige Situation, die den Entscheidungsträgern bei der Impf- und Eindämmungsstrategie hilfreich sein können.
Interessenkonflikt: Es liegen keine Interessenkonflikte vor.
Literatur
Alhasan K et al.: COVID-19 Delta variant: perceptions, worries, and vaccine-booster acceptability among healthcare workers. Healthcare 2021; 9: 1566.
Andrews N et al.: Effectiveness of BNT162b2 (Comirnaty, Pfizer-BioNTech) COVID-19 booster vaccine against covid-19 related symptoms in England: test negative case-control study. medRxiv 2021a;10.1101/2021.11.15.21266341.
Andrews N et al.: Vaccine effectiveness and duration of protection of Comirnaty, Vaxzevria and Spikevax against mild and severe COVID-19 in the UK. medRxiv 2021b;10.1101/2021.09.15.21263583.
Andrews N et al.: Effectiveness of COVID-19 vaccines against the Omicron (B.1.1.529) variant of concern. medRxiv 2021c;10.1101/2021.12.14.21267615.
Atmar RL et al.: Heterologous SARS-CoV-2 booster vaccinations – preliminary report. medRxiv 2021;10.1101/2021.10.10.21264827.
Bar-On YM et al.: Protection across age groups of BNT162b2 vaccine booster against Covid-19. medRxiv 2021;10.1101/2021.10.07.21264626.
Barda N et al.: Effectiveness of a third dose of the BNT162b2 mRNA COVID-19 vaccine for preventing severe outcomes in Israel: an observational study. Lancet 2021;10.1016/S0140-6736(21)02249-2.
Bruxvoort KJ et al.: Effectiveness of mRNA-1273 against Delta, Mu, and other emerging variants. medRxiv 2021;10.1101/2021.09.29.21264199.
CDC. COVID-19 vaccine effectiveness research. https://www.cdc.gov/vaccines/covid-19/effectiveness-research/protocols… (zuletzt abgerufen am 25.01.2022).
Chandan S et al.: Postvaccination SARS-CoV-2 infection among healthcare workers – A systematic review and meta-analysis. medRxiv 2021;10.1101/2021.10.04.21264542.
Chau NVV et al.: An observational study of breakthrough SARS-CoV-2 Delta variant infections among vaccinated healthcare workers in Vietnam. EClinicalMedicine 2021; 41: 101143.
Cherian S et al.: SARS-CoV-2 spike mutations, L452R, T478K, E484Q and P681R, in the second wave of COVID-19 in Maharashtra, India. Microorganisms 2021; 9.
Chia PY et al.: Virological and serological kinetics of SARS-CoV-2 Delta variant vaccine-breakthrough infections: a multi-center cohort study. medRxiv 2021;10.1101/2021.07.28.21261295.
Choi A et al.: Safety and immunogenicity of SARS-CoV-2 variant mRNA vaccine boosters in healthy adults: an interim analysis. Nat Med 2021;10.1038/s41591-021-01527-y.
Chua H. et al.: The use of test-negative controls to monitor vaccine effectiveness: a systematic review of methodolog. Epidemiology (Cambridge, Mass.) 2020; 31: 43–64.
Doria-Rose NA et al.: Booster of mRNA-1273 vaccine reduces SARS-CoV-2 Omicron escape from neutralizing antibodies. medRxiv 2021;10.1101/2021.12.15.21267805.
Earle KA et al.: Evidence for antibody as a protective correlate for COVID-19 vaccines. Vaccine 2021; 39: 4423–4428.
Falsey AR et al.: SARS-CoV-2 neutralization with BNT162b2 vaccine dose 3. N Engl J Med 2021; 385: 1627–1629.
Fisman DN et al.: Evaluation of the relative virulence of novel SARS-CoV-2 variants: a retrospective cohort study in Ontario, Canada. CMAJ 2021; 193:E1619.
Flaxman A et al.: Reactogenicity and immunogenicity after a late second dose or a third dose of ChAdOx1 nCoV-19 in the UK: a substudy of two randomised controlled trials (COV001 and COV002). Lancet 2021; 398: 981–990.
Fowlkes A et al.: Effectiveness of COVID-19 vaccines in preventing SARS-CoV-2 infection among frontline workers before and during B.1.617.2 (Delta) variant predominance - Eight U.S. Locations, December 2020 to August 2021. Centers for Disease Control and Prevention, MMWR Morb Mortal Wkly Rep 2021; 70.
Goldberg Y et al.: Waning immunity of the BNT162b2 vaccine: A nationwide study from Israel. medRxiv 2021;10.1101/2021.08.24.21262423.
Grannis SJ et al.: Interim estimates of COVID-19 vaccine effectiveness against COVID-19-associated emergency department or urgent care clinic encounters and hospitalizations among adults during SARS-CoV-2 B.1.617.2 (Delta) Variant Predominance - Nine States, June-August 2021. MMWR Morb Mortal Wkly Rep 2021; 70.
Gray AN et al.: Humoral responses to SARS-CoV-2 mRNA vaccines: Role of past infection. PLoS One 2021a; 16: e0259703.
Gray GE et al.: Vaccine effectiveness against hospital admission in South African health care workers who received a homologous booster of Ad26.COV2 during an Omicron COVID19 wave: Preliminary Results of the Sisonke 2 Study. medRxiv 2021b;10.1101/2021.12.28.21268436.
Hause A et al.: Safety monitoring of an additional dose of COVID-19 vaccine – United States, August 12 to September 19, 2021. MMWR Morb Mortal Wkly Rep 2021; 70.
Hetemäki I et al.: An outbreak caused by the SARS-CoV-2 Delta variant (B.1.617.2) in a secondary care hospital in Finland, May 2021. Eurosurveillance 2021; 26: 2100636.
Higdon MM et al.: A systematic review of COVID-19 vaccine efficacy and effectiveness against SARS-CoV-2 infection and disease. medRxiv, 2021;10.1101/2021.09.17.21263549.
Janssens U et al.: Einstellung zur Impfung gegen SARS-CoV-2. Med Klin Intensivmed Notfmed 2021; 116: 421–430.
Katikireddi SV et al.: Two-dose ChAdOx1 nCoV-19 vaccine protection against COVID-19 hospital admissions and deaths over time: a retrospective, population-based cohort study in Scotland and Brazil. Lancet 2022; 399: 25–35.
Khoury DS et al.: Neutralizing antibody levels are highly predictive of immune protection from symptomatic SARS-CoV-2 infection. Nat Med 2021a; 27: 1205–1211.
Khoury DS et al.: A meta-analysis of early results to predict vaccine efficacy against Omicron. medRxiv 2021b;10.1101/2021.12.13.21267748
Klugar M et al.: COVID-19 vaccine booster hesitancy (VBH) of healthcare workers in Czechia: National Cross-Sectional Study. Vaccines 2021; 9: 1437.
Kozak A et al.: COVID-19 vaccination: status and willingness to be vaccinated among employees in health and welfare care in Germany. IJERPH 2021; 18: 6688.
Lan F-Y et al.: Continued effectiveness of COVID-19 vaccination among urban healthcare workers during delta variant predominance. medRxiv 2021;10.1101/2021.11.15.21265753.
Levine-Tiefenbrun M et al.: Viral loads of Delta-variant SARS-CoV-2 breakthrough infections after vaccination and booster with BNT162b2. Nat Med 2021;10.1038/s41591-021-01575-4.
Lopez Bernal J et al.: Effectiveness of Covid-19 vaccines against the B.1.617.2 (Delta) Variant. N Engl J Med 2021; 385 :585–594.
Luo CH et al.: Infection with the SARS-CoV-2 delta variant is associated with higher infectious virus loads compared to the alpha variant in both unvaccinated and vaccinated individuals. medRxiv 2021;10.1101/2021.08.15.21262077.
Nohl A et al.: Acceptance of COVID-19 vaccination among front-line health care workers: a nationwide survey of emergency medical services personnel from Germany. Vaccines 2021; 9: 424.
Nordström P et al.: Effectiveness of Covid-19 vaccination against risk of symptomatic infection, hospitalization, and death up to 9 months: A Swedish total-population cohort study. medRxiv 2021;http://dx.doi.org/10.2139/ssrn.3949410.
Ontañón J et al.: Influence of past infection with SARS-CoV-2 on the response to the BNT162b2 mRNA vaccine in health care workers: Kinetics and durability of the humoral immune response. EBioMedicine 2021; 73:103656.
Pal S et al.: COVID-19 Vaccine hesitancy and attitude toward booster doses among US healthcare workers. Vaccines 2021; 9: 1358.
Poukka E et al.: Cohort study of Covid-19 vaccine effectiveness among healthcare workers in Finland, December 2020 – October 2021. medRxiv 2021;10.1101/2021.11.03.21265791.
Pouwels KB et al.: Effect of Delta variant on viral burden and vaccine effectiveness against new SARS-CoV-2 infections in the UK. Nat Med 2021;10.1038/s41591-021-01548-7.
RKI: KROCO – die Krankenhausbasierte Online-Befragung zur COVID-19-Impfung – Ergebnisbericht Dritte Befragungswelle. Berlin: Robert Koch-Institut; 2021a, 10.01.2022. https://www.rki.de/DE/Content/InfAZ/N/Neuartiges_Coronavirus/Projekte_R… (zuletzt abgerufen am 25.01.2022).
RKI: Wöchentlicher COVID-19-Lagebericht vom 09.12.2021. Berlin: Robert Koch-Institut; 2021b, 09.12.2021. https://www.rki.de/DE/Content/InfAZ/N/Neuartiges_Coronavirus/Situations… (zuletzt aufgerufen: 14.12.2021).
Self W et al.: Comparative Effectiveness of Moderna, Pfizer-BioNTech, and Janssen (Johnson & Johnson) Vaccines in Preventing COVID-19 Hospitalizations Among Adults Without Immunocompromising Conditions – United States, March–August 2021. MMWR Morb Mortal Wkly Rep 2021;http://dx.doi.org/10.15585/mmwr.mm7038e1.
Shamier MC et al.: Virological characteristics of SARS-CoV-2 vaccine breakthrough infections in health care workers. medRxiv 2021;10.1101/2021.08.20.21262158.
SPIEGEL: Die Immunisierung ist nach der zweiten Impfung nicht vollständig. 2021, 15.11.2021. https://www.spiegel.de/wissenschaft/mensch/corona-die-immunisierung-ist… (zuletzt aufgerufen: 16.11.2021).
STIKO. Beschluss der STIKO zur 12. Aktualisierung der COVID-19-Impfempfehlung. Berlin: Ständige Impfkommission;2021, 18.10.2021. https://www.rki.de/DE/Content/Infekt/EpidBull/Archiv/2021/43/Art_01.html (zuletzt aufgerufen: 27.10.2021).
Susky EK et al.: Hospital outbreak of the severe acute respiratory coronavirus virus 2 (SARS-CoV-2) delta variant in partially and fully vaccinated patients and healthcare workers in Toronto, Canada. Infect Control Hosp Epidemiol 2021: 1–4.
Tada T et al.: Comparison of neutralizing antibody titers elicited by mRNA and adenoviral vector vaccine against SARS-CoV-2 Variants. bioRxiv 2021;10.1101/2021.07.19.452771.
Tartof SY et al.: Effectiveness of mRNA BNT162b2 COVID-19 vaccine up to 6 months in a large integrated health system in the USA: a retrospective cohort study. The Lancet 2021; 398:1407–1416.
Tenforde MW et al.: Association between mRNA vaccination and COVID-19 hospitalization and disease severity. JAMA 2021; 326: 2043–2054.
Ulloa AC et al.: Early estimates of SARS-CoV-2 Omicron variant severity based on a matched cohort study, Ontario, Canada. medRxiv 2022;10.1101/2021.12.24.21268382.
Viana R et al.: Rapid epidemic expansion of the SARS-CoV-2 Omicron variant in southern Africa. medRxiv 2021;10.1101/2021.12.19.21268028.
Waldman SE et al.: Secondary cases of Delta-variant COVID-19 among vaccinated healthcare workers with breakthrough infections is rare. Clin Infect Dis 2021;10.1093/cid/ciab916.
Wang Y et al.: Transmission, viral kinetics and clinical characteristics of the emergent SARS-CoV-2 Delta VOC in Guangzhou, China. EClinicalMedicine 2021; 40.
Wolter N et al.: Early assessment of the clinical severity of the SARS-CoV-2 Omicron variant in South Africa. medRxiv 2021;10.1101/2021.12.21.21268116.
Yeh T-Y et al.: Full vaccination suppresses SARS-CoV-2 delta variant mutation frequency. medRxiv, 2021;10.1101/2021.08.08.21261768.
Zhong D et al.: Durability of antibody levels after vaccination with mRNA SARS-CoV-2 vaccine in individuals with or without prior infection. JAMA 2021;10.1001/jama.2021.19996.
Kontakt
Dr. rer. biol. hum. Agnessa Kozak
Competenzzentrum Epidemiologie und Versorgungsforschung bei Pflegeberufen (CVcare) am Universitätsklinikum Hamburg Eppendorf
Martinistraße 52
20246 Hamburg
a.kozak@uke.de
Das PDF dient ausschließlich dem persönlichen Gebrauch! - Weitergehende Rechte bitte anfragen unter: nutzungsrechte@asu-arbeitsmedizin.com.