Einleitung
In insgesamt vier Folgen werden Schlaglichter auf Themen des betrieblichen Arbeitsschutzes für Schwangere, Stillende und ihre Kinder geworfen. In Folge 1 wird die aktualisierte Leitlinie zur Labordiagnostik schwangerschaftsrelevanter Infektionskrankheiten vorgestellt. Sie definiert den Begriff schwangerschaftsrelevant, berücksichtigt neue epidemiologische Entwicklungen mit Schwerpunkt in Deutschland und gibt auch Empfehlungen zur Beratung von Schwangeren mit Aufenthalt in tropischen und subtropischen Ländern. Folge 2 richtet den Blick auf die Frühphase der Schwangerschaft sowie den Aspekt des präkonzeptionellen Mutterschutzes: Welche allgemeinen Arbeitsschutzkonzepte müssen etabliert sein, um auch in der Frühphase einer (möglicherweise noch unentdeckten) Schwangerschaft ausreichenden Schutz zu bieten? In Folge 3 werden Epidemiologie, Krankheitsbild und Präventionsmöglichkeiten der Embryofetopathie durch pränatale Infektion mit Zytomegalieviren (CMV) aufgezeigt. Die Infektion mit CMV hat die impfpräventablen Röteln in ihrer Bedeutung für die Schwangerschaft schon seit längerem abgelöst, ist jedoch den Frauen selten bekannt. Folge 4 schließt die Serie mit einem Beitrag zum gefahrstoffbezogenen Mutterschutz. Am Beispiel der polychlorierten Biphenyle (PCB) wird verdeutlicht, wie sich gefährdende Expositionen gegenüber dieser Gruppe bioakkumulierender Gefahrstoffe bewerten und verhindern lassen. Johanna Stranzinger, Johannes Gerding, BGW, Hamburg
Folge 3: Die kongenitale CMV-Infektion – heute das größte Risiko für fetale Schädigungen
Was charakterisiert eine CMV-Infektion?
Infektionen mit dem humanen Zytomegalievirus (CMV, humanes Herpesvirus 5) sind weltweit verbreitet, in Industrieländern sind sie die häufigste infektionsbedingte Ursache für Embryo- und Fetopathien. In Deutschland sind, abhängig vom sozioökonomischen Status, zwischen 40 und 90 % der Bevölkerung mit diesem Vertreter der Herpesviren infiziert. Nach der meist asymptomatisch verlaufenden akuten Infektion – sie wird auch als Primärinfektion bezeichnet – persistiert CMV lebenslang im Organismus. Während der Persistenz wird das Virus sporadisch reaktiviert und dabei erneut in Speichel, Urin oder Blut nachweisbar (Jenks et al. 2021). Deswegen scheiden sowohl akut wie auch persistierend infizierte Personen die Erreger aus und können sie an seronegative Personen weitergeben, wobei die Übertragung überwiegend durch Schmierkontaminationen mit Speichel und Urin erfolgt. Infektiöses CMV findet man aber auch in den Zervixsekreten und in der Samenflüssigkeit, so dass Sexualverkehr eine weitere Ansteckungsquelle darstellt (Bresson et al. 2003). Die Übertragung ist auch durch Organtransplantate, Bluttransfusionen und -produkte möglich. Säuglinge und Kleinkinder können postnatal durch Stillen infiziert werden, weil mehr als 95 % der seropositiven Mütter – das heißt, alle akut oder persistierend CMV-infizierten Mütter – die Viren vorübergehend reaktivieren, in der Muttermilch ausscheiden und auf die Stillkinder übertragen (Hamprecht u. Goelz 2017). Mit Ausnahme von Frühgeborenen erkranken diese postnatal infizierten Kleinkinder nicht, scheiden jedoch bis zum dritten Lebensjahr, insbesondere aber in den ersten Monaten nach der Infektion, zum Teil große Mengen der Zytomegalieviren im Speichel und im Urin aus. Vor allem in Betreuungseinrichtungen für Kleinkinder können die Erreger auf seronegative Spielkameraden oder erwachsene Kontaktpersonen übertragen werden (Cannon et al. 2011). Schätzungen gehen davon aus, dass bis zu 20% der seropositiven Erwachsenen die CMV-Infektion auf diese Weise im Kleinkindalter erworben haben.
Ein weiterer Übertragungsweg besteht dann, wenn die CMV-Primärinfektion während der Schwangerschaft erfolgt. Abhängig von der Schwangerschaftsphase können die Erreger in bis zu 40 % der Fälle transplazentar auf die Feten übertragen werden und sie infizieren, wobei zwischen der Infektion der Schwangeren und derjenigen des Feten eine Zeitspanne von etwa vier bis sechs Wochen liegt. Mit fortschreitender Schwangerschaft nimmt die Wahrscheinlichkeit der Übertragung zu, das Risiko für die Entwicklung fetaler Erkrankungen jedoch ab: Die größte Gefahr für fetale beziehungsweise neonatale CMV-Erkrankungen (kongenitales CMV-Syndrom, cCMV-Syndrom) besteht bei Primärinfektion der Schwangeren um den Zeitpunkt der Konzeption und während der folgenden Wochen. Primärinfektionen, die sich ab der 12.–14. Schwangerschaftswoche bis zur Geburt ereignen, bewirken nur sehr selten fetale Erkrankungen oder Schädigungen beim Neugeborenen. Die transplazentare Übertragung erfolgt vor allem bei CMV-Primärinfektionen der Schwangeren, seltener bei Reaktivierungen oder Reinfektionen.
Wie häufig ist die kongenitale CMV-Infektion in Deutschland?
In Mitteleuropa und auch in Deutschland ist die CMV-Infektion nicht meldepflichtig, genaue Zahlen zur Inzidenz und zum Infektionsstatus liegen deswegen nicht vor. Deutschland gilt als Niederprävalenzland; unter Berücksichtigung von regionalen, sozialen und anderen epidemiologischen Einflüssen sind etwa 40–50 % der Schwangeren CMV-seropositiv. Auf der Basis von Untersuchungen in Ländern mit ähnlicher Durchseuchung und Bevölkerungsstruktur schätzt man, dass es bei 1–2 % der Schwangeren zu Primärinfektionen kommt und dass etwa 0,2–0,6 % aller Neugeborenen mit einer kongenital erworbenen CMV-Infektion geborenen werden (Buxmann et al. 2018). Bei einer jährlichen Geburtskohorte von etwa 750.000 Kindern kann folglich von 1500 bis 4500 cCMV-infizierten Neugeborenen ausgegangen werden. Das Ausmaß, in dem Nicht-Primärinfektionen zu dieser Zahl beitragen, ist völlig unklar. Während die CMV-Reaktivierung bei Stillenden recht gut untersucht ist, existieren derzeit nur wenige Daten zur Häufigkeit und zu den Auslösern von transienten Reaktivierungen bei Schwangeren. Die hormonelle Umstellung während der Schwangerschaft dürfte jedoch mit vermehrten Reaktivierungen der persistierenden Viren verbunden sein, weshalb 10 % aller Schwangeren CMV ausscheiden. Bei diesen CMV-Reaktivierungen, die meist nicht mit der Produktion von großen Virusmengen einhergehen, kommt es seltener zu transplazentaren Übertragungen.
Die postnatale CMV-Infektion – welche Erkrankungen sind mit ihr verbunden?
Bei immungesunden Personen und auch bei Schwangeren verlaufen CMV-Primärinfektionen meist asymptomatisch; nur etwa 20 % der schwangeren Patientinnen berichten von leichtem Fieber, Lymphknotenschwellungen und Grippe- oder Mononukleose-ähnlichen Erkrankungszeichen, schwere Verläufe mit Gastritis, Ösophagitis, oder Pneumonie sind selten (Picone et al. 2013; Kagan u. Hamprecht 2017). Das nach der Primärinfektion etablierte Stadium der lebenslangen CMV-Persistenz ist von Reaktivierungsepisoden durchbrochen, die bei Immungesunden ohne Symptome verlaufen und klinisch nicht von ebenfalls symptomfreien Reinfektionen unterschieden werden können.
Immunsupprimierte Personen – beispielsweise Transplantatempfängerinnen und -empfänger, Tumor- und AIDS-Erkrankte – produzieren sehr viel Virus und scheiden sehr große Mengen aus. Bei diesen Personen verursachen CMV-Infektionen häufig schwere Erkrankungen, hierzu zählen Chorioretinitiden, Hepatitiden, gastrointestinale Ulzerationen und Kolitiden mit Schmerzen und Durchfällen. Die interstitielle CMV-Pneumonie ist bei AIDS-Erkrankten und Knochenmarkstransplantierten eine häufige Todesursache.
Was charakterisiert die kongenitale CMV-Infektion?
Das klinische Spektrum der kongenitalen CMV-Infektion reicht von asymptomatischen Verläufen (ca. 85–90 %) bis hin zu lebensbedrohlichen Erkrankungen (Kagan u. Hamprecht 2017). Vor allem CMV-Primärinfektionen, seltener aber auch Reaktivierungen und Reinfektionen in der Frühschwangerschaft sind mit Aborten oder schweren Fetopathien mit Mikrozephalie, zerebralen Fehlbildungen, schweren Organschädigungen, Hepatosplenomegalie, Wachstums- und Entwicklungsretardierung, Augen- und Gehörschädigung verbunden. Die schweren Symptome fallen häufig bei den Ultraschalluntersuchungen während der Schwangerschaft, spätestens aber nach der Geburt der Kinder auf.
Bei den Neugeborenen können die Symptome einer cCMV-Infektion sehr diskret sein, sie sind daher nicht immer leicht zu erkennen. Während disseminierte Petechien, Hepatosplenomegalie und eine Hyperbilirubinämie mit einem hohen Anteil direkten Bilirubins charakteristisch für eine cCMV des Neugeborenen sind, sind Wachstumsretardierung, Mikrozephalie und Frühgeburtlichkeit eher unspezifische Symptome. Häufig zeigen sich Auffälligkeiten beim Neugeborenen-Hörscreening, denn die cCMV-Infektion verursacht bis zu 25 % der frühkindlichen Schwerhörigkeiten. Andauernde Hörstörungen in Form von Schallempfindungsschwerhörigkeiten treten bei 10–15 % der cCMV-infizierten Kinder auf. Auch wenn die große Mehrheit der cCMV-infizierten Kinder augenscheinlich asymptomatisch geborenen wird, können bei bis zu 25 % dennoch im Verlauf progrediente Hörstörungen bis hin zur Ertaubung auftreten, mit der Folge von Sprach- und weiteren Entwicklungsstörungen.
Wie können CMV-Infektionen bei Schwangeren verhindert werden?
Bisher existiert kein Impfstoff zum Schutz vor einer CMV-Infektion. In etlichen Studien wurde gezeigt, dass sich CMV-Primärinfektionen vermeiden lassen, wenn Schwangere möglichst früh beraten werden, wie sie diese durch bestimmte Hygienemaßnahmen vermeiden können. Mit das größte Ansteckungsrisiko geht von unter dreijährigen Kindern aus. Wie eingangs beschrieben, infizieren sich Säuglinge seropositiver Mütter über die Milch und scheiden in den Folgemonaten große Virusmengen in Speichel und Urin aus. In Krippen und ähnlichen Gemeinschaftseinrichtungen für Kleinkinder übertragen sie die Viren auf seronegative Kinder und infizieren sie, ohne dass sie dabei Erkrankungsanzeichen entwickeln. Die folglich persistierend infizierten Kinder können jedoch die Infektion auf ihre Eltern, Geschwister und andere Familienangehörige übertragen, falls diese noch seronegativ sind. Ist die Mutter zu diesem Zeitpunkt erneut schwanger, ist der Fetus durch die CMV-Primärinfektion der Mutter stark gefährdet. Man kann davon ausgehen, dass die überwiegende Zahl der CMV-Primärinfektionen bei Schwangeren von den eigenen Kindern in der Familie übertragen werden. Deswegen sollen alle Schwangeren beraten werden, Kontakte zu Speichel und Urin von Kleinkindern zu vermeiden. Dazu zählen beispielsweise: nicht den Schnuller oder das Essbesteck eines Kindes in den Mund nehmen oder seine Speisereste aufessen, Kinder nicht auf den Mund küssen, nach jedem Wickeln, Windelwechseln etc. die Hände mit begrenzt viruziden Mitteln zu desinfizieren oder mit Seife zu waschen. Da auch von CMV-Reinfektionen ein – wenn auch schwer einzuschätzendes – Risiko für eine kongenitale Infektion des Feten ausgeht, sollen sowohl seronegative wie auch seropositive Schwangere eine entsprechende Beratung erfahren.
Neue Studien zeigen aber auch, dass bei rechtzeitiger Erkennung der CMV-Primärinfektion die Übertragung auf den Feten durch zeitnahe und hochdosierte Gabe von Immunglobulinen verhindert werden kann (Kagan et al. 2021, s. „Weitere Infos“). Ebenfalls in der Frühschwangerschaft kann man die transplazentare Übertragung und fetale Infektion auch durch die Behandlung der Schwangeren mit Valaciclovir hemmen (Faure-Bardon et al. 2021). Deswegen kommt der korrekten und frühzeitigen Diagnose der CMV-Primärinfektion eine immer größer werdende Bedeutung zu. Sie ist jedoch nicht trivial, weil
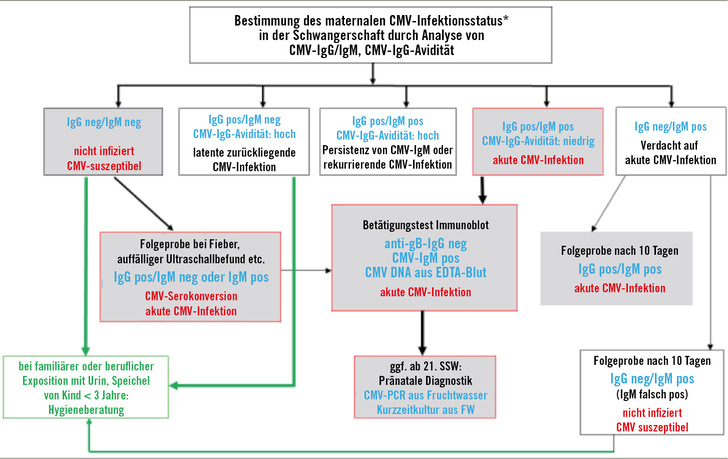
In der überarbeiteten S2k-AWMF-Leitlinie 093-001 „Labordiagnostik schwangerschaftsrelevanter Virusinfektionen“ wird empfohlen, dass bei allen Schwangeren, die private und/oder berufliche Kontakte zu Kindern im Alter von unter drei Jahren haben, so früh wie möglich der CMV-Infektionsstatus durch Bestimmung von CMV-IgM und CMV-IgG erhoben werden soll. Jeder positive CMV-IgM-Befund soll durch Bestimmung der CMV-IgG-Avidität ergänzt werden (➥ Abb. 1). Nur bei niedrigen Werten für die Avidität der CMV-IgG-Antikörper kann das positive CMV-IgM als Hinweis für eine CMV-Primärinfektion gewertet werden. Bei CMV-IgM/IgG-negativen Schwangeren mit entsprechender anhaltender Exposition zu Kleinkindern kann in den Schwangerschaftswochen 12–14 eine erneute Bestimmung von CMV-IgG erfolgen. Die erneute Testung soll auch dann vorgenommen werden, wenn im Zeitraum bis zur 14. Schwangerschaftswoche bei initial seronegativen Frauen Symptome auftreten, die mit einer CMV-Primärinfektion vereinbar sind. Ergibt die Folgetestung positive Werte, dann zeigt diese Serokonversion, dass die Schwangere sich zwischen der ersten und zweiten Testung mit CMV infiziert hat.
Wie oben beschrieben, sind CMV-Primärinfektionen zwischen der Konzeption und der 12./14. Schwangerschaftswoche sehr kritisch. In diesem Zeitraum sind transplazentare Übertragungen auf den Feten zwar selten, verursachen aber – wenn sie stattfinden – besonders häufig schwere fetale Erkrankungen. Deswegen muss in diesen Fällen eine besonders intensive Beratung hinsichtlich des Risikos für mögliche Fetopathien erfolgen; eine Therapie zur Verhinderung der Übertragung der CMV-Infektion durch Immunglobine oder Valacicovir kann mit den Eltern besprochen und erwogen werden. Mit dieser Vorgehensweise zur Labordiagnostik ist der für die Gesundheit des Feten besonders kritische Zeitraum erfasst.
Wie erfolgt die Labordiagnostik einer kongenitalen CMV-Infektion beim Neugeborenen?
Auch bei Neugeborenen sind cCMV-Infektion klinisch nicht immer leicht zu erkennen, sie fallen meist im Neugeborenen-Hörscreening auf, können aber auch erst während der ersten Lebensmonate und -jahre auftreten. Jedoch ist die frühe und zweifelsfreie Diagnose der kongenitalen CMV-Infektion bei Neugeborenen sehr wichtig, weil aktuelle Studien zeigen, dass man durch eine rechtzeitige antivirale Therapie mit Valganciclovir die CMV-assoziierten Erkrankungen der kongenital infizierten Neugeborenen positiv beeinflussen kann. Wegen der oben beschriebenen möglichen Übertragung der CMV-Infektion auf Säuglinge durch die Milch seropositiver stillender Mütter muss die Diagnostik der cCMV-Infektion zeitnah nach der Geburt, möglichst innerhalb der ersten, spätestens aber bis zum Ende der dritten Lebenswoche erfolgen, um eine kongenitale von einer früh erfolgten postnatalen CMV-Infektion zu unterscheiden. Postnatale Infektionen verlaufen bei reifgeborenen Säuglingen asymptomatisch und bleiben ohne Folgen. Die Bestimmung von CMV-spezifischen Antikörpern (CMV-IgG, CMV-IgM) ist beim Neugeborenen nicht empfohlen, weil mütterliche Antikörper das Ergebnis beeinflussen. Bei Neugeborenen erfolgt der Nachweis der cCMV-Infektion stattdessen durch den Nachweis von CMV-DNA in einer Urin- oder Speichelprobe (Abstrich der Mundschleimhaut) mittels quantitativer Polymerase-Kettenreaktion (PCR). Bei einer Speichelprobe sollte zwischen dem letzten Stillen und der Abnahme der Probe ein Zeitraum von mindestens zwei Stunden liegen, weil andernfalls durch die CMV-Ausscheidung in der Muttermilch falsch-positive Befunde möglich sind. Der in der ersten Lebenswoche ermittelte Wert für die CMV-Genomkopien in Urin und Blut kann einen Hinweis für das potenzielle Risiko des Neugeborenen für die Entwicklung von Hörstörungen geben, die man bei hoher Viruslast deutlich häufiger findet. Wird eine antivirale Therapie erwogen und begonnen, so dient dieser Wert für das sich anschließende Monitoring als Ausgangsbefund zur Kontrolle des Behandlungserfolgs.
Soll bei Auftreten von Hörstörungen oder anderen Symptomen die cCMV-Infektion im Alter von einigen Lebenswochen oder -monaten retrospektiv diagnostiziert werden, so kann dies durch Nachweis von CMV-DNA aus der Trockenblutprobe des Neugeborenenscreenings, gewonnen in den ersten drei Lebenstagen, erfolgen. Leider sollen im Unterschied zu anderen europäischen und nichteuropäischen Ländern die Trockenblutproben des Neugeborenenscreenings seit 2005 entsprechend eines G-BA-Beschlusses in Deutschland aus datenschutzrechtlichen Bestimmungen nach drei Monaten vernichtet werden. Dadurch werden nach diesem Zeitpunkt Therapieoptionen oder Follow-up-Untersuchungen für CMV-infizierte Kinder unmöglich, bei denen unklar ist, ob sie kongenital oder postnatal infiziert wurden.
Künftige Entwicklungen
Die Empfehlungen der Leitlinie zur Labordiagnostik müssen in regelmäßigen Abständen auf ihre Gültigkeit überprüft werden. In dieser Hinsicht unterliegt auch diese Leitlinie einem kontinuierlichen Anpassungs- und Prüfungsprozess. Durch den Fokus auf die labordiagnostische Vorgehensweise werden für Prävention und Therapie der CMV-Infektion bei Schwangeren und Neugeborenen keine Empfehlungen gegeben. Diese müssen in anderen Leitlinien behandelt und abgestimmt werden.
Interessenkonflikt: Die Autorin gibt an, dass kein Interessenkonflikt vorliegt.
Literatur
Bresson J, Clavequin MC, Mazeron MC et al.: CECOS, Risk of cytomegalovirus transmission by cryopreserved semen: a study of 635 semen samples from 231 donors. Hum Reprod 2003; 18: 1881–1886.
Buxmann H, Enders M, Gembruch U et al.: Management der kongenitalen Zytomegalievirus-Infektion bei Neugeborenen: Aktueller Diskussionsstand zu Diagnostik, Prävention und Therapie. Kinder- und Jugendarzt 2018: 49: 107–117.
Cannon MJ, Hyde TB, Schmid DS: Review of cytomegalovirus shedding in bodily fluids and relevance to congenital cytomegalovirus infection. Rev Med Virol 2011; 21: 240–255.
Faure-Bardon V, Fourgeaud J, Stirnemann J, Leruez-Ville M, Ville Y: Secondary prevention of congenital cytomegalovirus infection with valacyclovir following maternal primary infection in early pregnancy. Ultrasound Obstet Gynecol 2021; 58: 576–581.Epub 2021 Sep 13. PMID: 33998084.
Hamprecht K, Goelz R: Postnatal cytomegalovirus infection through human milk in preterm infants: transmission, clinical presentation, and prevention. Clin Perinatol 2017; 44: 121–130. Epub 2016 Dec 27. PMID: 28159200.
Jenks CM, Hoff SR, Mithal LB: Congenital cytomegalovirus infection: epidemiology, timely diagnosis, and management. Neoreviews 2021; 22: e606–e613. PMID: 34470762.
Kagan KO, Hamprecht K: Cytomegalovirus infection in pregnancy. Arch Gynecol Obstet 2017; 296: 15–26.. Epub 2017 May 15. PMID: 28508343.
Picone O, Vauloup-Fellous C, Cordier AG et al.: A series of 238 cytomegalovirus primary infections during pregnancy: description and outcome. Prenat Diagn 2013; 33: 751–758.
doi:10.17147/asu-1-211443
Weitere Infos
Kagan KO et al:. Outcome of pregnancies with recent primary cytomegalovirus infection in first trimester treated with hyperimmunoglobulin: observational study. Ultrasound Obstetrics Gynecology 2021; 57 (Open Access)
https://obgyn.onlinelibrary.wiley.com/doi/full/10.1002/uog.23596
Modrow S et al.: AWMF-Leitlinie 093-001 Labordiagnostik schwangerschaftsrelevanter Virusinfektionen, 2021
https://www.awmf.org/leitlinien/detail/ll/093-001.html
Kernaussagen
Kontakt
Das PDF dient ausschließlich dem persönlichen Gebrauch! - Weitergehende Rechte bitte anfragen unter: nutzungsrechte@asu-arbeitsmedizin.com.
Alle Folgen der Serie "Präventiver Mutterschutz" in der Übersicht