Die BK 1301-Matrix als Algorithmus und Entscheidungshilfe für eine Zusammenhangsbegutachtung
W. Weistenhöfer1,**
K. Golka2**, U. Bolm-Audorff3
H.M. Bolt2, T. Brüning4
E. Hallier5, D. Pallapies4
H.-M. Prager6, T. Schilling1
S. Schmitz-Spanke1,
W. Uter7, T. Weiß4, H. Drexler1
1 Institut und Poliklinik für Arbeits-, Sozial- und Umweltmedizin (IPASUM) der Friedrich-Alexander-Universität Erlangen-Nürnberg
2 Leibniz-Institut für Arbeitsforschung an der TU Dortmund (IfADo), Dortmund
3 Regierungspräsidium Darmstadt, Abteilung Arbeitsschutz, Dezernat Landesgewerbearzt, Wiesbaden
4 Institut für Prävention und Arbeitsmedizin der Deutschen Gesetzlichen Unfallversicherung (IPA), Bochum
5 Institut für Arbeits-, Sozial- und Umweltmedizin der Georg-August-Universität Göttingen
6 Institut für Arbeits-, Sozial- und Umweltmedizin, Castrop-Rauxel
7 Institut für Medizininformatik, Biometrie und Epidemiologie (IMBE) der Friedrich-Alexander-Universität Erlangen-Nürnberg
(eingegangen am 12.01.2022, angenommen am 09.02.2022)
Work-related bladder cancer – The BK 1301 matrix as an algorithm and decision aid in the context of an assessment of an occupational disease
The risk of developing bladder cancer can be influenced by various occupational and non-occupational risk factors. These need to be evaluated in the context of an assessment of an occupational disease according to no. 1301 (BK 1301: Mucosal changes, cancer and other neoplasms of the urinary tract (hereinafter referred to as “bladder cancer”) caused by aromatic amines) of the Annex to the Ordinance on Occupational Diseases. The BK 1301 matrix presented here for the assessment of the causal relationship in urinary bladder cancers after proven and relevant occupational exposure to carcinogenic aromatic amines was derived as a convention by a working group, based on the results of a workshop with more than 230 participants. It can be applied even in the absence of an individual cumulative exposure dose. The decision matrix is intended to support experts experienced in occupational medicine in the field of BK 1301 in the assessment procedure. It also provides an overview of relevant aspects of work-related bladder cancer for the purposes of accident insurance institutions and courts. The BK 1301 matrix includes occupational indicators such as exposure duration, exposure frequency and exposure intensity, as well as the age of onset, the latency period and competing non-occupational risk factors such as smoking behaviour.
Based on the BK 1301 matrix, the relevant arguments favouring or refuting a causal occupational relationship in the individual case can be evaluated in detail by the occupational physician, resulting in a recommendation for or against recognition of the bladder cancer as an occupational disease. This notwithstanding, the decision as to whether an occupational disease is indeed present is ultimately an administrative act of the responsible accident insurance institution, which may be subject to review by the social courts.
Keywords: expert opinion – occupational disease 1301 – bladder cancer – aromatic amines – matrix – convention
ASU Arbeitsmed Sozialmed Umweltmed 2019; 57: 177–179
doi:10.17147/asu-1-174375
Das beruflich bedingte Harnblasenkarzinom – Die BK 1301-Matrix als Algorithmus und Entscheidungshilfe für eine Zusammenhangsbegutachtung
Das Risiko, an einem Harnblasenkarzinom zu erkranken, kann durch verschiedene berufliche und außerberufliche Risikofaktoren beeinflusst werden.
Diese sind im Rahmen der Zusammenhangsbegutachtung einer Berufskrankheit nach Nr. 1301 (BK 1301: Schleimhautveränderungen, Krebs und andere Neubildungen der ableitenden Harnwege (im Folgenden als „Harnblasenkarzinom“ bezeichnet) durch aromatische Amine) der Anlage zur Berufskrankheiten-Verordnung zu bewerten. Die hier vorgestellte BK 1301- Matrix zur Beurteilung und Bewertung des Ursachenzusammenhangs bei Harnblasenkarzinomen nach arbeitstechnisch nachgewiesener und für die BK 1301 relevanter beruflicher Exposition gegenüber krebserzeugenden aromatischen Aminen wurde auf der Basis der Ergebnisse eines Workshops mit über 230 Teilnehmenden in einer Arbeitsgruppe als Konvention abgeleitet. Sie kann auch bei fehlender konkreter kumulativer Expositionsdosis angewendet werden. Die Matrix soll auf dem Gebiet der BK 1301 arbeitsmedizinisch erfahrene Sachverständige im Feststellungsverfahren unterstützen. Sie gibt aber auch für Unfallversicherungsträger und Gerichte einen Überblick über relevante Aspekte des beruflich bedingten Harnblasenkarzinoms. Die BK 1301-Matrix beinhaltet u. a. berufliche Indikatoren wie Expositionsdauer, Expositionshäufigkeit und Expositionsintensität, aber auch das Erkrankungsalter, die Latenzzeit sowie konkurrierende außerberufliche Risikofaktoren wie z. B. das Rauchverhalten und wertet diese hinsichtlich der Beurteilung des Ursachenzusammenhangs in Bezug auf eine BK 1301.
Auf der Grundlage der BK 1301-Matrix können die relevanten Pro- und Kontra-Argumente für die Beurteilung des Ursachenzusammenhangs im Einzelfall eingehend arbeitsmedizinisch gewürdigt werden und münden in einer Empfehlung des Gutachters für oder gegen die Anerkennung der Erkrankung als Berufskrankheit. Die Entscheidung, ob eine Berufskrankheit vorliegt, ist letztlich aber ein Verwaltungsakt des zuständigen Unfallversicherungsträgers, der gegebenenfalls sozialgerichtlich überprüft wird.
Schlüsselwörter: egutachtung – Berufskrankheit 1301 – Harnblasenkarzinom – aromatische Amine – Matrix – Konvention
Einleitung
Das Feststellungsverfahren einer Berufskrankheit nach Nummer 1301 (BK 1301: Schleimhautveränderungen, Krebs und andere Neubildungen der ableitenden Harnwege (im Folgenden als „Harnblasenkarzinom“ bezeichnet) durch aromatische Amine) der Anlage zur Berufskrankheiten-Verordnung (BKV) erfordert eine plausible, von allen Beteiligten nach aktuellem wissenschaftlichem Kenntnisstand nachvollziehbare Kausalitätsbeurteilung. In der Legaldefinition der BK 1301 wird keine bestimmte Dosis krebserzeugender aromatischer Amine für die Anerkennung gefordert. Der alleinige Nachweis
einer stattgehabten Exposition belegt allerdings noch nicht, dass ein Harnblasenkarzinom durch die beruflichen Einflüsse wesentlich mitverursacht wurde. Die Kausalität auch von geringen Expositionen gegenüber krebserzeugenden aromatischen Aminen bei der Entstehung von Harnblasenkarzinomen muss also nachvollziehbar beurteilt werden. Daher wurde eine Konvention für die Bewertung der Exposition gegenüber krebserzeugenden aromatischen Aminen bei Verdacht auf Vorliegen einer BK 1301 erarbeitet, um eine einheitlichere und damit gerechtere Beurteilung aller betroffenen Versicherten zu ermöglichen.
Die Kausalitätsbeurteilung hängt wesentlich von der Ermittlungsqualität der Unfallversicherungsträger (Präventionsdienste) ab (Schöps et al. 2016). Arbeitsmedizinische Gutachterinnen/Gutachter sind gefordert, die Ermittlungsergebnisse auf Plausibilität zu überprüfen und mit branchentypischen Erfahrungen abzugleichen, gegebenenfalls sind Nachermittlungen anzufordern (Golka u. Schöps 2021).
Am 05.03.2021 fand ein Online-Workshop der Deutschen Gesellschaft für Arbeitsmedizin und Umweltmedizin e. V. (DGAUM) zum Thema „Expositionsabschätzung für das Harnblasenkrebsrisiko durch aromatische Amine“ im Rahmen des von der Deutschen Gesetzlichen Unfallversicherung (DGUV) geförderten Projekts FB 286 „Erarbeitung einer Expositionsabschätzung für das Harnblasenkrebsrisiko durch aromatische Amine und Einschätzung der Auswirkung der Erkrankung Harnblasenkrebs auf die Erwerbstätigkeit“ statt. Dabei wurden verschiedene Ansätze zur Einschätzung und Bewertung der Exposition vorgestellt und von den über 230 Teilnehmenden diskutiert.
Da oftmals keine validen Expositionsdaten von aromatischen Aminen oder Azofarbstoffen vorliegen, die die Abschätzung einer Expositionsdosis zulassen (Pucknat 2021), und diese Daten auch für andere, aromatische Amine abspaltende Substanzen fehlen, wurde beschlossen, verschiedene Ansätze zur Bewertung der Expositionsbedingungen am Arbeitsplatz und konkurrierender Risikofaktoren zu erarbeiten, die ein für die Anerkennung als Berufskrankheit ausreichend erhöhtes Erkrankungsrisiko für Harnblasenkarzinome wahrscheinlich machen oder hinreichend sicher ausschließen lassen.
Eine Arbeitsgruppe unter Einschluss des Autorenteams dieser Publikation erarbeitete auf der Grundlage der auf dem Workshop vorgestellten Ansätze zur Einschätzung und Bewertung der Exposition (u. a. über epidemiologische Daten (Schilling 2021) und eine Analogiebetrachtung zum Tabakrauchen (Weiß 2021; Weiß et al. 2010)) eine Beurteilungsmatrix zur Abschätzung des beruflich bedingten Harnblasenkarzinomerkrankungsrisikos durch verschiedene krebserzeugende aromatische Amine. Diese hier nachfolgend beschriebene Beurteilungsmatrix wurde in Anlehnung an eine von der Arbeitsgruppe um Golka, Böthig und Schöps (Böthig et al. 2019, 2020) bereits entwickelte Matrix für Harnblasenkarzinome nach langjähriger Querschnittlähmung erstellt. Die Matrix stützt sich darüber hinaus auf Daten aus Originalpublikationen sowie auf arbeitsmedizinische Erfahrungen. Der entscheidende Vorteil des hier vorgeschlagenen Vorgehens zur Beurteilung des Ursachenzusammenhangs liegt darin, dass auf der Basis einer auf einem Konsens beruhenden Konvention der Zusammenhang zwischen der Einwirkung krebserzeugender aromatischer Amine und einer aufgetretenen Harnblasenkrebserkrankung auch bei solchen Fällen beurteilt werden kann, bei denen eine konkrete kumulative Expositionsdosis nicht ermittelt werden konnte. Die rechtliche Umsetzung dieser Matrix soll zeitnah in gutachterlichen Empfehlungen zur BK 1301 erfolgen.
Indikatoren für oder gegen die Anerkennung eines Harnblasenkarzinoms als Berufskrankheit
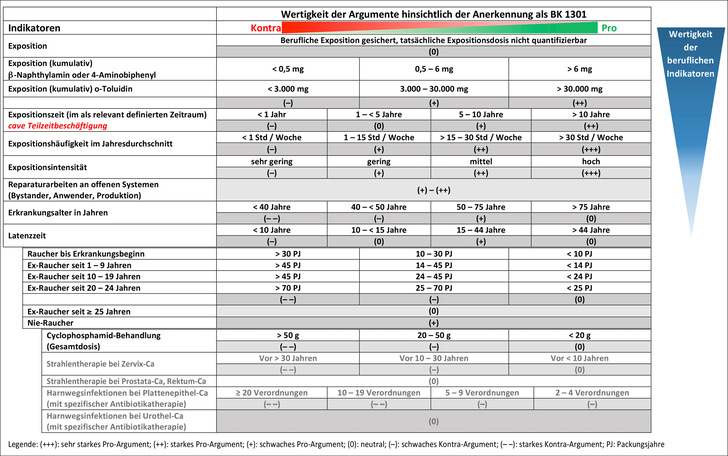
Das Risiko, an einem Harnblasenkarzinom zu erkranken, kann durch verschiedene berufliche und außerberufliche Risikofaktoren beeinflusst werden. Im Rahmen der Begutachtung einer BK 1301 sind diese Indikatoren, die für oder gegen eine Anerkennung der Erkrankung als Berufskrankheit sprechen, zu diskutieren und zu bewerten. Die BK 1301-Matrix (➥ Abb. 1) kann nur angewendet werden, wenn eine arbeitstechnisch relevante Exposition gegenüber krebserzeugenden aromatischen Aminen für eine BK 1301 gesichert werden konnte. Sie gibt einen Überblick über relevante Aspekte des beruflich bedingten Harnblasenkarzinoms und zeigt ihre jeweilige Wertung an. Dabei sind die Zeilen der Matrix untereinander in ihrer Wertigkeit nicht gleichrangig.
Exposition
Die Anerkennung einer Harnblasenkarzinomerkrankung als Berufskrankheit nach Nr. 1301 der Anlage zur BKV kann nur dann erfolgen, wenn eine für eine BK 1301 arbeitstechnisch relevante Exposition gegenüber krebserzeugenden aromatischen Aminen vorgelegen hat. Auch wenn das Berufskrankheitenrecht für die BK 1301 keine Verdopplungsdosis für die Anerkennung im Einzelfall fordert, sollte ein Expositionsszenario definiert werden, bei dem eine Berufskrankheit mit der von den Gesetzesvorschriften und der Rechtsprechung geforderten Wahrscheinlichkeit gesichert werden kann, oder eben nicht. Der alleinige Nachweis einer Exposition kann nicht zu einer Anerkennung führen. Im § 9 Abs. 1 Satz 2 SGB VII wird ausgeführt, dass für Berufskrankheiten eine Exposition „in erheblich höherem Grade als bei der Normalbevölkerung“ zu belegen ist. Valide epidemiologische Daten zu Expositionen gegenüber krebserzeugenden aromatischen Aminen und dem damit verbundenen Harnblasenkarzinomerkrankungsrisiko liegen aber nur vereinzelt vor. Dies liegt unter anderem darin begründet, dass aromatische Amine an Arbeitsplätzen in der Regel zu einem relevanten Anteil auch über die Haut aufgenommen werden, der Beitrag der dermalen Aufnahme an der Gesamtbelastung messtechnisch aber kaum valide zu erfassen ist.
Wenn eine konkrete kumulative Expositionsdosis krebserzeugender aromatischer Amine durch den Unfallversicherungsträger nicht quantifiziert werden kann, eine möglicherweise relevante berufliche Exposition aufgrund der Arbeitsplatzanamnese und arbeitsmedizinischer Erfahrung aber anzunehmen ist, stellt eine nicht ermittelbare Expositionsdosis in der Kausalitätsbeurteilung kein Abschneidekriterium dar. Sofern es also im Rahmen der arbeitstechnischen Ermittlungen nicht möglich war, eine zahlenmäßig konkrete kumulative Expositionsdosis zu ermitteln, so ist dies in der Gesamtbetrachtung als neutral zu werten (0).
Für diejenigen Fälle, in denen die tatsächliche Exposition ermittelt werden kann, werden im Folgenden kumulative Expositionsdosen und deren Wertigkeit im Anerkennungsverfahren dargestellt.
Ableitung einer kumulativen Dosis für o-Toluidin aus epidemiologischen Daten
Trotz der kontroversen Diskussion hinsichtlich der Kanzerogenitätseinstufung wurde o-Toluidin von wissenschaftlichen Gremien (Greim 2007; IARC 2010) eindeutig als krebserzeugendes aromatisches Amin im Sinne einer BK 1301 eingestuft und diese Einstufung vom Ärztlichen Sachverständigenbeirat umgesetzt (Ärztlicher Sachverständigenbeirat 2011).
Für ein Kollektiv von 1749 Beschäftigten einer Fabrik zur Herstellung von Chemikalien für die Gummi-Industrie liegen Daten zur Exposition gegenüber o-Toluidin aus Luftmessungen sowie Inzidenzraten für die Erkrankung an einem Harnblasenkarzinom vor (Ward et al. 1991, 1996), aus denen unter der Annahme eines linearen Verlaufs der Dosis-Wirkungs-Beziehung und linearer Extrapolation eine kumulative Dosis von etwa 2800 mg o-Toluidin als Verdopplungsdosis für die Erkrankung an einem Harnblasenkarzinom abgeleitet werden kann. Diese Ableitung wurde auch auf dem Workshop zur BK 1301 vorgestellt und diskutiert (Schilling 2021). Das beschriebene Kollektiv aus der Gummichemikalien-herstellenden Industrie war Gegenstand weiterer Publikationen (u. a. Carreón et al. 2010, 2014; Hanley et al. 2012; Markowitz 2005; Markowitz u. Levin 2004; Park et al. 2021; Vieth et al. 2009), die jedoch aufgrund mangelnder Vergleichbarkeit (wechselnde Eingruppierungen bzgl. Expositionshöhe, Erweiterung des Kollektivs etc.) nicht unmittelbar zur Berechnung einer kumulativen Dosis herangezogen werden konnten. Aus den Daten der Publikationen von Vieth et al. (2009; NIOSH-Report) und Carreón et al. (2014) lässt sich jedoch ebenfalls über die Annahme einer linearen Extrapolation eine kumulative Verdoppelungsdosis für die Erkrankung an einem Harnblasenkarzinom von etwa 4000 mg o-Toluidin abschätzen (Details zur Ableitung finden sich im Infokasten, S. 187).
Bei der Ableitung der Verdopplungsdosen anhand der epidemiologischen Daten aus der Gummichemikalien-produzierenden US-amerikanischen Firma ist zu beachten, dass die zur Berechnung verwendeten Luftmessdaten (Ward et al. 1991) vom Ende der späten 1980er Jahre stammen. Auch konnten die in ihrer Höhe unbekannte Hautaufnahme des o-Toluidins ebenso wie die Verunreinigungen von Prozesschemikalien (z. B. Verunreinigung von Diphenylamin mit 4-Aminobiphenyl (Safe et al. 1977)) bei der Ableitung nicht berücksichtigt werden.
Es liegen Publikationen über weitere o-Toluidin-exponierte Kollektive mit deutlich erhöhtem Harnblasenkarznomerkrankungsrisiko vor, für die jedoch keine konkreten Expositionsdaten zur Berechnung einer kumulativen o-Toluidin-Dosis angegeben wurden (Nakano et al. 2018, 2021; Pira et al. 2010; Rubino et al. 1982; Sorahan 2008; Sorahan et al. 2000).
Für weitere, stärker wirksame krebserzeugende aromatische Amine, insbesondere das zweikernige 2-Naphthylamin und 4-Aminobiphenyl, konnte aufgrund fehlender Dosisangaben in epidemiologischen Studien kein entsprechender Ansatz in Analogie zum o-Toluidin erarbeitet werden.
Ableitung kumulativer Dosen für 2-Naphthylamin, 4-Aminobiphenyl und o-Toluidin über ein Dosis-Modell
Anhand tierexperimenteller Befunde, mittels Abrauchmaschinen im Zigarettenrauch bestimmter Konzentrationen kanzerogener aromatischer Amine und der Analogiebetrachtung epidemiologischer Erkenntnisse zum Harnblasenkarzinomerkrankungsrisiko durch das Tabakrauchen entwickelten Weiß et al. (2010) ein Modell und leiteten darüber Dosis-Risiko-Beziehungen für drei humankanzerogene aromatische Amine ab. Die aus diesen Dosis-Risiko-Beziehungen berechneten kumulativen Dosen für das verdoppelte Risiko, an einem Harnblasenkarzinom zu erkranken, lagen für 2-Naphthylamin bei ca. 6 mg, für 4-Aminobiphenyl bei ca. 1,2 mg und für o-Toluidin bei ca. 30.000 mg.
Die Ableitung von Verdopplungsdosen über das Modell von Weiß et al. (2010) wurde kontrovers diskutiert (Golka u. Bolt 2010; Henschler et al. 2012; Münch 2012; Schöps 2010; Slupinski 2013; Weiß et al. 2012; Woitowitz 2013).
Bewertung kumulativer Dosen für 2-Naphthylamin, 4-Aminobiphenyl und o-Toluidin in der Matrix
Aufgrund der Problematik der dargestellten Expositionsbewertungen sowohl aus epidemiologischen Studien als auch über den Vergleich mit dem Erkrankungsrisiko durch das Rauchen und der mit beiden Ansätzen verbundenen Unsicherheiten wurden von den Mitgliedern der Arbeitsgruppe per Konvention in Kenntnis der Publikation von Weiß et al. (2010) für die Matrix folgende Wertungen für eine nachgewiesene kumulative Exposition gegenüber 2-Naphthylamin oder 4-Aminobiphenyl im Konsens abgeleitet: bei weniger als 0,5 mg (–), bei 0,5 bis 6 mg (+) und bei mehr als 6 mg (++).
Bei einer nachgewiesenen kumulativen Exposition gegenüber o-Toluidin wurden unter Berücksichtigung der Ableitung aus epidemiologischen Daten (Schilling 2021) und in Kenntnis der Publikation von Weiß et al. (2010) im Konsens entsprechende Werte festgelegt: bei weniger als 3000 mg (–), bei 3000 bis 30.000 mg (+) und bei mehr als 30.000 mg (++). Dabei bestätigen die Ergebnisse einer aktuell publizierten Re-Analyse des initial von Ward et al. (1991, 1996) untersuchten Kollektivs (Park et al. 2021) zahlenmäßig die Ableitung des Wertes, der für die untere Intervallgrenze der o-Toluidin-Expositionen angesetzt bzw. verwendet wurde.
Weitere Risikoabschätzungen
Für einzelne Berufe sind mit der Matrix auch andere Risikoabschätzungen möglich: So waren Friseurinnen und Friseure in der Vergangenheit vor allem gegenüber K2-Stoffen (im Wesentlichen 2,4-Diaminoanisol und 2,4-Toluylendiamin), aber historisch gesehen wahrscheinlich auch gegenüber 2-Naphthylamin exponiert, wobei diese Expositionen nicht durch Messergebnisse an Arbeitsplätzen dokumentiert werden konnten. In der Metaanalyse von Harling et al. (2010) wurden nachvollziehbare Risiken für eine Friseurtätigkeit publiziert: Für eine Tätigkeit länger als 10 Jahre wurde ein Summary Risk Ratio (SRR) von 1,70 (95 % KI 1,01–2,88) beobachtet. Dieses Ergebnis steht im Einklang mit der Studie von Takkouche et al. (2009) und den von Reulen et al. (2008) publizierten Ergebnissen. Die Arbeit von Harling et al. (2010) stellt das wissenschaftliche Fundament der von der Berufsgenossenschaft für Gesundheitsdienst und Wohlfahrtspflege (BGW) initiierten Konvention zur Anerkennung eines beruflich bedingten Harnblasenkarzinoms als Berufskrankheit im Friseurhandwerk dar. Sie ist allgemein anerkannt und kommt seit Längerem in Berufskrankheitenverfahren zur Anwendung (Darstellung als Matrix siehe ➥ Abb. 2).
Die BK 1301-Matrix kann als Vorlage für weitere Matrices für Berufe wie Maler, Drucker oder Tätigkeiten in der Gummi-Industrie dienen.
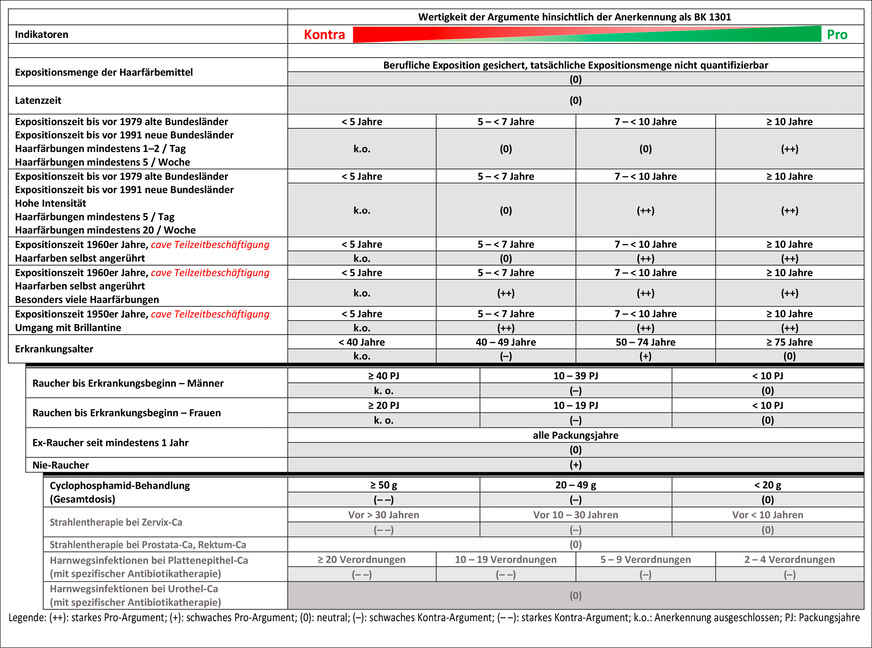
Fig. 2: BK 1301 matrix for hairdressing profession for the evaluation of occupational and non-occupational risk factors of bladder cancer in the context of an assessment of an occupational disease according to No. 1301 of the Annex to the Ordinance on Occupational Disease
Expositionsdauer
Für die Anerkennung einer Harnblasenkarzinomerkrankung durch aromatische Amine als Berufskrankheit nach Nr. 1301 ist auch die Dauer der Exposition zu beachten. Dabei sind Zeiten mit Teilzeitbeschäftigung entsprechend zu berücksichtigen. Eine Auswertung beruflich bedingter anerkannter Krebserkrankungen der Jahre 1978 bis 2010 zeigte für die BK 1301 bei Berücksichtigung von 1945 Fällen eine mittlere Einwirkdauer von 21 Jahren (Butz 2012). Gago-Dominguez et al. (2001) untersuchten 1514 an einem Harnblasenkarzinom erkrankte Personen sowie ebenso viele alters- und geschlechtsgematchte Kontrollpersonen und eruierten ein 5-fach erhöhtes Erkrankungsrisiko (95 % KI 1,3–19,2) für Friseurinnen und Friseure, die mehr als 10 Jahre in ihrem Beruf arbeiteten und dabei gegenüber Azofarbstoffen in Haarfärbemitteln exponiert waren. Diese Studie wurde korrekt und nachvollziehbar durchgeführt, ist jedoch nicht ohne weiteres auf andere Kollektive übertragbar (Bolt u. Golka 2007). Harling et al. (2010) fanden in ihrer Metaanalyse von 42 Studien ein signifikant erhöhtes Risiko für Friseurinnen und Friseure, an einem Harnblasenkarzinom zu erkranken, die länger als 10 Jahre in ihrem Beruf arbeiteten. Im Schrifttum zur Begutachtung werden als ausreichend lange Expositionszeit gegenüber krebserzeugenden aromatischen Aminen für die Anerkennung einer Harnblasenkarzinomerkrankung als Berufskrankheit mehr als 10 Jahre angegeben (Bichler 2004; Valentin et al. 1988). Um ein erhöhtes Harnblasenkarzinomerkrankungsrisiko auch bei kürzerer Expositionszeit annehmen zu können, ist eine entsprechend höhere Exposition notwendig. Aus den dargestellten Angaben ergeben sich für die Matrix für eine Expositionsdauer von weniger als einem Jahr die Wertung (–), für 1 bis weniger als 5 Jahre Exposition (0), für 5 bis 10 Jahre Exposition (+) und bei mehr als 10 Expositionsjahren (++).
Expositionshäufigkeit und -intensität
Für die Beurteilung oder Bewertung des Ursachenzusammenhangs des Harnblasenkarzinoms sind auch Häufigkeit und Intensität der Exposition gegenüber krebserzeugenden aromatischen Aminen während der Expositionsdauer zu betrachten. Dabei ist eine Expositionshäufigkeit im Jahresdurchschnitt von weniger als einer Stunde pro Woche als (–), von 1 bis 15 Stunden pro Woche als (+), von mehr als 15 bis 30 Stunden pro Woche als (++) und von mehr als 30 Stunden pro Woche als (+++) zu werten.
Hinsichtlich der Expositionsintensität ist zwischen sehr gering (–), gering (+), mittel (++) und hoch (+++) zu unterscheiden. Auch bei Reparaturarbeiten an offenen Systemen ist die Expositionsintensität je Tätigkeit als Bystander, Anwender oder in der Produktion von (+) bis (++) zu bewerten.
Alle Aspekte zur Expositionshäufigkeit und -intensität dienen der möglichst umfassenden Anamneseerhebung und müssen in der Zusammenschau bewertet werden.
Erkrankungsalter in Jahren
Das mittlere Erkrankungsalter für das Harnblasenkarzinom in Deutschland liegt bei knapp 75 Jahren, wobei Männer etwas früher als Frauen erkranken (Kraywinkel et al. 2018). Eine Erkrankung in einem höheren Alter gibt keinen besonderen Hinweis auf einen beruflich bedingten Einfluss. Sie stellt aber auch kein Abschneidekriterium dar (Matrixwertung: > 75 Jahre (0)). Ein Erkrankungsalter zwischen 40 und 49 Jahren (–) und erst recht eine Erkrankung an einem Harnblasenkarzinom vor dem 40. Lebensjahr (– –) geben eher Hinweise auf eine genetische Disposition, nicht jedoch, von sehr hohen Expositionen in jungen Jahren einmal abgesehen, auf einen besonderen beruflich bedingten Einfluss. Auch wenn die Harnblasenkrebsinzidenz in der Allgemeinbevölkerung ab etwa dem 50. Lebensjahr ansteigt, müssen aufgrund des mittleren Erkrankungsalters von 75 Jahren für das Harnblasenkarzinom Erkrankungen im Alter von 50 bis 75 Jahren als vorgezogene Erkrankungen betrachtet werden und weisen auf einen möglichen beruflich bedingten Einfluss hin (+). So lag das Erkrankungsalter der Versicherten, bei denen eine Berufskrankheit anerkannt wurde, im Durchschnitt bei 67,4 ± 9,5 Jahren (Butz 2012).
Latenzzeit
Die Latenzzeit beim Harnblasenkarzinom, also die Zeit von der ersten Exposition gegenüber krebserzeugenden aromatischen Aminen bis zur Diagnose des Tumors, kann mehrere Jahrzehnte dauern. Im Zeitraum der von 1978 bis 2016 anerkannten BK 1301-Fälle wurde eine mittlere Latenzzeit von etwa 40 Jahren beobachtet (Butz 2012; DGUV 2019). Latenzzeiten von weniger als 10 Jahren sprechen eher gegen eine berufliche Verursachung (–). Als typische Latenzzeiten werden 15 bis 40 Jahre angegeben (+). Alle anderen Latenzzeiten („10 bis weniger als 15 Jahre“ sowie „mehr als 40 Jahre“) werden als (0) bewertet.
Diese per Konvention festgelegten Latenzzeiträume sind auch vor dem Hintergrund zu sehen, dass in der überwiegenden Zahl der Fälle relevante berufliche Expositionen gegenüber krebserzeugenden aromatischen Aminen zeitlich länger zurückliegen. Daher sind Expositionen aus jüngerer Zeit in der überwiegenden Anzahl der Fälle als geringer einzuschätzen und damit kurze Latenzzeiten bei beruflich verursachten Harnblasenkarzinomen heutzutage eher unwahrscheinlich.
Interimszeit
Aus der Literatur gibt es im Gegensatz zu den Daten bei Raucherinnen und Rauchern keine Hinweise darauf, dass die Interimszeit, also die Dauer der Zeit zwischen dem letzten beruflichen Kontakt zum Gefahrstoff und der Erstdiagnose der Erkrankung, spezifisch für eine berufliche Verursachung ist. In der Studie von Sorahan (2008) ergab sich ein statistisch signifikant positiver Trend in den Standardized Mortality Ratios (SMRs) für Harnblasenkarzinome (p < 0,05) mit dem Zeitraum ab Beginn der Exposition, aber kein Hinweis auf eine Abnahme der Risiken mit dem Zeitraum ab Beendigung der Exposition. Systematische Untersuchungen der Interimszeit beruflich exponierter Kollektive fehlen aber weitgehend. Lediglich in der Studie von Pira et al. (2010) wurde bei hoch gegenüber krebserzeugenden aromatischen Aminen exponierten Arbeitern aus der Farbstoffindustrie in den ersten 29 Jahren nach Expositionsende zwar eine Abnahme des Standardized Mortality Ratios, aber keine Abnahme des absoluten Risikos pro 1000 „man-years“ für die Erkrankung an einem Harnblasenkarzinom beobachtet.
Aufgrund der genannten Überlegungen wird die Interimszeit in der Matrix nicht berücksichtigt.
Rauchen
Hinsichtlich des Rauchens hat sowohl bei Männern als auch bei Frauen etwa die Hälfte der an einem Harnblasenkarzinom Erkrankten eine positive Anamnese (Freedman et al. 2011). Im Gegensatz zu den Studien mit durch eine berufliche Exposition gegenüber krebserzeugenden aromatischen Aminen verursachten Harnblasenkarzinomen ist dabei in den größeren Studien zum Rauchverhalten das relative Harnblasenkarzinomerkrankungsrisiko nicht größer als 6 (Brennan et al. 2000).
In der Literatur findet sich für die Verdoppelung des Harnblasenkarzinomerkrankungsrisikos (relatives Risiko von 2) ein Bereich von 15 bis 38 Packungsjahren („pack years“) (Hours et al. 1994; Pesch et al. 2000; Puente et al. 2006; Vena et al. 1993), wobei 1 Packungsjahr 20 gerauchten Zigaretten pro Tag über ein Jahr entspricht.
Für die Bewertung der Verdoppelungsdosis durch das Rauchen werden häufig die Daten aus den gepoolten Studien von Brennan et al. (2000, 2001) als grundlegend herangezogen (AWMF 2020; IARC 2004). In diesen Studien finden sich sowohl Angaben zum Erkrankungsrisiko bei unterschiedlicher Dauer der Rauchanamnese in Jahren und pro Tag gerauchter Zigaretten (➥ Tabelle 1) als auch Angaben zur Risikoreduktion nach Aufgabe des Rauchens bei unterschiedlich langer Rauchanamnese (➥ Tabelle 2). Als ursächlich für die Verdoppelung des Harnblasenkarzinomerkrankungsrisikos werden etwa 20 Packungsjahre angegeben. Auch wenn das durch das Rauchen bedingte Harnblasenkarzinomerkrankungsrisiko in den ersten 3 bis 4 Jahren nach Aufgabe des Rauchens bereits um etwa 30 % sinkt und sich nach 20 Jahren dem eines Nie-Rauchers nähert, erreicht es dieses nicht mehr. Bei beruflich exponierten Kollektiven konnte ein Rückgang des Risikos nach Beendigung der beruflichen Exposition nicht eindeutig belegt werden (Pira et al. 2010).
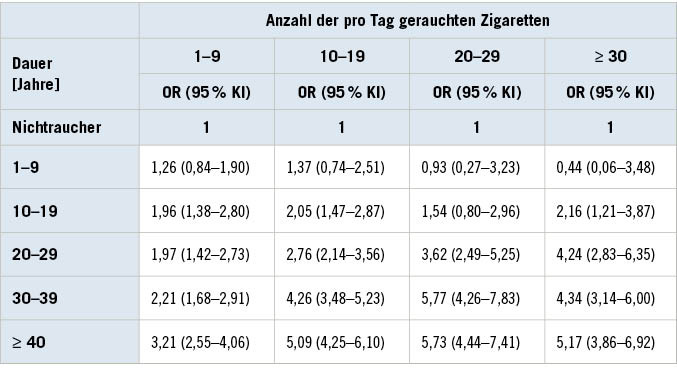
Table 1: Urinary bladder cancer risk (odds ratio (OR)) for men as a function of duration of smoking and number of cigarettes smoked per day (after Brennan et al. 2000)
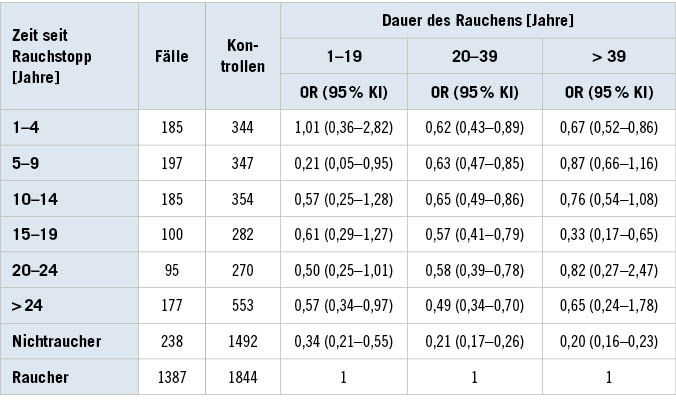
Table 2: Urinary bladder cancer risk (odds ratio (OR)) for men after smoking cessation as a function of smoking duration (after Brennan et al. 2000)
In der Matrix für die BK 1301 wird der Indikator Rauchen in Abhängigkeit vom Erkrankungsbeginn und unterschiedlichen Zeitspannen des Ex-Rauchens als starkes Kontra-Argument (– –) bis neutrales Argument (0) eingestuft. Bei erst kurzfristig zurückliegender Beendigung des Rauchens (< 5 Jahre) ist insbesondere bei höherer stattgehabter Rauchintensität der Manifestationszeitpunkt des initialen Karzinoms abzuschätzen.
Während bezüglich des Rauchens für die BK 1301-Matrix für krebserzeugende aromatische Amine die Daten von Brennan et al. (2000, 2001) zugrunde gelegt wurden (siehe Abb. 1, Tabellen 1 und 2), weichen die per Konvention von der Berufsgenossenschaft Gesundheitsdienst und Wohlfahrtspflege (BGW) festgelegten Bewertungen für Friseure aus historischen Gründen davon ab (siehe Abb. 2).
Weitere außerberufliche Einflussfaktoren auf das Harnblasenkarzinomerkrankungsrisiko
Die folgenden Indikatoren sind in der Praxis aufgrund ihrer Seltenheit eher von geringer Bedeutung. Bei entsprechender Anamnese werden Einstufungen von stark kontra (– –) bis neutral (0) vorgenommen.
Chemotherapie mit Cyclophosphamid
Eine Chemotherapie mit dem Therapeutikum Cyclophosphamid kann Harnblasentumoren verursachen. Fairchild et al. (1979) beobachteten in einem Kollektiv von 19.040 Tumorpatienten mit einer Überlebenszeit von mehr als 5 Jahren im Teilkollektiv der 170 Cyclophosphamid-therapierten Patienten eine 9-fach erhöhte Harnblasenkarzinominzidenz. In einer weiteren Studie waren von 148 nach einer Cyclophosphamid-Therapie aufgetretenen Zweittumoren 21 % Harnblasentumoren (Schmähl 1988). Travis et al. (1995) beobachteten 31 Harnblasenkarzinome bei 6171 wegen eines Non-Hodgkin-Lymphoms mit Cyclophosphamid behandelten Patientinnen und Patienten. Mit höheren kumulativen Cyclophosphamid-Dosen stieg auch das Erkrankungsrisiko von 2,4-fach bei einer Gesamtdosis von weniger als 20 g Cyclophosphamid bis auf 14,5-fach bei einer Gesamtdosis von mehr als 50 g. Bei der Therapie nicht-tumoröser Erkrankungen wie z. B. schwerer, progredienter Formen von Lupus-Nephritis und Granulomatose mit Polyangiitis (Wegener-Granulomatose) werden meist höhere Dosen erreicht als bei der Therapie von Tumoren (Baxter Oncology 2015). Durch die Einnahme von Uromitexan zum Schutz vor der akuten toxischen Wirkung des Cyclophosphamids auf die Harnblase (hämorrhagische Zystitis) wurde im Tierversuch bei der Ratte die Entstehung von Harnblasenkarzinomen vermindert (Habs u. Schmähl 1983).
Auch für das Zytostatikum Cisplatin wird das Harnblasenkarzinom als Therapiefolgeerkrankung diskutiert (Groot et al. 2018; van den Belt-Dusebout et al. 2007).
Zweittumoren nach Bestrahlung
Eine Strahlentherapie im kleinen Becken kann ein weiteres außerberufliches Risiko für Harnblasenkarzinome sein und mit einer Latenzzeit von mehreren Jahren zur Entwicklung eines Harnblasenkarzinoms führen (AWMF 2020). Insbesondere in früheren Jahrzehnten traten nach Strahlentherapien von Gebärmuttertumoren vermehrt Harnblasentumoren auf. So beobachteten Boice et al. (1985) bei 182.040 Frauen mit einer Therapie wegen eines Zervixkarzinoms mehr Harnblasenkarzinome im Teilkollektiv der mit einer Strahlentherapie behandelten Patientinnen, wobei das Erkrankungsrisiko mit der Zeit auf bis zu 8,5 nach ≥ 30 Jahren seit der Strahlentherapie zunahm. Bei 104.764 Zervixkarzinompatientinnen, die ihre Tumortherapie mehr als ein Jahr überlebt hatten (Chaturvedi et al. 2007), erkrankten 536 Patientinnen nach externer und/oder intrakavitärer Strahlentherapie an einem Harnblasenkarzinom (SIR 3,51; 95 % KI 3,22–3,83). Ohne Strahlentherapie erkrankten dagegen 109 Patientinnen (SIR 1,93; 95 % KI 1,59–2,34). Das Harnblasenkarzinomerkrankungsrisiko nach der Strahlentherapie erhöhte sich dabei signifikant über die Zeit (p < 0,001): Latenzzeit von 1–9 Jahren (n = 127) SIR 2,70; von 10–19 Jahren (n = 130) SIR 2,84; von 20–29 Jahren (n = 152) SIR 4,13; von 30–39 Jahren (n = 101) SIR 5,44; von ≥ 40 Jahren (n = 26) SIR 5,83. Bei Patientinnen mit vor längerer Zeit erfolgter kurativer, aber, aus heutiger Sicht, technisch veralteter Bestrahlung sind erhöhte Harnblasenkarzinomerkrankungsrisiken möglich (AWMF 2020).
In einem Kollektiv von Prostatakarzinompatienten mit Strahlentherapie (n = 34.889) war das Risiko eines Harnblasenkarzinoms 5–8 Jahre nach Therapie 1,3-fach (95 % KI 1,0–1,7) und nach mehr als 8 Jahren 1,5-fach (95 % KI 1,1–2,0) erhöht (Neugut et al. 1997). Brenner et al. (2000) werteten die Daten zwischen 1973 und 1993 von Patienten mit einem Prostatakarzinom aus und ermittelten das Risiko von Zweittumoren nach Strahlentherapie (insgesamt 51.584 Patienten, davon entwickelten 3549 Zweittumoren) und nach chirurgischer Intervention (insgesamt 70.539 Patienten, davon 5055 mit Zweittumoren). Dabei beobachteten sie bei den strahlentherapeutisch behandelten im Vergleich zu den chirurgisch therapierten Patienten eine Erhöhung des Harnblasenkarzinomerkrankungsrisikos von 15 % nach einem Jahr (Risiko für „observed/expected“ von 1,10 vs. 0,97), 55 % nach 5 Jahren (Risiko von 1,20 vs. 0,77) und 77 % nach 10 Jahren (Risiko von 1,32 vs. 0,75), aber insgesamt niedrige Risiken. Wallis et al. (2016) betrachteten in ihrer Metaanalyse von 22 Studien das Risiko von Zweittumoren nach Strahlentherapie eines Prostatakarzinoms. Strahlentherapierte Patienten hatten dabei ein höheres Harnblasenkarzinomerkrankungsrisiko als nicht strahlentherapierte, wobei jedoch die berichteten absoluten Raten niedrig waren. Für das Harnblasenkarzinom als Zweittumor wurde eine absolute Differenz der Inzidenz von 0,6 pro 100 Patienten beobachtet.
Eine kanadische Kohortenstudie zeigte für strahlentherapierte Rektumkarzinompatientinnen und -patienten kein erhöhtes Risiko für die Erkrankung an einem Harnblasenkarzinom (Kendal u. Nicholas 2007). In einer Kohortenstudie mit 28.220 bestrahlten Rektumkarzinompatientinnen und -patienten aus Taiwan war das Harnblasenkarzinomerkrankungsrisiko bei einer mittleren Nachbeobachtungszeit von 5,2 Jahren nicht signifikant erhöht (1,55; 95 % KI 0,90–2,64; Wang et al. 2018). Eine große niederländische gepoolte Analyse von Phase-III-Studien mit individuellen Patientendaten von 2554 strahlentherapeutisch behandelten Rektum- oder Endometriumkarzinompatienten zeigte kein erhöhtes Erkrankungsrisiko für Zweittumoren durch die Strahlentherapie (Wiltink et al. 2015). Insgesamt führt die Strahlentherapie von Prostata- oder Rektumkarzinomen zu einer geringen Risikoerhöhung für eine Harnblasenkarzinomerkrankung (Hoeller et al. 2021). Daher erscheint diese als nicht relevant bei der Zusammenhangsbegutachtung beruflich bedingter Harnblasenkarzinome.
Aufgrund der aus heutiger Sicht teilweise technisch veralteten Bestrahlungen ist bei Patientinnen und Patienten mit vorangegangener Strahlentherapie im Rahmen der arbeitsmedizinischen Begutachtung in einem Berufskrankheitenverfahren ein strahlenbiologisches Zusatzgutachten zu empfehlen.
Harnwegsinfektionen mit Antibiotikatherapie bei Plattenepithel- und Urothelkarzinom
Es gibt einige Krankheitsbilder, die zu einem erhöhten Erkrankungsrisiko für Harnblasenkarzinome führen können, wie rezidivierende Zystitiden. In einer historischen epidemiologischen Studie mit 2982 Harnblasenkarzinompatientinnen und -patienten und 5782 Kontrollen zeigte sich ein signifikant erhöhtes Erkrankungsrisiko bei Personen, die drei oder mehr Harnwegsinfektionen hatten (Kantor et al. 1984). Eine Übersichtsarbeit zeigte, dass 5 von 6 Studien eine Assoziation zwischen dem Harnblasenkarzinomrisiko und Harnwegsinfektionen beschrieben (Abol-Enein 2008).
Eine landesweite dänische Studie mit insgesamt 12.271 Harnblasenkarzinompatientinnen und -patienten und alters- und geschlechtsgematchten Kontrollen zeigte bei 333 Personen mit einem Plattenepithelkarzinom eine klare Dosis-Wirkungs-Beziehung zwischen Infektionen des Urogenitaltrakts und Plattenepithelkarzinomen der Harnblase. Zehn und mehr Verschreibungen von harnwegsspezifischen Antibiotika führten nach Volladjustierung zu einem OR für das Plattenepithelkarzinom von 11,4 (95 % KI 7,6–17,2), zwei bis vier Verschreibungen zu einem OR von 2,5 (95 % KI 1,7–3,7) und fünf bis neun Verschreibungen zu einem OR von 4,1 (95 % KI 2,7–6,4). Bei Personen mit einem Urothelkarzinom zeigte sich kein signifikant erhöhtes Erkrankungsrisiko bei Verschreibung von entsprechenden Antibiotika (n = 11.029; OR 1,13; 95 % KI 0,97–1,32; Pottegård et al. 2020).
Bilharziose
Durch eine der weltweit verbreitetsten parasitären Infektionskrankheiten, die durch Schistosoma haematobium ausgelöste Bilharziose, wird nach Befall der Harnblase ein erheblich erhöhtes Harnblasenkarzinomrisiko beobachtet (AWMF 2020; Kadhum et al. 2018). Da diese Erkrankung aber bereits häufig zu Beginn Beschwerden macht und durch Medikamente gut therapierbar ist, erscheint die Erkrankung an einem Harnblasenkarzinom durch eine chronische Bilharziose in Deutschland eher unwahrscheinlich (Golka 2007). Genaue Informationen über die Häufigkeit dieser nicht meldepflichtigen Tropenkrankheit liegen für Deutschland nicht vor. Im Surveillance-System SIMPID wurden 24 Bilharziose-Erkrankungen im Jahr 2005 gemeldet (RKI 2006). In anderen Regionen der Erde haben die durch eine chronische Bilharziose bedingten Harnblasenkarzinome einen Anteil von mehr als 50 % der Erkrankungen (Salem u. Mahfouz 2012), so dass bei Erkrankten mit beruflichem Auslandsaufenthalt in Endemiegebieten in der Anamnese oder mit entsprechendem Migrationshintergrund ein durch die Bilharziose bedingtes Harnblasenkarzinom differentialdiagnostisch in Betracht gezogen und ggf. eine BK-Verdachtsanzeige nach Nr. 3104 der Anlage zur BKV gestellt werden sollte (Golka 2007; Werfel 2007).
Harnblasensteine
Sun et al. (2013) untersuchten 21.862 Patientinnen und Patienten mit Steinen des Urogenitalsystems und beobachteten signifikant erhöhte Harnblasenkarzinomerkrankungsrisiken nach Harnblasen- und Nierensteinen, wobei die Risiken bei Frauen höher als bei Männern waren. In einer Kohortenstudie mit 42.732 Personen mit Harnsteinen (Lin et al. 2016) fand sich ein signifikant erhöhtes Harnblasenkarzinomerkrankungsrisiko von 1,94 (95 % KI 1,62–2,33), wobei Frauen ein höheres Risiko hatten als Männer. Kantor et al. (1984) beobachteten in ihrer historischen Studie mit 2982 Harnblasenkarzinompatientinnen und -patienten und 5782 Kontrollen aus den USA ein erhöhtes Erkrankungsrisiko von 1,8 (95 % KI 1,1–2,8) bei Harnblasensteinen ohne und von 2,0 (95 % KI 1,3–3,2) mit Infektionen. Für Nierensteine zeigte sich in der Studie kein erhöhtes
Risiko.
Teersalben
Als weiterer außerberuflicher Faktor für die Erhöhung des Erkrankungsrisikos an einem Harnblasenkarzinom wird die Verwendung von Teersalben in der Therapie schwerer dermatologischer Erkrankungen diskutiert. Roelofzen et al. (2015) untersuchten in einer bevölkerungsbasierten Fall-Kontroll-Studie mit 1387 Harnblasenkarzinompatientinnen und -patienten und 5182 Kontrollen das Harnblasenkarzinomrisiko durch die Verwendung teerhaltiger Salben bei dermatologischen Therapien. Dabei beobachteten die Autoren nach Adjustierung für Alter, Geschlecht und Raucherstatus (inklusive Dauer und Intensität) ein nichtsignifikantes Odds Ratio von 1,37 (95 % KI 0,93–2,01) für die Erkrankung an einem Harnblasenkarzinom und sahen daher diesbezüglich keinen Grund für Sicherheitsbedenken nach der Verwendung von Steinkohlenteerpräparaten in der dermatologischen Praxis.
Genetische Suszeptibilitätsfaktoren
Für verschiedene fremdstoffmetabolisierende Enzyme, wie die N-Acetyltransferase 2 (NAT2; Substrat: aromatische Amine) werden Polymorphismen als Suszeptibilitätsfaktoren für das Harnblasenkarzinom diskutiert. So wurde in früheren Jahrzehnten eindeutig eine Assoziation zwischen dem Auftreten eines Harnblasenkarzinoms und der Exposition gegenüber krebserzeugenden aromatischen Aminen gezeigt, die durch den Acetyliererstatus moduliert wurde. Langsame Acetylierer hatten dabei ein erhöhtes Risiko für Harnblasenkarzinomerkrankungen (Cartwright et al. 1982; Golka et al. 1996, 2002, 2007). In neueren Studien ist der langsame Acetyliererstatus in der Mehrzahl der Studien kein Suszeptibilitätsfaktor mehr für das Harnblasenkarzinom (Ovsiannikov et al. 2012; Pesch et al. 2013). Die Ursachen hierfür liegen nicht in der Methodik, da von drei verschiedenen Arbeitsgruppen gezeigt wurde, dass die Übereinstimmung zwischen Geno- und Phänotyp bei über 90 % liegt (Agúndez et al. 1994; Cascorbi et al. 1995; Golka et al. 1996). Als Ursache hierfür ist in erster Linie die früher höhere Exposition gegenüber aromatischen Aminen in Betracht zu ziehen. Für diese Annahme spricht auch, dass der ultralangsame Acetyliererstatus auch in neueren Studien noch ein erhöhtes Risiko für das Harnblasenkarzinom anzuzeigen vermag (Selinski et al. 2015). Dieser ist aber aufgrund seiner Seltenheit, er liegt nur bei etwa 8 % der Allgemeinbevölkerung vor, für die Kausalitätsbetrachtung nicht relevant. Die Ergebnisse genomweiter Assoziationsstudien ergaben hinsichtlich weiterer Polymorphismen keine für die Begutachtung verwertbaren Ergebnisse. Lediglich bei den Glutathion-S-Transferasen gibt es für den GSTM1-negativen Genotyp Hinweise auf eine Modulation des Risikos einer Harnblasenkarzinomerkrankung durch Fremdstoffe. Dabei sind die Substrate für die GSTM1 u. a. hochreaktive Stoffwechselprodukte von krebserzeugenden polyzyklischen aromatischen Kohlenwasserstoffen (Figueroa et al. 2015; Golka et al. 1997; Lukas et al. 2017; Roth et al. 2012).
Die Ergebnisse der Studien zu Enzympolymorphismen reichen bisher nicht aus, um gegenwärtig genetische Suszeptibilitätsfaktoren als wesentliche Argumente bei der Begutachtung heranzuziehen. Daher werden diese auch in der Matrix nicht berücksichtigt. Bei den Expositionsverhältnissen der letzten Jahrzehnte spielt der Acetyliererstatus nur noch eine untergeordnete Rolle. Bei lange zurückliegenden Expositionen spricht ein langsamer Acetyliererstatus eher für als gegen eine berufliche Verursachung der Harnblasenkarzinomerkrankung. Die Matrix ist aber auch bei schnellem Acetyliererstatus anzuwenden.
Anwendungsbeispiel
Ein Beispiel für die Anwendung der Matrix in der Kausalitätsbeurteilung bei Verdacht auf Vorliegen einer Berufskrankheit nach Nr. 1301 der BKV findet sich in ➥ Abb. 3.
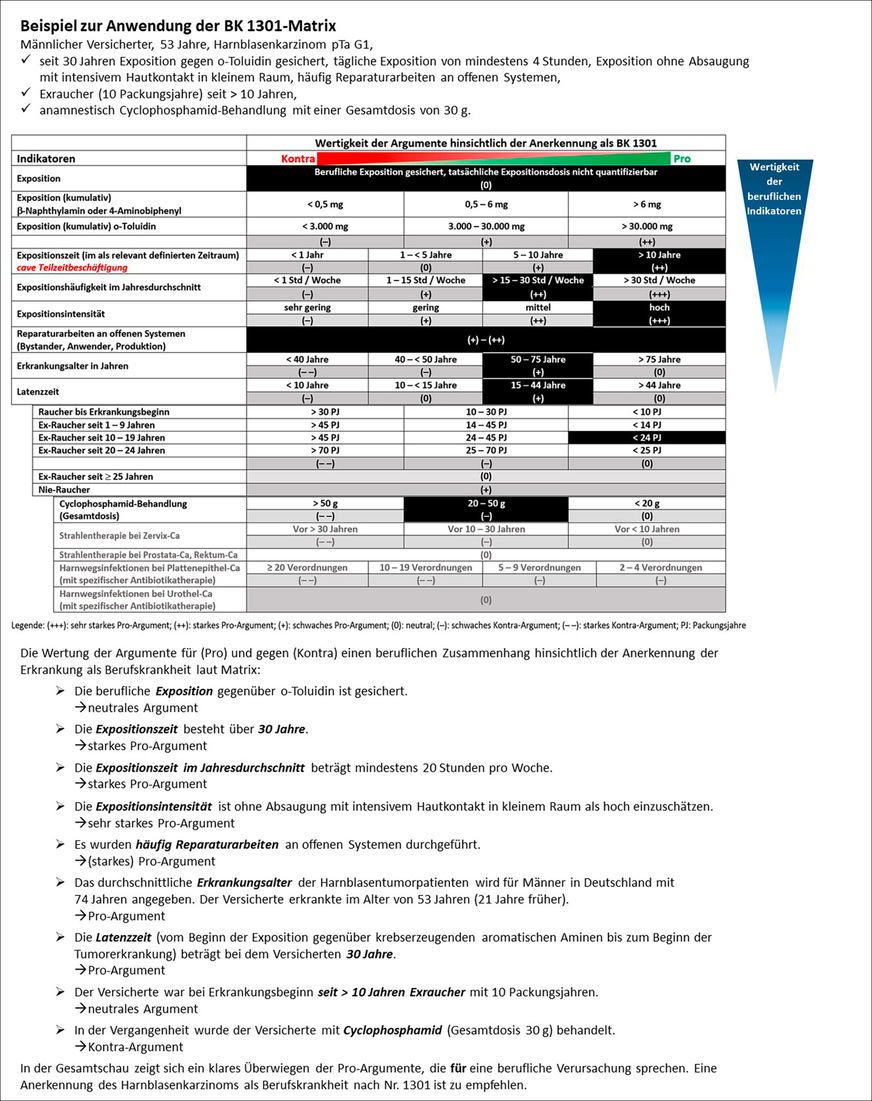
Fig. 3: BK 1301 matrix – application example
Fazit
Mit dieser Matrix wurde die Basis für eine Konvention hinsichtlich der Kausalitätsbeurteilung bei Einwirkung krebserzeugender aromatischer Amine und Verdacht auf Vorliegen einer Berufskrankheit nach Nr. 1301 der BKV auch bei fehlender konkreter kumulativer Expositionsdosis geschaffen. Diese kann vereinfachte Anerkennungsverfahren, besser nachvollziehbare Entscheidungen der Rechtsanwender und so eine einheitlichere und damit gerechtere Beurteilung aller betroffenen Versicherten ermöglichen.
Danksagung
Wir danken Dr. R. Böthig, Prof. Dr. A. Nienhaus, Dr. D. Pucknat, Prof. Dr. E. Richter, Dr. W. Schöps und allen Teilnehmenden des Workshops „Expositionsabschätzung für das Harnblasenkrebsrisiko durch aromatische Amine“.
Literatur
Abol-Enein H: Infection: Is it a cause of bladder cancer? Scandinavian Journal of Urology and Nephrology. Supplementum 2008; 218; 79–84.
Agúndez JA, Martínez C, Olivera M, Ledesma MC, Ladero JM, Benítez J: Molecular analysis of the arylamine N-acetyltransferase polymorphism in a Spanish population. Clinical Pharmacology and Therapeutics 1994; 56 (2): 202–209.
Ärztlicher Sachverständigenbeirat: Wissenschaftliche Stellungnahme zu der Berufskrankheit Nr. 1301 der Anlage 1 zur Berufskrankheiten-Verordnung „Schleimhautveränderungen, Krebs oder andere Neubildungen der Harnblase durch aromatische Amine“. Gemeinsames Ministerialblatt 2011; 18.
AWMF (2020): Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF): S3-Leitlinie Früherkennung, Diagnose, Therapie und Nachsorge des Harnblasenkarzinoms, Langversion 2.0, 2020 (AWMF-Registrierungsnummer 03 2/038OL). Retrieved January, 10, 2022 from https://www.leitlinienprogramm-onkologie.de/fileadmin/user_upload/Downl…
Baxter Oncology (2015): Fachinformation: ENDOXAN Lyophilisat 500 mg/1 g/2 g. Pulver zur Herstellung einer Injektionslösung. Retrieved January, 10, 2022 from https://www.baxter.de/sites/g/files/ebysai1301/files/2019-01/ENDOXAN_Ly…
Bichler K-H: Das urologische Gutachten (2. Auflage). Berlin, Heidelberg: Springer Verlag, 2004.
Boice JD, Day NE, Andersen A, Brinton LA, Brown R, Choi NW, Clarke EA, Coleman MP, Curtis RE, Flannery JT: Second cancers following radiation treatment for cervical cancer. An international collaboration among cancer registries. Journal of the National Cancer Institute 1985; 74 (5): 955–975.
Bolt HM, Golka K: The debate on carcinogenicity of permanent hair dyes: new insights. Critical Reviews in Toxicology 2007; 37 (6): 521–536.
Böthig R, Schöps W, Zellner M, Fiebag K, Kowald B, Hirschfeld S, Thietje R, Kurze I,
Böhme H, Kaufmann A, Jungmann O, Zumbé J, Porres D, Lümmen G, Nehiba M, Kadhum T, Forchert M, Golka K: Harnblasenkarzinom als Spätfolge einer Querschnittlähmung: Entscheidungshilfe für eine Zusammenhangsbegutachtung. Der Urologe 2020; 59 (6): 700–709.
Böthig R, Schöps W, Zellner M, Fiebag K, Kowald B, Hirschfeld S, Thietje R, Kurze I,
Böhme H, Kaufmann A, Jungmann O, Zumbé J, Porres D, Nehiba M, Kadhum T, Golka K, Forchert M: Ursachenzusammenhang zwischen langjähriger Querschnittlähmung und malignen Harnblasentumoren. Trauma und Berufskrankheit 2019; 21 (1): 61–73.
Brennan P, Bogillot O, Cordier S, Greiser E, Schill W, Vineis P, Lopez-Abente G, Tzonou A, Chang-Claude ., Bolm-Audorff U, Jöckel KH, Donato F, Serra C, Wahrendorf J, Hours M, T’Mannetje A, Kogevinas M, Boffetta P: Cigarette smoking and bladder cancer in men: A pooled analysis of 11 case-control studies. International Journal of Cancer 2000; 86 (2): 289–294.
Brennan P, Bogillot O, Greiser E, Chang-Claude J, Wahrendorf J, Cordier S, Jöckel KH, Lopez-Abente G, Tzonou A, Vineis P, Donato F, Hours M, Serra C, Bolm-Audorff U, Schill W, Kogevinas M, Boffetta P: The contribution of cigarette smoking to bladder cancer in women (pooled European data). Cancer Causes & Control 2001; 12 (5): 411–417.
Brenner DJ, Curtis RE, Hall EJ, Ron E: Second malignancies in prostate carcinoma patients after radiotherapy compared with surgery. Cancer 2000; 88 (2): 398–406.
Butz M: Beruflich verursachte Krebserkrankungen. Eine Darstellung der im Zeitraum 1978 bis 2010 anerkannten Berufskrankheiten. Dokumentation des Berufskrankheiten-Geschehens in Deutschland. 8. Auflage, St. Augustin: Deutsche Gesetzliche Unfallversicherung (DGUV), 2012.
Carreón T, Hein MJ, Hanley KW, Viet SM, Ruder AM: Bladder cancer incidence among workers exposed to o-toluidine, aniline and nitrobenzene at a rubber chemical manufacturing plant. Occupational and Environmental Medicine 2014; 71 (3), 175–182.
Carreón T, Hein MJ, Viet SM, Hanley KW, Ruder AM, Ward EM: Increased bladder cancer risk among workers exposed to o-toluidine and aniline: A reanalysis. Occupational and Environmental Medicine 2010; 67 (5): 348–350.
Cartwright RA, Glashan RW, Rogers HJ, Ahmad RA, Barham-Hall D, Higgins E, Kahn MA: Role of N-acetyltransferase phenotypes in bladder carcinogenesis: A pharmacogenetic epidemiological approach to bladder cancer. Lancet (London, England) 1982; 2 (8303): 842–845.
Cascorbi I, Drakoulis N, Brockmöller J, Maurer A, Sperling K, Roots I: Arylamine N-acetyltransferase (NAT2) mutations and their allelic linkage in unrelated Caucasian individuals: Correlation with phenotypic activity. American Journal of Human Genetics 1995; 57 (3): 581–592.
Chaturvedi AK, Engels EA, Gilbert ES, Chen BE, Storm H, Lynch CF, Hall P, Langmark F, Pukkala E, Kaijser M, Andersson M, Fosså SD, Joensuu H, Boice JD, Kleinerman RA, Travis LB: Second cancers among 104,760 survivors of cervical cancer: Evaluation of long-term risk. Journal of the National Cancer Institute 2007; 99 (21): 1634–1643.
DGUV: BK-Report 01/2019: Aromatische Amine. Eine Arbeitshilfe in Berufskrankheiten-Feststellungsverfahren. 5. aktualisierte Auflage des BK-Reports 1/2009. Berlin: DGUV, 2019. ISBN: 978-3-948657-03-1.
Fairchild WV, Spence CR, Solomon HD, Gangai MP: The incidence of bladder cancer after cyclophosphamide therapy. The Journal of Urology 1979; 122 (2): 163–164.
Figueroa JD, Koutros S, Colt JS, Kogevinas M, Garcia-Closas M, Real FX, Friesen MC, Baris D, Stewart P, Schwenn M, Johnson A, Karagas MR, Armenti KR, Moore LE, Schned A, Lenz P, Prokunina-Olsson L, Banday AR, Paquin A, Ylaya K, Chung J-Y, Hewitt SM, Nickerson ML, Tardón A, Serra C, Carrato A, García-Closas R, Lloreta J, Malats N, Fraumeni JF, Chanock SJ, Chatterjee N, Rothman N, Silverman DT: Modification of occupational exposures on bladder cancer risk by common genetic polymorphisms. Journal of the National Cancer Institute 2015; 107 (11), djv223.
Freedman ND, Silverman DT, Hollenbeck AR, Schatzkin A, Abnet CC: Association between smoking and risk of bladder cancer among men and women. Journal of the American Medical Association 2011; 306 (7): 737–745.
Gago-Dominguez M, Castelao JE, Yuan JM, Yu MC, Ross RK: Use of permanent hair dyes and bladder-cancer risk. International Journal of Cancer 2001; 91 (4), 575–579.
Golka K: Ätiologie und Prävention des Harnblasenkarzinoms: Schlusswort. Deutsches Ärzteblatt 2007; 104 (27): 1998–1999.
Golka K, Bolt H: Leserbrief 1 zu Weiß et al. Berufskrankheit 1301 (Arbeitsmed Sozialmed Umweltmed 2010; 45: 222-235). Arbeitsmedizin Sozialmedizin Umweltmedizin 2010; 45: 689–690.
Golka K, Prior V, Blaszkewicz M, Bolt HM: The enhanced bladder cancer susceptibility of NAT2 slow acetylators towards aromatic amines: A review considering ethnic differences. Toxicology Letters 2002; 128 (1–3): 229–241.
Golka K, Prior V, Blaszkewicz M, Cascorbi I, Schöps W, Kierfeld G, Roots I, Bolt HM: Occupational history and genetic N-acetyltransferase polymorphism in urothelial cancer patients of Leverkusen, Germany. Scandinavian Journal of Work, Environment & Health 1996; 22 (5), 332–338.
Golka K, Reckwitz T, Kempkes M, Cascorbi I, Blaszkewicz M, Reich SE, Roots I, Soekeland J, Schulze H, Bolt HM: N-Acetyltransferase 2 (NAT2) and glutathione S-transferase µ (GSTM1) in bladder-cancer patients in a highly industrialized area. International Journal of Occupational and Environmental Health 1997; 3 (2), 105–110.
Golka K, Schöps W: Aromatische Amine (BK 1301). In: Krebs und Arbeit – Arbeits- und sozialmedizinische Aspekte. Landsberg am Lech: ecomed-Storck GmbH, 2021, S. 184–202.
Golka K, Weistenhöfer W, Blaszkewicz M, Bolt HM: N-Acetyltransferase 2 und Anamnese bei Patienten mit einer angezeigten Berufskrankheit 1301. Arbeitsmedizin Sozialmedizin Umweltmedizin 2007; 42: 440–445.
Greim H: o-Toluidin, Nachtrag. In: Gesundheitsschädliche Arbeitsstoffe, Toxikologisch-arbeitsmedizinische Begründung von MAK-Werten (43. Lieferung). Weinheim: Wiley-VCH, 2007.
Groot HJ, Lubberts S, de Wit R, Witjes JA, Kerst JM, de Jong IJ, Groenewegen G, van den Eertwegh AJM, Poortmans PM, Klümpen H-J, van den Berg HA, Smilde TJ, Vanneste BGL, Aarts MJ, Incrocci L, van den Bergh ACM, Jóźwiak K, van den Belt-Dusebout AW, Horenblas S, Gietema JA, van Leeuwen FE, Schaapveld M: Risk of solid cancer after treatment of testicular germ cell cancer in the platinum era. Journal of Clinical Oncology 2018; 36 (24): 2504–2513.
Habs MR, Schmähl D: Prevention of urinary bladder tumors in cyclophosphamide-treated rats by additional medication with the uroprotectors sodium 2-mercaptoethane sulfonate (mesna) and disodium 2,2’-dithio-bis-ethane sulfonate (dimesna). Cancer 1983; 51 (4): 606–609.
Hanley KW, Viet SM, Hein MJ, Carreón T, Ruder AM: Exposure to o-toluidine, aniline, and nitrobenzene in a rubber chemical manufacturing plant: A retrospective exposure assessment update. Journal of Occupational and Environmental Hygiene, 2012; 9 (8): 478–490.
Harling M, Schablon A, Schedlbauer G, Dulon M, Nienhaus A: Bladder cancer among hairdressers: A meta-analysis. Occupational and Environmental Medicine 2010; 67 (5): 351–358.
Hartwig A, MAK Commission: Erhöhtes Atemvolumen am Arbeitsplatz – Bedeutung für die MAK-Wert-Ableitung bei Stoffen mit systemischer Wirkung. MAK Value Documentation in German language. The MAK-Collection for Occupational Health and Safety 2017; 2 (1). Retrieved January, 10, 2022 from https://onlinelibrary.wiley.com/doi/epdf/10.1002/3527600418.mbrespivold…
Henschler D, Norpoth K, Thielmann HW, Woitowitz H-J: Blasenkrebs durch aromatische Amine als Berufskrankheit: Zur Validität der neuen berufsgenossenschaftlichen Dosisgrenzwerte. Zentralblatt für Arbeitsmedizin, Arbeitsschutz und Ergonomie 2012; 62 (2): 64–75.
Hoeller U, Borgmann K, Oertel M, Haverkamp U, Budach V, Eich HT: Late sequelae of radiotherapy—The effect of technical and conceptual innovations in radiation oncology. Deutsches Arzteblatt International 2021; 118 (12): 205–211. doi: 10.3238/arztebl.m2021.0024.
Hours M, Dananche B, Fevotte J, Bergeret A, Ayzac L, Cardis E, Etard JF, Pallen C, Roy P, Fabry J: Bladder cancer and occupational exposures. Scandinavian Journal of Work, Environment & Health 1994; 20 (5): 322–330.
IARC: Tobacco smoke and involuntary smoking. IARC monographs on the evaluation of carcinogenic risks to humans (Bd. 83). Lyon: IARC press, 2004. Retrieved January, 10, 2022 from https://publications.iarc.fr/Book-And-Report-Series/Iarc-Monographs-On-…
IARC: o-Toluidine. In: Some aromatic amines, organic dyes, and related exposures.
IARC monographs on the evaluation of carcinogenic risks to humans (Bd. 99). Lyon: IARC press, 2010, S. 407–451. Retrieved January, 10, 2022 from https://publications.iarc.fr/Book-And-Report-Series/Iarc-Monographs-On-…-
Hazards-To-Humans/Some-Aromatic-Amines-Organic-Dyes-And-Related-Exposures-2010
Kadhum T, Wishahi M, Hammad S, Golka K: Bilharziose (Schistosomiasis) und Harnblasenkarzinom. In: Handbuch der Arbeitsmedizin—51. Erg.-Lfg. 11/18 (Bd. 51, S. 1–17). Landsberg am Lech: ecomed-Storck GmbH, 2018.
Kantor AF, Hartge P, Hoover RN, Narayana AS, Sullivan JW, Fraumeni JF: Urinary tract infection and risk of bladder cancer. American Journal of Epidemiology 1984; 119 (4): 510–515.
Kendal WS, Nicholas G: A population-based analysis of second primary cancers after irradiation for rectal cancer. American Journal of Clinical Oncology 2007; 30 (4): 333–339.
Kraywinkel K, Fiebig J, Schulz GB: Epidemiologie des Harnblasenkarzinoms in Deutschland. Der Onkologe 2018; 24 (1): 6–13.
Lin C-L, Huang W-T, Fan W-C, Feng Y-H, Lin C-H, Lin C-S, Lu C-C, Cheng T-C, Tsao C-J, Lin S-H: Associations between interventions for urolithiasis and urinary tract cancer among patients in Taiwan: The effect of early intervention. Medicine (Baltimore) 2016; 95 (49): e5594.
Lukas C, Selinski S, Prager H-M, Blaszkewicz M, Hengstler JG, Golka K: Occupational bladder cancer: Polymorphisms of xenobiotic metabolizing enzymes, exposures, and prognosis. Journal of Toxicology and Environmental Health. Part A, 2017; 80 (7–8): 439–452.
Markowitz SB: Corrections to: Markowitz SB, Levin K. Continued epidemic of bladder cancer in workers exposed to ortho-toluidine in a chemical factory. J Occup Environ Med. 2004;46:154-160. Journal of Occupational and Environmental Medicine 2005; 47 (9): 875–877.
Markowitz SB, Levin K: Continued epidemic of bladder cancer in workers exposed to ortho-toluidine in a chemical factory. Journal of Occupational and Environmental Medicine 2004; 46 (2): 154–160.
Münch K: Leserbrief zur Originalarbeit „Blasenkrebs durch aromatische Amine als Berufskrankheit: Zur Validität der neuen berufsgenossenschaftlichen Dosisgrenzwerte” in Zbl Arbeitsmed 62 (2012) 64–75. Zentralblatt für Arbeitsmedizin, Arbeitsschutz und Ergonomie 2012; 62 (4): 231–232.
Nakano M, Omae K, Takebayashi T, Tanaka S, Koda S: An epidemic of bladder cancer: Ten cases of bladder cancer in male Japanese workers exposed to ortho-toluidine. Journal of Occupational Health 2018; 60 (4): 307–311.
Nakano M, Shinagawa T, Eitaki Y, Omae K, Takeuchi A, Iwasawa S, Fukai K, Yoshioka N, Tanaka S, Koda S, Sobue T, Takebayashi T: Risk of bladder cancer in male Japanese workers exposed to ortho-toluidine and other aromatic amines. International Archives of Occupational and Environmental Health 2021; 94 (6): 1427–1439.
Neugut AI, Ahsan H, Robinson E, Ennis RD: Bladder carcinoma and other second malignancies after radiotherapy for prostate carcinoma. Cancer 1997; 79 (8): 1600–1604.
Ovsiannikov D, Selinski S, Lehmann M-L, Blaszkewicz M, Moormann O, Haenel MW, Hengstler JG, Golka K: Polymorphic enzymes, urinary bladder cancer risk, and structural change in the local industry. Journal of Toxicology and Environmental Health. Part A, 2012; 75 (8–10): 557–565.
Park RM, Carreón T, Hanley KW: Risk assessment for o-toluidine and bladder cancer incidence. American Journal of Industrial Medicine 2021; 64 (9): 758–770.
Pesch B, Gawrych K, Rabstein S, Weiss T, Casjens S, Rihs H-P, Ding H, Angerer J, Illig T, Klopp N, Bueno-de-Mesquita B, Ros MM, Kaaks R, Chang-Claude J, Roswall N, Tjønneland A, Overvad K, Clavel-Chapelon F, Boutron-Ruault M-C, Dossus L, Boeing H, Weikert S, Trichopoulos D, Palli D, Sieri S, Tumino R, Panico S, Quirós JR, González C, Sánchez MJ, Dorronsoro M, Navarro C, Barricarte A, Ljungberg B, Johansson M, Ulmert D, Ehrnström R, Khaw K-T, Wareham N, Key TJ, Ferrari P, Romieu I, Riboli E, Brüning T, Vineis P: N-acetyltransferase 2 phenotype, occupation, and bladder cancer risk: Results from the EPIC cohort. Cancer Epidemiology, Biomarkers & Prevention 2013; 22 (11): 2055–2065.
Pesch B, Haerting J, Ranft U, Klimpel A, Oelschlägel B, Schill W: Occupational risk factors for urothelial carcinoma: Agent-specific results from a case-control study in Germany. MURC Study Group. Multicenter Urothelial and Renal Cancer. International Journal of Epidemiology 2000; 29 (2): 238–247.
Pira E, Piolatto G, Negri E, Romano C, Boffetta P, Lipworth L, McLaughlin JK, La Vecchia C: Bladder cancer mortality of workers exposed to aromatic amines: A 58-year follow-up. Journal of the National Cancer Institute 2010; 102 (14): 1096–1099.
Pottegård A, Kristensen KB, Friis S, Hallas J, Jensen JB, Nørgaard M: Urinary tract infections and risk of squamous cell carcinoma bladder cancer: A Danish nationwide case-control study. International Journal of Cancer 2020; 146 (7): 1930–1936.
Pucknat D: Expositionsermittlung durch die Berufsgenossenschaft bei angezeigter BK 1301. Vortrag beim DGAUM-Online-Workshop „Expositionsabschätzung für das Harnblasenkrebsrisiko durch aromatische Amine“ im Rahmen des FB 286 der DGUV, Erlangen, 5. März 2021. Retrieved January, 10, 2022 from https://www.ipasum.med.fau.de/files/2021/03/2_workshop_bk1301_pucknat_e…
Puente D, Hartge P, Greiser E, Cantor KP, King WD, González CA, Cordier S, Vineis P, Lynge E, Chang-Claude J, Porru S, Tzonou A, Jöckel K-H, Serra C, Hours M, Lynch CF, Ranft U, Wahrendorf J, Silverman D, Fernandez F, Boffetta P, Kogevinas M: A pooled analysis of bladder cancer case-control studies evaluating smoking in men and women. Cancer Causes & Control 2006; 17 (1): 71–79.
Reulen RC, Kellen E, Buntinx F, Brinkman M, Zeegers MP: A meta-analysis on the association between bladder cancer and occupation. Scandinavian Journal of Urology and Nephrology. Supplementum 2008; 218: 64–78.
RKI: Zur Situation bei wichtigen Infektionskrankheiten in Deutschland: Reiseassoziierte Infektionskrankheiten im Jahr 2005. Epidemiologisches Bulletin 2006; 37: 323.
Roelofzen JHJ, Aben KKH, Van de Kerkhof PCM, Van der Valk PGM, Kiemeney LALM: Dermatological exposure to coal tar and bladder cancer risk: A case-control study. Urologic Oncology 2015; 33 (1): 20.e19–20.e22.
Roth E, Selinski S, Schikowsky C, Seidel T, Volkert F, Blaszkewicz M, Hengstler JG, Golka K: Bladder cancer survival in a former industrial area in Saxony-Anhalt, Germany. Journal of Toxicology and Environmental Health. Part A, 2012; 75 (19–20): 1216–1225.
Rubino GF, Scansetti G, Piolatto G, Pira E: The carcinogenic effect of aromatic amines: An epidemiological study on the role of o-toluidine and 4,4’-methylene bis (2-methylaniline) in inducing bladder cancer in man. Environmental Research 1982; 27 (2): 241–254.
Safe S, Hutzinger O, Crocker JF, Digout SC: Identification of toxic impurities in
commercial diphenylamine. Bulletin of Environmental Contamination and Toxicology 1977; 17 (2): 204–207.
Salem HK, Mahfouz S: Changing patterns (age, incidence, and pathologic types) of schistosoma-associated bladder cancer in Egypt in the past decade. Urology 2012; 79 (2): 379–383.
Schilling T (2021, März 5). Ergebnisse der Literaturrecherche zur Dosisabschätzung – Vorschlag einer Dosisableitung für o-Toluidin. Vortrag beim DGAUM-Online-Workshop „Expositionsabschätzung für das Harnblasenkrebsrisiko durch aromatische Amine“ im Rahmen des FB 286 der DGUV, Erlangen. Retrieved January, 10, 2022 from https://www.ipasum.med.fau.de/files/2021/03/3_workshop_bk1301_schilling…
Schmähl D: Combination effects in chemical carcinogenesis. Weinheim: VCH, 1988.
Schöps W: Leserbrief 2 zu Weiß et al. Berufskrankheit 1301 (Arbeitsmed Sozialmed Umweltmed 2010; 45: 222–235). Arbeitsmedizin Sozialmedizin Umweltmedizin, 2010; 45 (12): 690–691.
Schöps W, Jungmann OP, Zellner M, Zumbé J, Golka K: Erkrankt durch berufliche Exposition. Uro-News 2016; 20 (1): 23–31.
Selinski S, Blaszkewicz M, Getzmann S, Golka K: N-Acetyltransferase 2: Ultra-slow acetylators enter the stage. Archives of Toxicology 2015; 89 (12): 2445–2447.
Slupinski H: Leserbrief zur Originalarbeit „Blasenkrebs durch aromatische Amine als Berufskrankheit: Zur Validität der neuen berufsgenossenschaftlichen Dosisgrenzwerte” in Zbl Arbeitsmed 62 (2012) 64–75. Zentralblatt für Arbeitsmedizin, Arbeitsschutz und Ergonomie 2013; 63 (1): 46–49.
Sorahan T: Bladder cancer risks in workers manufacturing chemicals for the rubber industry. Occupational Medicine (Oxford, England) 2008; 58 (7): 496–501.
Sorahan T, Hamilton L, Jackson JR: A further cohort study of workers employed at a factory manufacturing chemicals for the rubber industry, with special reference to the chemicals 2-mercaptobenzothiazole (MBT), aniline, phenyl-beta-naphthylamine and o-toluidine. Occupational and Environmental Medicine 2000; 57 (2): 106–115.
Sun L-M, Lin C-L, Chang Y-J, Liang J-A, Liu S-H, Sung F-C, Kao C-H: Urinary tract stone raises subsequent risk for urinary tract cancer: A population-based cohort study. BJU International 2013; 112 (8): 1150–1155.
Takkouche B, Regueira-Méndez C, Montes-Martínez A: Risk of cancer among hairdressers and related workers: A meta-analysis. International Journal of Epidemiology 2009; 38 (6): 1512–1531.
Travis LB, Curtis RE, Glimelius B, Holowaty EJ, Van Leeuwen FE, Lynch CF, Hagenbeek A, Stovall M, Banks PM, Adami J, Gospodarowicz MK, Wacholder S, Inskip PD, Tucker MA, Boice JD: Bladder and kidney cancer following cyclophosphamide therapy for non-Hodgkin’s lymphoma. Journal of the National Cancer Institute, 1995; 87 (7): 524–530.
Valentin H, Hartung M, Raithel K: Kolloquium Krebserkrankungen und berufliche Tätigkeit, S. 32, Süddeutsche Eisen- und Stahlberufsgenossenschaft Mainz, 13.07.1988.
van den Belt-Dusebout AW, de Wit R, Gietema JA, Horenblas S, Louwman MWJ, Ribot JG, Hoekstra HJ, Ouwens GM, Aleman BMP, van Leeuwen FE: Treatment-specific risks of second malignancies and cardiovascular disease in 5-year survivors of testicular cancer. Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology 2007; 25 (28): 4370–4378.
Vena JE, Freudenheim J, Graham S, Marshall J, Zielezny M, Swanson M, Sufrin G: Coffee, cigarette smoking, and bladder cancer in western New York. Annals of Epidemiology 1993; 3 (6): 586–591.
Vieth S, Hanley K, Carreón-Valencia T, Ruder A: Assessment of exposure to o-toluidine and other aromatic amines in a rubber chemical manufacturing plant (Exposure Assessment Update Documentation Report IWSB # 73.08; S. 91). NIOSH, CDC, 2009. Retrieved January, 10, 2022 from https://www.cdc.gov/niosh/topics/oT/pdf/Site-visit-report-2009.pdf
Wallis CJD, Mahar AL, Choo R, Herschorn S, Kodama RT, Shah PS, Danjoux C, Narod SA, Nam RK: Second malignancies after radiotherapy for prostate cancer: Systematic review and meta-analysis. British Medical Journal (Clinical Research Ed.) 2016; 352: i851.
Wang T-H, Liu C-J, Chao T-F, Chen T-J, Hu Y-W: Second primary malignancy
risk after radiotherapy in rectal cancer survivors. World Journal of Gastroenterology 2018; 24 (40): 4586–4595.
Ward E, Carpenter A, Markowitz S, Roberts D, Halperin W: Excess number of bladder cancers in workers exposed to ortho-toluidine and aniline. Journal of the National Cancer Institute 1991; 83 (7): 501–506.
Ward EM, Sabbioni G, DeBord DG, Teass AW, Brown KK, Talaska GG, Roberts DR, Ruder AM, Streicher RP: Monitoring of aromatic amine exposures in workers at a chemical plant with a known bladder cancer excess. Journal of the National Cancer Institute 1996; 88 (15): 1046–1052.
Weiß T: Dosis-Modell kanzerogener aromatischer Amine bei Verdacht auf eine BK 1301 – Erfahrungen aus der gutachterlichen Praxis. Vortrag beim DGAUM-Online-Workshop „Expositionsabschätzung für das Harnblasenkrebsrisiko durch aromatische Amine“ im Rahmen des FB 286 der DGUV, Erlangen, 5. März 2021. Retrieved January, 10, 2022 from https://www.ipasum.med.fau.de/files/2021/03/4_workshop_bk1301_weiss_dos…
Weiß T, Henry J, Brüning T: Berufskrankheit 1301 Bewertung der beruflichen (Mit-)Verursachung von Harnblasenkrebserkrankungen unter Berücksichtigung der quantitativen Abschätzung der Einwirkung der aromatischen Amine 2-Naphthylamin, 4-Aminobiphenyl und o-Toluidin. Arbeitsmedizin Sozialmedizin Umweltmedizin 2010; 45 (5): 222–235.
Weiß T, Henry J, Brüning T: Leserbrief zur Originalarbeit „Blasenkrebs durch aromatische Amine als Berufskrankheit: Zur Validität der neuen berufsgenossenschaftlichen Dosisgrenzwerte” in Zbl Arbeitsmed 62 (2012) 64–75. Zentralblatt für Arbeitsmedizin, Arbeitsschutz und Ergonomie 2012; 62 (4): 228–229.
Werfel U: Chronische Schistosomiasis mit Harnblasenkarzinom assoziiert – Leserbrief zum Artikel „Ätiologie und Prävention des Harnblasenkarzinoms“. Deutsches Ärzteblatt 2007; 104 (27): 1998.
Wiltink LM, Nout RA, Fiocco M, Meershoek-Klein Kranenbarg E, Jürgenliemk-Schulz IM, Jobsen JJ, Nagtegaal ID, Rutten HJT, van de Velde CJH, Creutzberg CL, Marijnen CAM: No increased risk of second cancer after radiotherapy in patients treated for rectal or endometrial cancer in the randomized TME, PORTEC-1, and PORTEC-2 trials. Journal of Clinical Oncology 2015; 33 (15): 1640–1646.
Woitowitz H-J: Zum Leserbrief von Dr. Heino Slupinski, Hannover (30.10. 2012). Zentralblatt für Arbeitsmedizin, Arbeitsschutz und Ergonomie 2013; 63 (1): 49–50.
Interessenkonflikt: Die Autoren erklären, dass einige von ihnen innerhalb der vergangenen 3 Jahre politische Gremien wie Bund, AGS, Ärztlichen Sachverständigenbeirat Berufskrankheiten, Länderministerien, DGUV, DFG und das Scientific Committee of Consumer Safety der EU-Kommission beraten haben, Forschungsunterstützung von der DGUV (u. a. FB 286 „Erarbeitung einer Expositionsabschätzung für das Harnblasenkrebsrisiko durch aromatische Amine“), BAuA, Bayerische Ministerien (Arbeit, Gesundheit, Umwelt, Wissenschaft), BG ETEM, BG HM, BMBF, BMG, Chemie-Wirtschaftsförderungsgesellschaft, Environment and Health Fund, Jerusalem, Israel, DFG, Harvard School of Public Health, Hessisches Regierungspräsidium Darmstadt, UMCA/Selenium and Tellurium REACH Consortium, Umweltbundesamt, VBG, International Fragrance Research Institute erhalten haben, Vortragshonorare der Akademien für Arbeits-, Sozial- und Umweltmedizin der Ärztekammern im Rahmen der ärztlichen Fort- und Weiterbildung (u. a. der Ärztekammer und der Kassenärztlichen Vereinigung Westfalen-Lippe, der Bayerischen Landesärztekammer, der Sozial- und Arbeitsmedizinischen Akademie Baden-Württemberg e. V., der Ärztekammern Schleswig-Holstein und Hamburg, der DGAUM), Kongressveranstalter RG, Unfallversicherungsträger, Haus der Technik (Essen); Bundeswehrakademie (Mannheim), Toxikologiekurs Helmholtz Zentrum (München) und für die Unterstützung wissenschaftlicher Literaturauswertung (ITEM) erhalten haben sowie Gutachten für Gerichte, Behörden und Unfallversicherungsträger sowie Begutachtungen für den Wissenschaftsrat erstattet haben.
Kontakt
Priv.-Doz. Dr. med. Wobbeke Weistenhöfer
Institut und Poliklinik für Arbeits-, Sozial- und Umweltmedizin (IPASUM) der Friedrich-Alexander-Universität Erlangen-Nürnberg
Henkestraße 9–11
91054 Erlangen
wobbeke.weistenhoefer@fau.de
Info
Ableitung einer kumulativen Dosis für o-Toluidin aus epidemiologischen Daten
Daten zur Exposition gegenüber o-Toluidin sowie Inzidenzraten für die Erkrankung an einem Harnblasenkarzinom liegen für ein Kollektiv von 1749 Beschäftigten einer Fabrik zur Herstellung von Chemikalien für die Gummi-Industrie vor (Ward et al. 1991, 1996), für die im Laufe der Jahre weitere Analysen publiziert wurden (u. a. Carreón et al. 2010, 2014; Hanley et al. 2012; Markowitz 2005; Markowitz u. Levin 2004; Park et al. 2021; Vieth et al. 2009). Die seinerzeit durchgeführten personenbezogenen Luftmessungen ergaben bei 28 Exponierten mittlere o-Toluidin-Konzentrationen am Arbeitsplatz von 412 µg/m³ ± 366 µg/m³ und bei sieben weiteren Exponierten o-Toluidin-Konzentrationen von 516 µg/m³ ± 513 µg/m³ (Ward et al. 1996). Für die Gruppe der definitiv gegen o-Toluidin exponierten Beschäftigten mit sieben Harnblasenkarzinomerkrankungen wurde ein Standard Incidence Ratio (SIR) von 6,48 angegeben (90 % KI 3,04–12,2), wobei die Erkrankten im Mittel 15 Jahre exponiert waren (Ward et al. 1991).
Mit den o-Toluidin-Konzentrationen von im Mittel 0,433 mg/m³ Luft (Ward et al. 1996), der Expositionsdauer von 15 Jahren (Ward et al. 1991), angenommenen 240 Arbeitstagen pro Jahr und einem 8-Stunden-Atemschichtvolumen von 10 m³ (Hartwig u. MAK Commission 2017) lässt sich eine kumulative o-Toluidin-Dosis von 15.588 mg errechnen, die zu einer Zunahme des Erkrankungsrisikos für ein Harnblasenkarzinom um den Faktor 6,48 führt. Über eine lineare Extrapolation ergibt sich so eine kumulative Dosis von etwa 2800 mg o-Toluidin als Verdopplungsdosis für die Erkrankung an einem Harnblasenkarzinom. Diese Ableitung wurde auch auf dem Workshop zur BK 1301 vorgestellt und diskutiert (Schilling 2021).
Aus den Daten der Publikationen von Vieth et al. (2009; NIOSH-Report) und Carreón et al. (2014) ergibt sich unter Annahme eines Maximalscores von 10 aus der Ränge-Job Exposure Matrix (NIOSH), 48.000 „unit days“ (aus Carreón et al. 2014; entsprechend 4800 realen Tagen, also 20 Jahren), einem 8-Stunden-Atemschichtvolumen von 10 m³ (Hartwig u. MAK Commission 2017) und einer gemittelten o-Toluidin-Konzentration von 0,433 mg/m³ Luft (Ward et al. 1996) eine kumulative inhalative o-Toluidin-Dosis von 20.784 mg bei einem SIR von etwa 6. Dies würde über eine lineare Extrapolation zu einer kumulativen Verdoppelungsdosis für die Erkrankung an einem Harnblasenkarzinom von etwa 4000 mg o-Toluidin führen.
Das PDF dient ausschließlich dem persönlichen Gebrauch! - Weitergehende Rechte bitte anfragen unter: nutzungsrechte@asu-arbeitsmedizin.com.