Biomonitoring von Bleibelastungen – Ein alter Hut?
Biomonitoring als fester Bestandteil der arbeitsmedizinischen Vorsorge von Beschäftigten mit beruflichem Gefahrstoffkontakt dürfte spätestens seit der Veröffentlichung der Verordnung zur arbeitsmedizinischen Vorsorge (ArbMedVV) jedem im beruflichen Arbeitsschutz Tätigen bekannt sein. Zur Beurteilung von beruflichen Bleiexpositionen wird Biomonitoring aber nicht erst seit der Erstveröffentlichung der ArbMedVV verwendet, sondern es zählt zu den allerersten Einsatzgebieten des Biomonitorings überhaupt. Auch heute noch wird das Biomonitoring von Blei in der arbeitsmedizinischen Praxis mit am häufigsten eingesetzt.
Die Ursachen hierfür sind zum einen die weite Verbreitung von Blei, anorganischen Bleiverbindungen und deren Zubereitungen in zahlreichen industriellen und gewerblichen Anwendungen sowie die hohe Robustheit des Parameters Blei im Vollblut, der für das Biomonitoring von Blei etabliert ist. Trotz oder vielleicht auch wegen der langen Tradition des Blei-Biomonitorings macht es Sinn, sich die Grundlagen, die Stärken und Schwächen sowie damit verbunden die Randbedingungen für ein aussagekräftiges Biomonitoring von Bleiexpositionen vor Augen zu führen.
In diesem Praxisleitfaden werden zunächst einige Grundlagen zu Aufnahme, Verteilung, Metabolismus und Ausscheidung (in der Pharmakologie und Toxikologie als ADME-Prozesse bezeichnet) von Blei und anorganischen Bleiverbindungen sowie die sich in vielen Aspekten davon unterscheidenden organischen Bleiverbindungen vorgestellt. In Verbindung damit erfolgt die Diskussion der Vor- und Nachteile möglicher Biomonitoring-Parameter von Bleiexpositionen. Abschließend werden Verwendungsempfehlungen nach aktuellem Wissensstand sowie ein Ausblick auf Neuentwicklungen gegeben.
ADME-Prozesse und Toxikokinetik von Blei und Bleiverbindungen
Absorption und Verteilung
Blei und seine Verbindungen werden inhalativ und gastrointestinal gut resorbiert. Organische Bleiverbindungen, wie Tetraethylblei und Tetramethylblei, werden auch in toxikologisch relevanten Mengen über die Haut resorbiert. Es ist davon auszugehen, dass für elementares Blei und seine anorganischen Verbindungen am Arbeitsplatz die Aufnahme durch Inhalation der Hauptaufnahmeweg ist. Auch eine Aufnahme durch Hand-Mund-Kontakt bei verschmutzten Händen ist gegebenenfalls zu bedenken. Die allgemeine Grundbelastung resultiert dagegen vornehmlich durch die Nahrungsaufnahme und aus dem Trinkwasser. Gleichwohl können spezielle Life-Style-Faktoren, wie zum Beispiel Sportschießen, zu einer erheblichen Bleibelastung führen. Dagegen weisen Raucher lediglich um etwa 5 µg/l höhere Blutbleispiegel auf als Nichtraucher.
Über die Lungen wird Blei mit Resorptionsraten im Bereich von 40–60 % aufgenommen. Dabei hängt die Resorptionsrate von der Wasserlöslichkeit der Bleiverbindung sowie von der Durchmesserverteilung der eingeatmeten Partikel ab. Zwischen 5 und 10 % des oral aufgenommenen Bleis werden gastrointestinal resorbiert. Für Bleialkylverbindungen gilt, dass etwa 6 % der mit der Haut in Kontakt stehenden Menge unter Arbeitsplatzbedingungen dermal resorbiert werden.
Nach der Aufnahme wird Blei über das Blut im Körper verteilt. Dabei sind 94–99 % des Bleigehalts im Blut in beziehungsweise an den Erythrozyten gebunden und weniger als 1–6 % liegen in der Plasmafraktion vor. Verschiedene Studien wiesen darauf hin, dass der Zusammenhang zwischen der Bleiplasmakonzentration (Pb-P) und dem Bleigehalt im Vollblut (Pb-B) nicht linear ist, sondern der Pb-P/Pb-B-Quotient mit zunehmender Bleibelastung steigt. In-vitro-Experimente zeigten, dass der Großteil des Bleis die Erythrozytenmembran durchdringt und an Hämoglobin (80 %) gebunden ist, während ein kleiner Teil (14 %) an der Erythrozytenmembran gebunden ist. Im Plasma ist der Großteil des Bleis an Proteine (4,5 %) und Lipide (1,3 %) gebunden und nur ein geringer Anteil des Bleis liegt ungebunden vor. Obwohl der Bleigehalt in der Erythrozytenfraktion quantitativ den bedeutendsten Anteil im Vollblut darstellt, bestehen Zweifel daran, ob dieser Teil auch für den Austausch mit Organen und Körpergeweben verfügbar ist. So besteht die Hypothese, dass der Austausch zwischen den biologischen Matrices und dem Blut zunächst über die Plasmafraktion erfolgt, und gegebenenfalls der Bleiplasmagehalt aktuelle Zuflüsse besser widerspiegelt als der Bleigehalt im Vollblut.
Nach der Verteilung über das Blut wird Blei in verschiedenen Organen und Geweben in unterschiedlichem Ausmaß gespeichert. In beziehungsweise aus manchen Organen und Geweben, wie beispielsweise dem Gehirn oder den Nieren, kann Blei relativ schnell transferiert werden. Andere Körpergewebe weisen dagegen ein deutlich langsameres Austauschverhalten auf, zum Beispiel Knochen und Zähne. Im Gleichgewichtszustand sind 80–90 % der Bleigesamtbelastung des Körpers im Knochengerüst eingelagert. Die Kinetik von Blei im Knochengewebe hängt vor allem von der Festigkeit des Knochens ab. Aus dem schwammartigen trabekulären Knochenanteil wird Blei deutlich leichter und schneller eliminiert als aus der kortikalen Knochenstruktur. Blei passiert die Plazentabarriere, so dass immer eine Belastung des Embryos zu beachten ist. Das Blut der Feten hat deshalb eine sehr ähnliche Belastungshöhe wie das mütterliche Blut. Blei kann ebenfalls die Blut-Hirn-Schranke penetrieren und im Gehirn akkumulieren.
Metabolismus
Nach Verteilung im Organismus werden die organischen Bleiverbindungen sukzessive dealkyliert. Für Tetraethylblei ist eine oxidative Dealkylierung zunächst zu Triethylblei sowie Diethylblei bis hin zum anorganischem Blei beschrieben. Diese oxidative Dealkylierung wird in der Leber durch Cytochrom P 450 katalysiert. Die Metabolite Triethylblei und Diethylblei besitzen im Gegensatz zu Tetraethylblei einen ionischen Charakter und können so über den Urin ausgeschieden werden. Für Tetramethylblei wird ein analoger Metabolismus und ein vergleichbares Eliminationsverhalten wie für Tetraethylblei angenommen. Dagegen werden anorganische Bleiverbindungen in der Regel in Form des Pb2±-Ions systemisch aufgenommen, so dass hierfür kein spezifischer Metabolismus zu beachten ist.
Ausscheidung
Die Hauptausscheidung des Bleis erfolgt über die Harnwege. Dies umfasst 75–80 % der Gesamtausscheidung. Zweitbedeutend ist danach der gastrointestinale Eliminationsweg. Andere Ausscheidungswege, wie zum Beispiel über die Haare, Nägel und Schweiß, tragen zusammen weniger als 8 % zu der Gesamtausscheidung bei. Ein Teil des Bleis wird in der Stillphase über die Muttermilch abgegeben. Generell erfolgt die Elimination nach bisherigem Kenntnisstand sehr langsam. Aufgrund der Speicherung von Blei in diversen Organen und Körpergeweben und den jeweils unterschiedlichen Austauschverhalten zwischen den Kompartimenten zeigt die Elimination von Blei aus dem Körper eine komplexe mehrphasige Kinetik. Nach Expositionsende fällt dabei der Blutbleispiegel in einer ersten Phase mit einer Halbwertzeit von 29 bis 36 Tagen ab. Aufgrund der Nachlieferung von Blei aus Weichgewebe und insbesondere aus der Knochenmatrix verlangsamt sich die Ausscheidungskinetik deutlich, zunächst auf etwa 1,2 Jahre und schließlich auf etwa 13 Jahre. Für den Abbau des Bleispeichers in der Knochenmatrix zeigen In-vivo-Studien Halbwertzeiten im Bereich von 6 bis 37 Jahren.
Potenzielle Parameter für ein Biomonitoring von Bleibelastungen
Blei in Blut und Blutkompartimenten
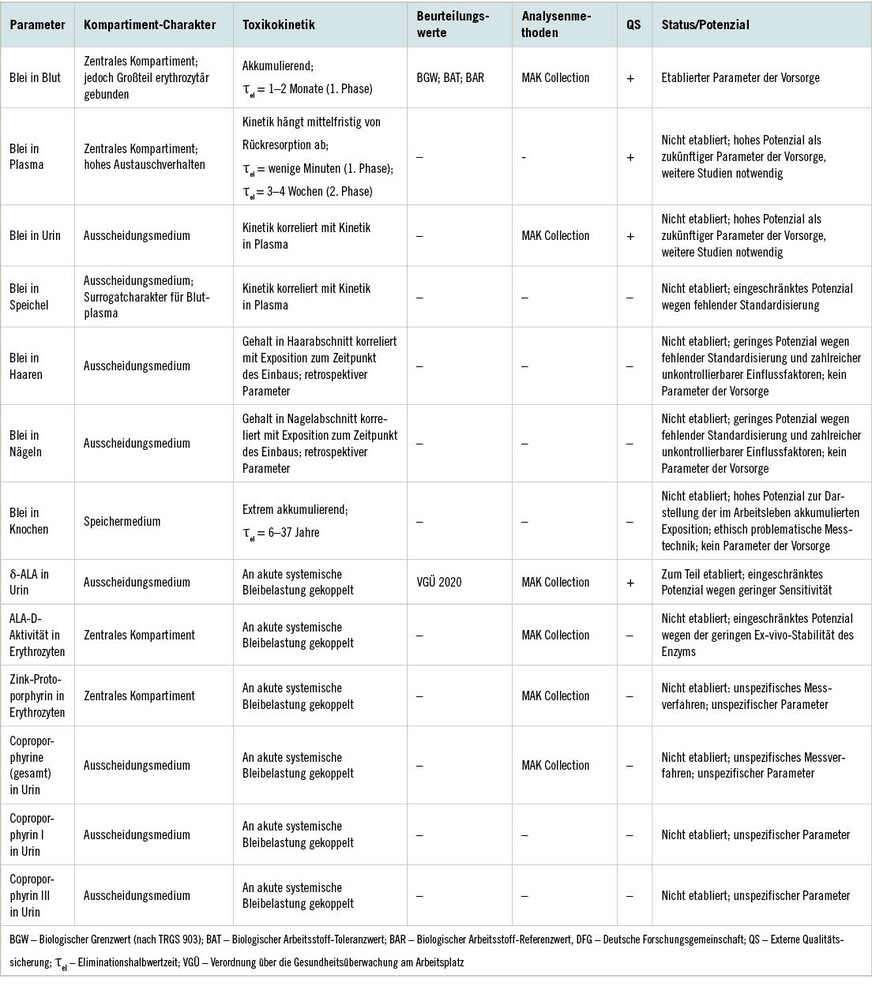
Die Bestimmung von Blei in Blut ist der etablierte und auch in der Praxis am häufigsten verwendete Biomonitoring-Parameter für Bleibelastungen. Der Parameter repräsentiert maßgeblich die aktuelle Belastung und zeigt in der ersten Phase nach Expositionsende eine Eliminationshalbwertzeit im Bereich von 1 bis 2 Monaten. Je nachdem wie viel Blei durch vorausgehende, gegebenenfalls jahrelange hohe Expositionen in der Knochenmatrix gespeichert wurde, zeigt sich im weiteren Verlauf ein deutlich abgeschwächter Abfall des Blutbleispiegels in der Expositionskarenz, so dass unter Umständen auch noch nach Jahren der Bereich der allgemeinen Hintergrundbelastung nicht erreicht wird. Je nach Expositionssituation und Arbeitsplatzhygiene zeigt der Parameter eine Assoziation mit dem Ausmaß der äußeren Exposition, wobei diese Korrelation jedoch zum Teil eine starke Streuung aufweist. Der größte Vorteil der Bestimmung von Blei in Blut besteht allerdings in der exzellenten Datenlage, da nahezu sämtliche Studien, die eine Verknüpfung zwischen Bleiexposition und gesundheitlichen Effekten beschreiben beziehungsweise untersucht haben, diesen Parameter verwendet haben. Dadurch sind toxikologisch basierte Beurteilungswerte direkt mit der im Menschen beobachteten kritischen Toxizität verknüpft. Aufgrund der langsamen Elimination von Blei aus dem Blut ist der Probenahmezeitpunkt relativ unkritisch, was eine Umsetzung in der arbeitsmedizinischen Vorsorgepraxis deutlich erleichtert. Die gute Datenlage führt auch dazu, dass gut begründete Beurteilungswerte für Bewertung der Biomonitoring-Ergebnisse vorliegen. Sowohl der Ausschuss für Gefahrstoffe als auch die Senatskommission zur Prüfung gesundheitsschädlicher Arbeitsstoffe (MAK-Kommission) sowie die Europäische Chemikalien-Agentur haben für Blei ihre Grenzwerte mit 150 µg/l Blut festgelegt. Die MAK-Kommission hat darüber hinaus für Frauen einen Biologischen Arbeitsstoff-Referenzwert von 30 µg/l Blut evaluiert, der aufgrund der Einstufung in die Schwangerschaftsgruppe A mit Blick auf den Mutterschutz auf alle Frauen mit beruflichem Kontakt zu Blei angewendet werden sollte. Darüber hinaus stehen sowohl von der MAK-Kommission als auch von anderen Fachleuten zahlreiche anerkannte Analysenverfahren zur Verfügung, mit denen die Einhaltung der aktuellen Beurteilungswerte zuverlässig kontrolliert werden kann. Schließlich wird im Rahmen des Ringversuchsprogramms GEQUAS bereits seit fast 40 Jahren eine externe Qualitätssicherung für diesen Parameter angeboten.
Es ist allerdings wichtig, darauf hinzuweisen, dass Blei nicht gleichmäßig in den verschiedenen Blutkompartimenten verteilt ist und für die Gehalte in den verschiedenen Kompartimenten auch unterschiedliches toxikokinetisches Verhalten berücksichtigt werden muss. In der Erythrozytenfraktion finden sich mehr als 90 % des Gesamtgehalts von Blei in Blut, wodurch die Toxikokinetik im Blut maßgeblich durch diese Fraktion bestimmt wird. Das Blei ist dabei sowohl intrazellulär als auch an der Zellmembran der Erythrozyten gebunden, so dass sich dadurch das geringe Austauschvermögen von in diesem Kompartiment gebundenem Blei erklärt. Anderseits ist das Blei in der Erythrozytenfraktion auch nicht vollständig immobil. Ansonsten wäre eine noch langsamere Elimination aus dem Blut zu erwarten.
Im Gegensatz zur Erythrozytenfraktion ist nur ein Bruchteil des Blutbleis in der Plasmafraktion zu finden. In der Regel beträgt dieser Anteil weniger als 1 %, kann aber in speziellen Situationen auch auf bis zu 6 % ansteigen. Im Gegensatz zum Blei in der Erythrozytenfraktion ist das Blei im Plasma sehr mobil und steht ungehindert für den Austausch mit Organen und anderen Körpergeweben zur Verfügung. Mehrere Studien beschreiben die Assoziation zwischen dem Blei in Plasma und anderen Parametern der inneren Bleiexposition. Diese Studienergebnisse unterstützen die Hypothese, dass Blei im Plasma die frei austauschbare Fraktion des Blutes repräsentiert und daher auch für pharmakokinetische Betrachtungen besonders interessant ist. Die große Herausforderung dieses Parameters ist der geringe Gehalt von Blei im Plasma, so dass insbesondere bei geringen Bleibelastungen entsprechend nachweisstarke Analysenmethoden gefordert sind. Vermutlich sind teils widersprüchliche Ergebnisse in früheren Studien zur Toxikokinetik von Plasmablei auf die anspruchsvolle Analytik sowie auf die mit dem geringen Gehalt verbundene höhere Gefährdung durch Kontamination zu erklären. Allerdings ist in den letzten Jahrzenten nicht nur die Bleibelastung am Arbeitsplatz und in der Hintergrundbelastung abgefallen, sondern es wurde in dieser Zeit auch die analytische Nachweisempfindlichkeit deutlich gesteigert, so dass der Parameter ein hohes diagnostisches Potenzial hat. Auch bietet das GEQUAS-Ringversuchsprogramm eine externe Qualitätssicherung für diesen Parameter an. Die schwache Datenlage lässt aber derzeit das Potenzial des Parameters nicht sicher beurteilen und führte dazu, dass für ihn keine Beurteilungswerte evaluiert wurden, anhand derer die Ergebnisse des Biomonitorings bewertet werden könnten.
Blei in Speichel
Ein weiterer Parameter, der für ein Biomonitoring von Blei bereits vielfach sowohl für berufliche als auch umweltbedingte Bleiexpositionen verwendet wurde, ist die Bestimmung von Blei in Speichel. Prinzipiell kann Speichel als Surrogatmatrix für den Gehalt von Xenobiotika im Blutplasma verwendet werden. In Übereinstimmung damit zeigten die bisher durchgeführten Studien eine Korrelation zwischen dem Bleigehalt im Speichel und dem Blutbleispiegel, allerdings erst bei deutlich erhöhten Bleibelastungen. Die Vergleichbarkeit der Ergebnisse zwischen den Studien wird allerdings dadurch konterkariert, dass in den verschiedenen Studien zum Teil unterschiedliche Probennahmeverfahren und Probenaufarbeitungen verwendet wurden. Die diversen Probennnahmetechniken und Probenahmeprotokolle sowie die fehlende Standardisierung dieser Prozesse sind auch der maßgebliche Nachteil für eine mögliche Etablierung dieses Parameters für ein Blei-Biomonitoring, der gegenüber dem Vorteil einer nicht invasiven Probenahme deutlich überwiegt. Folglich liegen auch keine Beurteilungswerte für die Bewertung derartiger Messergebnisse vor.
Blei in Urin
Ein anderer vielversprechender Parameter für das Biomonitoring von Bleibelastungen ist die Bestimmung von Blei in Urin. Ein Vorteil ist, dass diese Matrix nicht invasiv gewonnen werden kann. Dieser Ansatz wird dadurch unterstützt, dass die renale Ausscheidung den Haupteliminationsweg für das systemisch aufgenommene Blei darstellt. Darüber hinaus zeigten diverse Studien eine signifikante Korrelation zwischen dem Bleigehalt im Urin und dem Blutbleispiegel, und zwar sowohl bei beruflichen Belastungen als auch in der Hintergrundbelastung der Bevölkerung. Allerdings ist der lineare Zusammenhang zwischen diesen beiden Parametern häufig mit einer hohen Streubreite verbunden, die vermutlich vornehmlich aus dem unterschiedlichen toxikokinetischen Verhalten der Parameter resultiert. Interessanterweise ist der Zusammenhang zwischen der Bleikonzentration im Urin und dem Plasmableispiegel enger als mit dem Blutbleispiegel, was wiederum die unterschiedliche Verfügbarkeit des Bleis in den Medien und das damit verbundene toxikokinetische Verhalten unterstreicht. Derzeit sind allerdings die bisher verfügbaren Daten zu gering, um eine enge Korrelation zwischen der akut einwirkenden Bleibelastung und der Bleikonzentration im Urin zu belegen und um einen Zusammenhang zwischen toxischen Effekten und dem Urinbleispiegel zu beschreiben. Demzufolge stehen zwar Analyseverfahren zur zuverlässigen Bestimmung von Blei in Urin sowie auch ein Qualitätssicherungsangebot für den Parameter zur Verfügung, aber leider keine Beurteilungswerte.
Blei in Knochen
Einerseits sind im Gleichgewichtszustand 80–90 % der Bleigesamtbelastung des Körpers im Knochengerüst eingelagert. Andererseits ist der Austausch zwischen dem Knochengewebe und dem Blut sehr langsam. Für den Eliminationsprozess aus vormals hoch beladenen Knochen wurden Halbwertzeiten im Bereich von 6–37 Jahren ermittelt, die von der jeweiligen Knochengewebestruktur abhängig sind. Die meisten Daten liegen für den Gehalt an Blei im Schienbein vor, gefolgt von Daten in der Kniescheibe, im Fersenknochen und in Fingerknochen. Grundsätzlich besteht auch eine hohe Korrelation zwischen dem Bleigehalt im Knochen und der kumulativen Bleiexposition. Während Blei im Blut eher die aktuelle Expositionssituation widerspiegelt und in wenigen Tagen seinen Gleichgewichtszustand erreicht, wird Blei sukzessive in den Knochen eingebaut, wo es dann über einen langen Zeitraum akkumuliert. Demzufolge gilt Blei im Knochen als Biomonitoring-Parameter für die Langzeitbelastung mit Blei. Dagegen kann eine akute Veränderung der Expositionssituation durch den Bleigehalt in der Knochenmatrix nicht nachvollzogen werden. Die Bestimmung des Bleigehalts im Knochen erfolgt mit der Röntgenfluoreszenzspektroskopie (XRF), die zwar keine Gewebeentnahme erfordert, dennoch aufgrund der angewendeten Röntgenstrahlungsdosis als invasiv eingestuft werden muss.
Blei in anderen humanbiologischen Materialien
Weitere humanbiologische Materialien, die bisher für ein Biomonitoring von Bleiexpositionen eingesetzt wurden, sind Haarproben von unterschiedlichen Körperregionen, Zähne und insbesondere Milchzähne, Finger- und Zehennägel, Schweiß und Muttermilch. Diese Materialien haben mit Blick auf den klaren Zusammenhang zu dem zu beurteilenden Expositionszeitpunkt sowie der Kontrolle von Stör- und Einflussfaktoren große Nachteile. Darüber hinaus fehlen häufig die Daten, um die Parameter für ein Biomonitoring von beruflichen Bleiexpositionen zu etablieren. Schließlich fehlen die Möglichkeiten die Ergebnisse durch eine externe Qualitätssicherung zu verifizieren.
(eigene Darstellung)
Potenzielle Parameter für ein biologisches Effektmonitoring
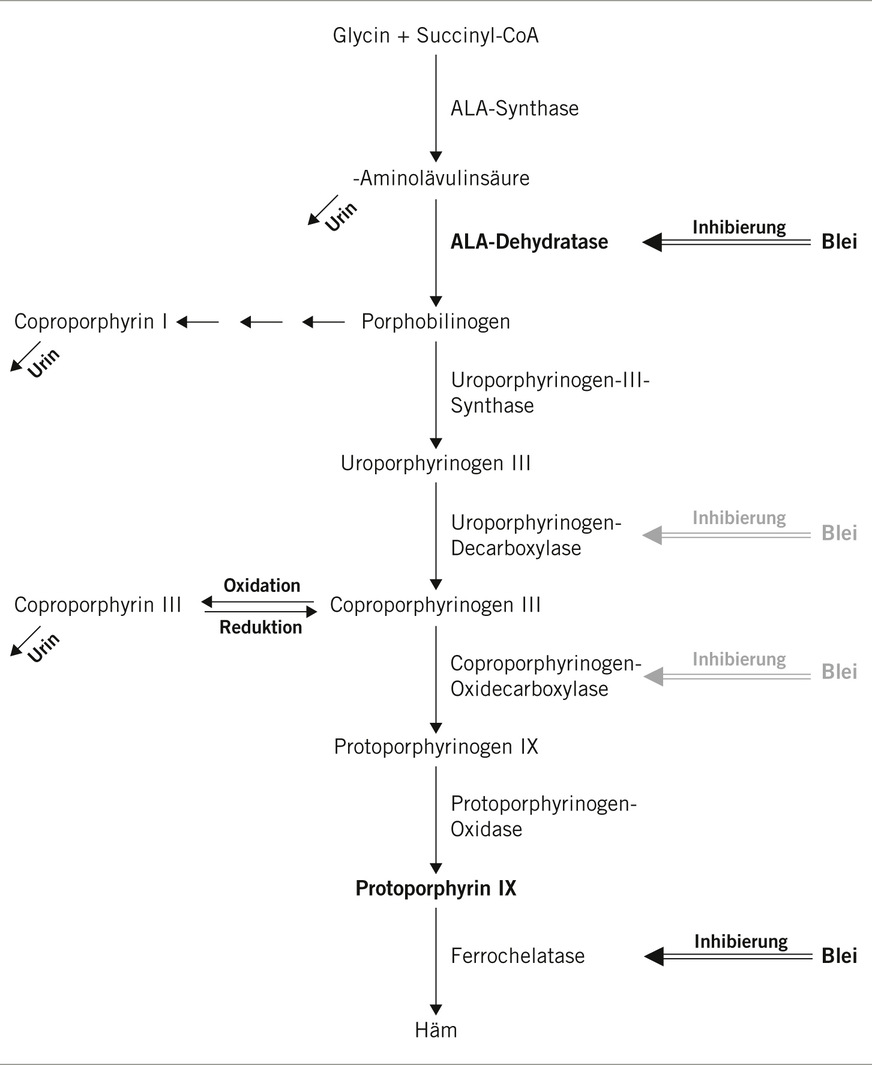
Der Großteil der biologischen Effekte, die eine systemische Bleibelastung auslösen, ist der hohen Affinität des Metalls an funktionelle Positionen diverser Proteine und der Eigenschaft, essenzielle Elemente, wie Calcium und Zink, aus funktionellen Bindungsstellen zu ersetzen und somit die Funktion dieser Proteine zu behindern, zuzuschreiben. Dieser Mechanismus ist für die Störung der Hämsynthese durch Blei belegt und könnte auch für die Störung der Calcium-gesteuerten Signalwege und somit für neurologische Effekte und Wirkungen auf das kardiovaskuläre System verantwortlich sein.
Für die Blei-assoziierten neurologischen und kardiovaskulären Mechanismen sind bisher keine biologischen Effektparameter etabliert. Dagegen sind, basierend auf den spezifischen Wirkungen von Blei auf die Mechanismen der Hämsynthese, mehrere Parameter für ein biologisches Effektmonitoring verfügbar (➥ Abb. 1). Besonders ausgeprägt sind dabei die inhibierende Wirkung auf die δ-Aminolävulinsäuredehydratase (ALA-D) und die Ferrochelatase, die an den jeweils katalysierten Schritten die Hämsynthese hemmen. Demzufolge wurden folgende Parameter für die Bleiwirkung auf das blutbildende System etabliert:
Dabei ist die Bestimmung der ALA-D-Aktivität der einzige Parameter, bei dem die inhibierende Wirkung des Bleis direkt bestimmt wird. Für den Parameter wurde durch die MAK-Kommission auch ein Analyseverfahren validiert und veröffentlicht. Allerdings existieren keine einheitlichen Beurteilungswerte für dieses Messverfahren. Zudem ist die ALA-D in der gewonnenen Blutprobe recht instabil und muss auch bei geeigneter Lagerung spätestens innerhalb von 24 Stunden nach der Probenahme gemessen werden. Darüber hinaus reagiert die Enzymaktivitätsmessung sehr empfindlich auf die Inkubationsbedingungen und ist demzufolge nur schwer zu standardisieren.
Ein alternativer Ansatz, die Inhibierung der ALA-D zu messen, besteht im Nachweis des dadurch ausgelösten Anstiegs der delta-Aminolävulinsäure-Konzentration im Serum beziehungsweise im Urin. Von diesen Möglichkeiten hat sich die Bestimmung der ALA in Urin durchgesetzt und wird beispielsweise derzeit in der österreichischen Verordnung über die Gesundheitsüberwachung am Arbeitsplatz (VGÜ) als Biomonitoring-Parameter eingesetzt. Für diesen Parameter werden in der VGÜ auch Werte zur Beurteilung der Eignung beziehungsweise Nichteignung aufgeführt. Auch von der MAK-Kommission wurde dieser Parameter bis 1999 in der MAK- und BAT-Werte-Liste aufgeführt. Mit der Absenkung des BAT-Wertes von 700 auf 400 µg Blei/l Blut im Jahr 2000 wurde die ALA als unzureichend empfindlicher Parameter nicht mehr in die Liste aufgenommen. Gleichwohl wurde für die Bestimmung der ALA auch noch in den letzten Jahren eine besonders zuverlässige Methode von der MAK-Kommission geprüft und publiziert. Außerdem besteht auch für diesen Parameter ein Angebot zur externen Qualitätssicherung durch das GEQUAS-Ringversuchsprogramm.
Ein weiterer Parameter, der für die Diagnostik der Störung der Hämsynthese durch Blei herangezogen wird, ist die Bestimmung des Gehalts an Porphyrinen im Erythrozyten, wobei der Parameter zum Teil als freie Erythrozytenporphyrine (EPs) oder Zinkprotoporphyrine (ZPPs) benannt wird. Da in den Erythrozyten hauptsächlich Protoporphyrin IX enthalten ist, eignet sich der Parameter vornehmlich zum Nachweis der Inhibierung der Ferrochelatase (siehe Abb. 1). Für diesen Parameter wurde ebenfalls ein Analyseverfahren durch die MAK-Kommission geprüft und veröffentlicht. Einheitliche Beurteilungswerte sowie ein Angebot zur externen Qualitätssicherung existieren jedoch nicht.
Schließlich wird auch die Bestimmung der Coproporphyrine in Urin als Nachweis der Hämsynthesestörung herangezogen, wobei Messverfahren etabliert wurden, die entweder die Summe aus Coproporphyrin I und III bestimmen oder eine getrennte Analyse dieser beiden Strukturen ermöglichen. Dabei erscheint die Bestimmung des Coproporphyrin III der leistungsfähigere Parameter der beiden Unterformen zu sein. Allerdings existieren weder für den Summenparameter noch für die beiden Einzelstrukturen Beurteilungswerte oder Angebote zur externen Qualitätssicherung.
Grundsätzlich ist darauf hinzuweisen, dass die Störung der Hämsynthese nach bisherigem Kenntnisstand erst bei hohen Bleibelastungen eintritt, so dass die genannten Parameter weniger für ein allgemeines Belastungsscreening geeignet sind, sondern erst nach Messung deutlich erhöhter Blutbleiwerte für eine weitergehende Diagnostik eingesetzt werden sollten. Weiterhin ist bei der Beurteilung der Werte zu beachten, dass eine Störung der Hämsynthese auch durch andere Faktoren, wie zum Beispiel Drogen-, Medikamenten- und Alkoholkonsum, abweichende Hormonspiegel und Leberschäden, ausgelöst werden kann.
Aktuelle Empfehlungen für die Praxis und Ausblick
Derzeit ist weiterhin die Bestimmung von Blei in Blut für das Biomonitoring von Blei und seinen anorganischen Verbindungen für die arbeitsmedizinische Vorsorge klar zu empfehlen. Dafür sprechen vornehmlich die gut begründeten toxikologisch abgeleiteten Beurteilungswerte sowie die Tatsache, dass der Probenahmezeitpunkt aufgrund der langsamen Kinetik unkritisch ist und keiner besonderen Beschränkungen bedarf. Allerdings gilt auch, dass der Blutbleispiegel aufgrund der langsamen Kinetik nicht kurzfristig auf Expositionsminderung reagieren kann und daher für ein Erfolgsmonitoring von präventiven Maßnahmen nachteilig ist. Die Bestimmungen von Blei in Plasma und Blei in Urin scheinen das Potenzial zu besitzen, eher auf akute Expositionsänderungen zu reagieren. Allerdings ist die Datenlage für diese Parameter unzureichend, um hierfür derzeit Beurteilungswerte und Empfehlungen zu erstellen. Hier könnten aber durch die aktuell laufende Studie der Bundesanstalt für Arbeitsschutz und Arbeitsmedizin zur „Ableitung geeigneter Methoden des Biomonitorings zur Ermittlung der aktuellen tätigkeitsbedingten Bleiexposition von Beschäftigten“ (BAuA-Forschungsvorhaben F 2510) in absehbarer Zeit neue belastbare Daten vorliegen.
Die Bestimmung von Parametern des biologischen Effektmonitorings, wie δ-Aminolävulinsäure im Urin, reagiert erst bei deutlich erhöhten Blutbleispiegeln und gewinnt demzufolge erst bei derartigen Belastungen Bedeutung für die arbeitsmedizinische Vorsorge. Bei der Durchführung des Biomonitorings sowie bei der Beurteilung der Befunde sollten immer die Randbedingungen, wie die Toxikokinetik des Parameters oder der Einfluss des Knochenspeichers, berücksichtigt werden. Eine wertvolle Hilfestellung liefert dazu die im letzten Jahr aktualisierte arbeitsmedizinische Leitlinie (siehe dazu auch den entsprechenden Beitrag von Greiner und Drexler in diesem Heft).
Interessenkonflikt: Das Autorenteam gibt an, dass keine Interessenkonflikte vorliegen.
Literatur
Barbosa F et al.: A critical review of biomarkers used for monitoring human exposure to lead: Advantages, limitations, and future needs. Environ Health Perspect 2005; 113: 1669–1674.
Klotz K, Göen T: Human biomonitoring of lead exposure. Metal Ions Life Sci 2017; 17: 99–121.
Österreichisches Bundesministerium für Arbeit, Familie und Jugend: Verordnung über die Gesundheitsüberwachung am Arbeitsplatz (VGÜ 2020). BGBl. II Nr. 550/2020
Triebig G et al.: Biomonitoring in Arbeitsmedizin und Umweltmedizin. Landsberg: ecomed Medizin, 2012.
World Health Organization: Environmental Health Criteria No. 165 Inorganic lead. International Programme on Chenical Safety (IPCS). Geneva: WHO, 1995.
Weitere Infos
BAuA-Projektinfo: Ableitung geeigneter Methoden des Biomonitorings zur Ermittlung der aktuellen tätigkeitsbedingten Bleiexposition von Beschäftigten
https://www.baua.de/DE/Aufgaben/Forschung/Forschungsprojekte/f2510.html
Deutsche Gesellschaft für Arbeitsmedizin und Umweltmedizin (DGAUM): Arbeitsmedizinische Leitlinie „Prävention und Früherkennung arbeitsbedingter Gesundheitsgefährdungen bei Tätigkeiten unter Einwirkung von Blei und seinen anorganischen Verbindungen (außer Bleiarsenate, Bleichromate)“ (AWMF Reg.Nr. 002-001), März 2020
https://www.awmf.org/leitlinien/detail/ll/002-001.html
Ständige Senatskommission zur Prüfung gesundheitsschädlicher Arbeitsstoffe: The MAK-Collection for Occupational Health and Safety. Publisso, Köln 2021
https://series.publisso.de/pgseries/overview/mak
Koautorinnen
An der Erstellung des Beitrags beteiligt waren Dr. med. Annette Greiner und Priv.-Doz. Dr. Katrin Klotz, beide Institut und Poliklinik für Arbeits-, Sozial- und Umweltmedizin der Friedrich-Alexander-Universität Erlangen-Nürnberg.