Hepatitis B
Hepatitis B wird durch das Hepatitis-B-Virus (HBV) verursacht, das durch perkutanen oder mukosalen Kontakt mit infektiösem Blut oder Körperflüssigkeiten übertragen wird. Bei Erwachsenen äußert sich eine HBV-Infektion bei etwa einem Drittel der Infizierten als eine akute ikterische Hepatitis. Ein weiteres Drittel der Infizierten zeigt nur unspezifische Symptome und ein Drittel einen asymptomatischen Verlauf. Während die Mehrheit der akuten Hepatitis-B-Erkrankungen bei Erwachsenen vollständig ausheilt, verlaufen etwa 0,5–1 % aller Infektionen fulminant mit der Entwicklung eines akuten Leberversagens. Weiter entwickeln bis zu 10 % der HBV-infizierten Erwachsenen einen chronischen Verlauf, häufig ohne dass eine akute Erkrankung bemerkt wurde. Das Risiko einer Chronifizierung ist unter anderem bei immunkompromittierten Personen erhöht. Eine chronische Hepatitis B kann zur Entstehung einer Leberzirrhose oder eines Leberzellkarzinoms führen (Robert Koch-Institut 2016).
Empfehlungen zur HBV-Impfung
Die Ständige Impfkommission (STIKO) empfiehlt die Hepatitis-B-Impfung als Standardimpfung für alle Säuglinge, als Indikationsimpfung bei Personen, bei denen wegen einer vorbestehenden oder zu erwartenden Immundefizienz beziehungsweise -suppression oder wegen einer vorbestehenden Erkrankung (z. B. HIV- oder Hepatitis-C-Infektion bzw. Dialysepflicht) ein schwerer Verlauf einer Hepatitis-B-Erkrankung zu erwarten ist, sowie bei Personen mit einem erhöhten nichtberuflichen Expositionsrisiko (z. B. Kontakt zu Hepatitis-B-Oberflächen-Antigen-(HBsAg)-Trägern in Familie/Wohngemeinschaft oder Sexualverhalten mit hohem Infektionsrisiko). Die HBV-Impfung ist auch empfohlen bei Personen mit erhöhtem beruflichen Expositionsrisiko, zum Beispiel Personal in medizinischen Einrichtungen (einschließlich Labor- und Reinigungspersonal), Sanitäts- und Rettungsdienst, betriebliche Ersthelferinnen/Ersthelfer, Polizistinnen/Polizisten und Personal von Einrichtungen, in denen eine erhöhte Prävalenz von Hepatitis-B-Infizierten zu erwarten ist (z. B. Gefängnisse, Asylbewerberheime, Einrichtungen für Menschen mit Behinderungen). Daneben besteht eine Indikation als Reiseimpfung, wobei bei dieser Risikogruppe eine individuelle Gefährdungsbeurteilung erforderlich ist. Die STIKO empfiehlt, zur Kontrolle des Impferfolgs 4–8 Wochen nach Abschluss der Impfserie die Anti-HBs quantitativ zu bestimmen, wobei Anti-HBs ≥ 100 IE/l für eine erfolgreiche Impfung sprechen. Bei Reiseindikation ist individuell abzuwägen, ob eine Impferfolgskontrolle erforderlich erscheint (Robert Koch-Institut 2022).
Traditionelle HBV-Impfstoffe
Das Standard-Dosierungsschema der bisher zur Verfügung stehenden HBV-Impfstoffe umfasst die Gabe von drei Dosen innerhalb von sechs Monaten. Bei gesunden, jungen Erwachsenen unter 40 Jahren zeigen diese HBV-Impfstoffe nach Abschluss der kompletten Drei-Dosen-Impfserie Seroprotektionsraten von 90 % oder mehr, das heißt, eine große Mehrheit der Geimpften entwickelt anti-HBs-Antikörperkonzentrationen, die mit der Entwicklung eines Immungedächtnisses und eines Langzeitschutzes assoziiert sind (Van Damme 2017). Bei älteren Erwachsenen ab dem Alter von 40 Jahren, Männern, Diabetikerinnen/Diabetikern, Adipösen und bei Raucherinnen/Rauchern sowie bei Personen, die nicht die gesamte Drei-Dosen-Impfserie erhalten, tritt hingegen eine verminderte Immunantwort auf (Van Damme 2017). Mehrere Studien weisen auf suboptimale Abschlussraten der Drei-Dosen-Impfserie hin. So zeigten in den USA durchgeführte Kohortenstudien, dass nur rund jeder zweite bis dritte Erwachsene die komplette HBV-Impfserie mit drei Dosen innerhalb von zwei Jahren abschloss (Trantham 2018; Nelson 2009). Zur Frage nach der Vervollständigung von HBV-Impfserien in Deutschland sind keine Daten verfügbar.
Der neue HBV-Impfstoff HEPLISAV-B
Anfang 2021 wurde in der EU ein neuer Impfstoff zur aktiven Immunisierung gegen eine HBV-Infektion bei Erwachsenen ab einem Alter von 18 Jahren zugelassen. Der Impfstoff wird durch das deutsch-dänische Unternehmen Bavarian Nordic unter dem Produktnamen HEPLISAV-B vertrieben. Im Gegensatz zu den traditionellen HBV-Impfstoffen besteht eine Impfserie mit HEPLISAV-B aus nur zwei Dosen, verabreicht im Abstand von einem Monat. HEPLISAV-B enthält das gleiche Antigen (HBsAg) wie die Drei-Dosen-HBV-Impfstoffe, dieses wird dabei jedoch durch CpG 1018 und nicht durch ein Aluminiumsalz adjuvantiert. Das Adjuvans CpG 1018 bindet an den Toll-like-Rezeptor 9 und aktiviert dadurch plasmazytoide dendritische Zellen. Diese Aktivierung führt zu einer starken und anhaltenden Antikörperantwort, wahrscheinlich aufgrund der raschen Bildung einer großen Anzahl von Anti-HBs-Antikörper-sezernierenden Plasmazellen und HBsAg-spezifischen B- und T-Gedächtniszellen (HEPLISAV-B Fachinformation 2021).
HEPLISAV-B wird im ersten Halbjahr 2022 in Deutschland verfügbar sein und kann im Rahmen der Empfehlungen der STIKO eingesetzt werden. Der Preis einer Impfserie HEPLISAV-B entspricht etwa dem Preis einer Impfserie mit anderen für Erwachsene zugelassenen HBV-Impfstoffen.
Immunantwort auf HEPLISAV-B
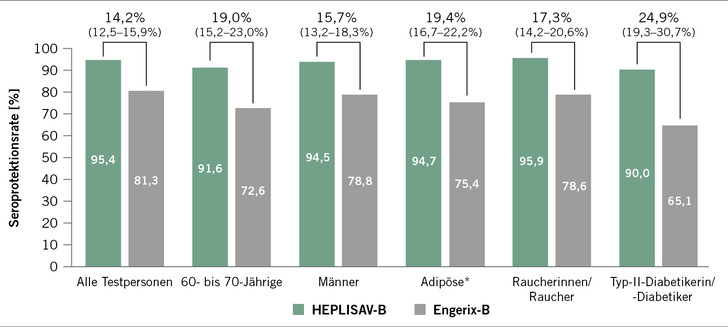
Im Rahmen von drei Phase-3-Zulassungsstudien verglich man eine Impfserie HEPLISAV-B (2 Dosen im Monat 0 und 1) mit einer Impfserie Engerix-B (3 Dosen im Monat 0, 1 und 6). Die ersten zwei Studien schlossen gesunde Erwachsene im Alter von 18–55 Jahren (n = 2415) beziehungsweise 40–70 Jahren (n = 2452) ein. In beiden Studien zeigten mit HEPLISAV-B Geimpfte eine frühere und stärkere Immunantwort als die Engerix-B-Geimpften (Halperin 2012; Heyward 2013). Zwei Monate nach der zweiten Dosis betrug die Seroprotektionsrate, definiert als Anteil der Testpersonen mit Anti-HBs ≥ 10 IE/l, in der HEPLISAV-B-Gruppe 95,1 % (Studie 1) beziehungsweise 90,1 % (Studie 2) und in der Engerix-B-Gruppe 22,5% (Studie 1) beziehungsweise 17,0 % (Studie 2). Sieben Monate nach Impfbeginn lag die Seroprotektionsrate in der HEPLISAV-B-Gruppe bei 97,9 % (Studie 1) beziehungsweise 94,8 % (Studie 2) und in der Engerix-B-Gruppe bei 81,1 % (Studie 1) beziehungsweise 72,8 %
(Studie 2). Die dritte Zulassungsstudie schloss Erwachsene im Alter von 18–70 Jahren ein, wobei im Gegensatz zu den anderen beiden Studien eine klinisch schwerwiegende akute oder chronische Krankheit kein Ausschlusskriterium war. Auch in dieser Studie waren die Seroprotektionsraten in der HEPLISAV-B-Gruppe signifikant höher als in der Engerix-B-Gruppe, speziell
auch bei Personen, die normalerweise eine verminderte Immunantwort auf HBV-Impfstoffe zeigen, wie Ältere, Personen mit Adipositas, Raucherinnen/Raucher und Typ-II-Diabetikerinnen/-Diabetiker. So betrug zum Beispiel sieben Monate nach der ersten Dosis die Seroprotektionsrate bei Personen mit Diabetes in der HEPLISAV-B-Gruppe 90,0 % und in der Engerix-B-Gruppe 65,1 % (Jackson 2018) (➥ Abb. 1).
Sicherheitsprofil von HEPLISAV-B
Eine Analyse untersuchte die integrierten Daten zur Sicherheit aus den drei Phase-III-Studien bei HEPLISAV-B-Geimpften (n = 9365) und bei Engerix-B-Geimpften (n = 3867). Lokale und systemische Reaktionen auf die Injektion waren nach der Impfung mit HEPLISAV-B ähnlich häufig wie nach der Impfung mit Engerix-B (55,1 % vs. 57,1 %). Lokale Reaktionen, das heißt Schmerz, Rötung oder Schwellung an der Injektionsstelle, traten bei 42,8 % in der HEPLISAV-B-Gruppe und bei 41,1 % in der Engerix-B-Gruppe auf. Systemische Reaktionen, inklusive Fieber, Unwohlsein, Kopfschmerzen und Ermüdung, kamen bei 32,3 % in der HEPLISAV-B-Gruppe und bei 37,4 % in der Engerix-B-Gruppe vor. Auch in Bezug auf das Auftreten anderer unerwünschter Ereignisse war das Sicherheitsprofil von HEPLISAV-B insgesamt vergleichbar mit dem von Engerix-B (Heyer 2018).
HEPLISAV-B bei Non-Respondern
Es liegen erste Daten vor zum Einsatz von HEPLISAV-B bei Personen, bei denen eine frühere Impfung mit einem anderen HBV-Impfstoff keine genügende Immunantwort auslöste (Non-Responder). So schloss eine retrospektive Querschnittstudie 67 HIV-Infizierte ein, die keine Immunantwort auf eine oder mehrere Serien mit anderen HBV-Impfstoffen gezeigt hatten. Nach zwei Dosen HEPLISAV-B waren 87 % der Testpersonen seropositiv (Anti-HBs > 10 IE/l; Khaimova 2021). Die Impfung von HIV-infizierten Non-Respondern mit HEPLISAV-B führte in einer anderen Untersuchung zu einer ähnlich hohen Seroprotektionsrate (81 %; Schnittman 2021).
Abschluss von HBV-Impfserien
Eine weitere Kohortenstudie untersuchte, ob HEPLISAV-B-Geimpfte (n = 4727) mit höherer Wahrscheinlichkeit die Impfserie vervollständigten als Engerix-B-Geimpfte (n = 6161). Die Studie umfasste Mitglieder von Kaiser Permanente Southern California, einem integrierten Gesundheitsversorgungssystem in den USA. 60,5 % der HEPLISAV-B-Geimpften und 32,3 % der Engerix-B-Geimpften schlossen die Impfserie innerhalb eines Jahres ab. Personen, die mit der HEPLISAV-B-Impfserie begannen, hatten somit eine signifikant höhere Wahrscheinlichkeit die Impfserie abzuschließen (bereinigtes relatives Risiko: 1,77; 95%-KI: 1,68–1,87) (Bruxvoort 2020).
Interessenkonflikt: Der Erstautor und seine Koautorin sind Angestellte von Bavarian Nordic, die HEPLISAV-B in Deutschland vertreibt.
Literatur
Bruxvoort KS et al.: Association of number of series doses required with hepatitis B vaccine series completion in US adults. JAMA Newt Open 2020: 3: e2027577.
Halperin SA et al.: Comparison of safety and immunogenicity of two doses of investigational hepatitis B virus surface antigen co-administered with an immunostimulatory phosphorothioate oligodeoxyribonucleotide and three doses of a licensed hepatitis B vaccine in healthy adults 18–55 years of age. Vaccine 2012; 30: 2556–2563.
HEPLISAV-B Fachinformation
Heyward WL et al.: Immunogenicity and safety of an investigational hepatitis B vaccine with a Toll-like receptor 9 agonist adjuvant (HBsAg-1018) compared to a licensed hepatitis B vaccine in healthy adults 40–70 years of age. Vaccine 2013; 31: 5300–5305.
Hyer R et al.: Safety of a two-dose investigational hepatitis B vaccine, HBsAg-1018, using a toll-like receptor 9 agonist adjuvant in adults. Vaccine 2018; 36: 2604–2611.
Jackson S et al.: Immunogenicity of a two-dose investigational hepatitis B vaccine, HBsAg-1018, using a toll-like receptor 9 agonist adjuvant compared with a licensed hepatitis B vaccine in adults. Vaccine 2018; 36: 668–674.
Khaimova R et al.: Serological response with Heplisav-B in prior Hepatitis B vaccine non-responders living with HIV. Vaccine 2021; 39: 6529–6534.
Nelson JC et al.: Compliance with multiple-dose vaccine schedules among older children, adolescents, and adults: results from a vaccine safety datalink study. Am J Public Health 2009; 99: S389–S397.
Robert Koch-Institut: RKI-Ratgeber Hepatitis B und D, erstveröffentlicht im Jahre 2000, aktualisiert im Jahre 2016. https://www.rki.de/DE/Content/Infekt/EpidBull/Merkblaetter/Ratgeber_Hep… (abgerufen am 21.10.2021).
Robert Koch-Institut: Empfehlungen der Ständigen Impfkommission beim Robert Koch-Institut. Epidemiologisches Bulletin 2001; 34.
Schnittman SR et al.: Heplisav-B Seroprotection in people with HIV: a single-center experience. J Acquir Immune Defic Syndr 2021; 86: 445–449.
Trantham L et al.: Adherence with and completion of recommended hepatitis vaccination schedules among adults in the United States. Vaccine 2018; 36: 5333–5339.
Van Damme P et al.: Hepatitis B vaccines. In: Plotkin S (Hrsg.): Vaccines. 7. Aufl. Amsterdam: Elsevier, 2017.
doi:10.17147/asu-1-174360
Weitere Infos
Robert Koch-Institut: RKI-Ratgeber Hepatitis B und D
https://www.rki.de/DE/Content/Infekt/EpidBull/Merkblaetter/Ratgeber_HepatitisB.html
Robert Koch-Institut: Empfehlungen der Ständigen Impfkommission beim Robert Koch-Institut. Epidemiologisches Bulletin 4, 2022
https://www.rki.de/DE/Content/Infekt/EpidBull/Archiv/2022/Ausgaben/04_2…
Kernaussagen
neuer Impfstoff zur Prävention von HBV-Infektionen bei Erwachsenen.
Fachinformation (Gekürzt)
HEPLISAV B 20 Mikrogramm Injektionslösung in einer Fertigspritze. Hepatitis-B-Impfstoff (rekombinante DNA, adjuvantiert).
Zusammensetzung: Eine Dosis (0,5 ml) enthält 20 Mikrogramm Hepatitis-B-Oberflächenantigen (HBsAg), hergestellt in Hefezellen (Hansenula polymorpha) und adjuvantiert mit 3000 Mikrogramm des Adjuvans CpG 1018.
Indikation: Anwendung bei Erwachsenen ab einem Alter von 18 Jahren zur aktiven Immunisierung gegen eine Hepatitis-B-Virusinfektion (HBV), die durch alle bekannten Subtypen des Hepatitis-B-Virus verursacht wird.
Dosierung: Nur intermuskuläre Verabreichung. Zwei Dosen zu jeweils 0,5 ml mit einem Intervall von 1 Monat.
Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff, einen sonstigen Bestandteil oder gegen Hefe. Schwere allergische Reaktion, wie z. B. Anaphylaxie, nach einer vorherigen Dosis eines beliebigen Hepatitis-B-Impfstoffs.
Warnhinweise und Vorsichtsmaßnahmen: Nicht intravenös, subkutan oder intradermal verabreichen. Es sollten eine geeignete medizinische Behandlung und Überwachung für den Fall seltener anaphylaktischer Reaktionen zur Verfügung stehen. Nicht verabreichen im Falle einer akuten schweren fiebrigen Erkrankung. Maßnahmen zur Vorbeugung von Verletzungen durch Synkope ergreifen. Personen mit geschwächtem Immunsystem können eine verminderte Immunantwort zeigen.
Wechselwirkungen: Keine Daten zur gleichzeitigen Verabreichung mit anderen Impfstoffen.
Fertilität, Schwangerschaft und Stillzeit: Anwendung während Schwangerschaft möglichst vermeiden. Risiko für gestillten Säugling kann nicht ausgeschlossen werden. Keine Daten zur Auswirkung auf die Fertilität des Menschen.
Nebenwirkungen: Sehr häufig: Kopfschmerzen, Myalgie, Unwohlsein, Ermüdung, Schmerzen an der Injektionsstelle. Häufig: Schwellung an der Injektionsstelle, Erythem an der Injektionsstelle, Fieber. Gelegentlich: Gastrointestinale Symptome, Überempfindlichkeit. Selten: Schwindelgefühl, Parästhesie. Sehr selten: Anaphylaxie.
Art und Inhalt des Behältnisses: 0,5 ml Lösung in einer Fertigspritze mit Spitzenverschluss und Kolbenstopfen. Verschreibungspflichtig.
Stand: Verschreibungspflichtig. Februar 2021, Bavarian Nordic A/S, Philip Heymans Allé 3, 2900 Hellerup, Dänemark.
Weitere Informationen siehe Fachinformation. Nebenwirkungsmeldungen an die Hotline: 0800/627 3110 DE-2100006.
Koautorin
An der Erstellung des Beitrags beteiligt war Andrea Kühberger, Bavarian Nordic GmbH, Martinsried, Deutschland.
Kontakt
Das PDF dient ausschließlich dem persönlichen Gebrauch! - Weitergehende Rechte bitte anfragen unter: nutzungsrechte@asu-arbeitsmedizin.com.