Gesetzliche und geschichtliche Aspekte der Trinkwasserqualitätssicherung
Die durchgehende und flächendeckende Versorgung von Haushalten und öffentlichen Gebäuden mit Trinkwasser stellt eine der erfolgreichsten Errungenschaften der öffentlichen Gesundheit in Industrienationen dar. Seit der Entdeckung des Zusammenhangs zwischen durch mit Fäkalien kontaminiertem Brunnenwasser und dem Ausbruch von Cholera in London durch den Arzt John Snow (1854) sowie der ersten Isolation von Bakterien der Spezies Vibrio cholera durch Robert Koch in Ägypten (1884) hat die Verbesserung der Trinkwasserqualität massiv dazu beigetragen, die Sterblichkeit durch wasserübertragene Infektionen weltweit zu verringern und die Lebenserwartung signifikant zu erhöhen (WHO 1993, s. „Weitere Infos“).
In Deutschland wird die besondere Bedeutung der Ressource Wasser seit 2001 durch die Trinkwasserverordnung definiert und reguliert. Sie stellt die Umsetzung der EG-Richtlinie 98/83/EG „Über Qualität von Wasser für den menschlichen Gebrauch“ aus dem Jahr 1998 dar, die vorschreibt, dass die Mitgliedsstaaten der Europäischen Union die Standards für die Qualität des Trinkwassers in Nationalen Gesetzen festlegen. In ihrer neuesten Auflage aus dem Jahr 2019 ist festgelegt, dass es der „Zweck der Verordnung ist […], die menschliche Gesundheit vor den nachteiligen Einflüssen, die sich aus der Verunreinigung von Wasser ergeben, das für den menschlichen Gebrauch bestimmt ist, durch Gewährleistung seiner Genusstauglichkeit und Reinheit […] zu schützen“ (TrinkwV 2019, s. „Weitere Infos“). Dies ist die oberste Priorität bei der Produktion von Trinkwasser und dessen Transport durch Leitungen bis zum Privathaushalt oder zu öffentlichen Gebäuden und der Verteilung im Hausleitungsnetz.
Chemische Desinfektion des Trinkwassers – Gefahr oder Chance?
Während die Beigabe von chemischen Desinfektionsmitteln wie Chlor oder dem länger aktiven Chloramin als „letzte Barriere“ im Trinkwasser in Ländern wie den Vereinigten Staaten, Kanada, Singapur oder England üblich ist, wird hierzulande traditionell auf sie verzichtet. Dies ist neben der inhärent geringen Belastung mit Mikroorganismen vor allem mit dem der Trinkwasserversorgung voranstehenden Grundsatz verbunden, dass das Wasser „farblos, geruchslos […] und geschmacklich neutral und kühl […]“ sein muss (TrinkwV 2019). Die gesetzlich vorgeschriebene gesundheitliche Unbedenklichkeit des Wassers wird durch eine sehr umfassende Aufbereitung und die überwiegende Nutzung von Grundwasser als Ausgangsmaterial erzielt. Die Abwesenheit von chemischen Bakteriziden im Wasser können jedoch zu einer höheren Konzentration an (zumeist harmlosen) Mikroorganismen im Wasser führe, auf der anderen Seite sind allerdings gesundheitsschädliche und oft nicht ausreichend charakterisierte Desinfektionsnebenprodukte (z. B. Trihalogenmethane) sowie bestimmte, zu Korrosion führende Bakterien, weniger häufig zu finden.
Trotz der hohen Ansprüche an Trinkwasser kommt es in Industrienationen immer wieder zu vereinzelten Fällen oder sogar Ausbrüchen von mit Wasser oder dem wasserführenden Leitungssystem assoziierten mikrobiellen Krankheitserregern. Diese Vorfälle werden oft durch alternde wasserführende Infrastruktur oder unzureichendes Qualitätsmanagement verursacht: Pathogene können durch einen Druckabfall ins Leitungssystem eindringen und in den Verbrauch gelangen. In den Vereinigten Staaten von Amerika werden beispielsweise jährlich regelmäßig zwischen 12 und 19 Millionen Fälle von gastrointestinalen Infektionen registriert. In Deutschland hingegen sind entsprechende Ausbrüche in den letzten Jahrzehnten weniger mit Mängeln in der zentralen Aufbereitung und Verteilung des Wassers, sondern überwiegend mit Überschwemmungen (wie bei einem Kryptosporidiose-Ausbruch in Halle 2013), Kreuzkontaminationen bei Wasserrohrbrüchen (beispielsweise durch Frost, Vibrationen im Straßenverkehr oder unvorsichtigen Tiefbauarbeiten) oder dem unsachgemäßen Betreiben von Privatbrunnen in Erscheinung getreten. Laut Angaben der Gesundheitsberichterstattung des Bundes sind die bis zu 65 Millionen gastrointestinalen Infektionen zum allergrößten Teil auf kontaminierte Lebensmittel und die direkte Personen-Personen-Übertragung zurückzuführen.
Biofilm in der Hausinstallation
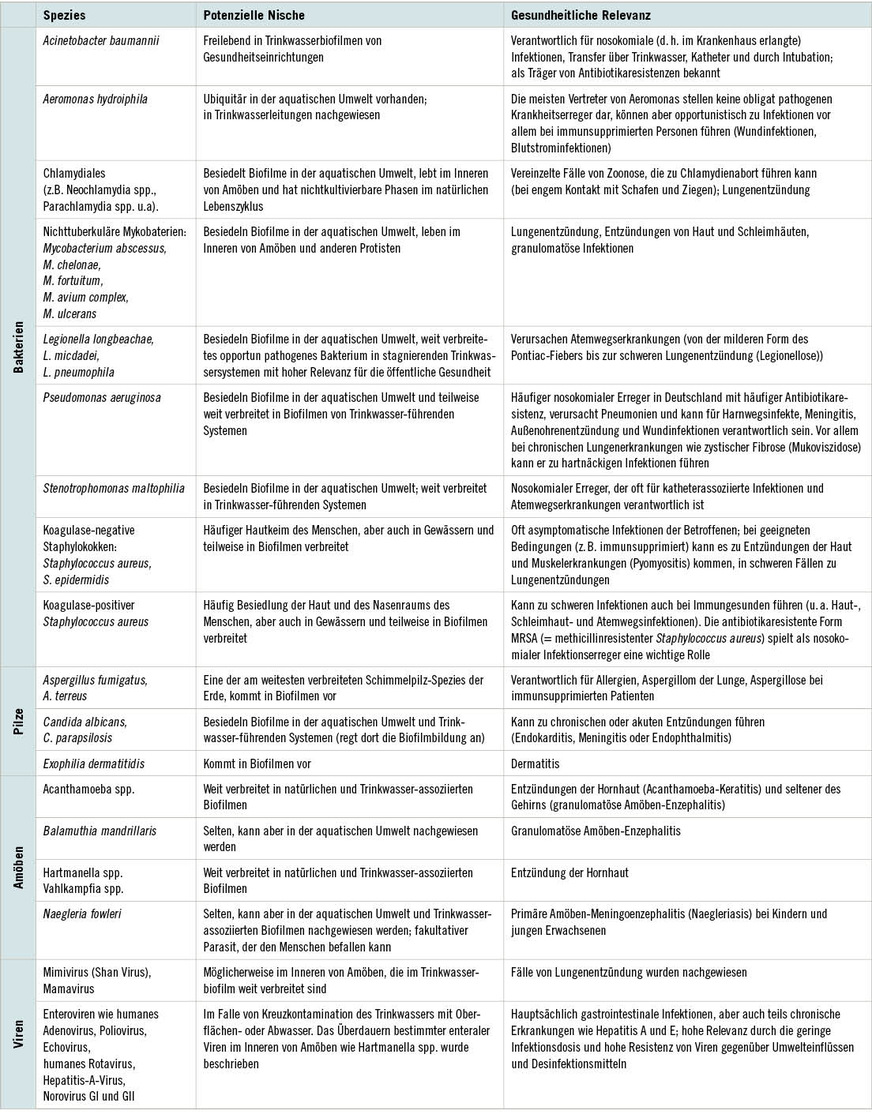
Mit dem Übergang des Trinkwassers in die Hausinstallation erhöhen sich die Stagnationsraten und somit auch die Möglichkeiten für opportunistisch pathogene Bakterien, sich in Biofilmen einzunisten. Als Biofilm wird der ubiquitäre Aufwuchs bezeichnet, der im Inneren von jedem wasserführenden System (sowohl natürlich als auch konstruiert) gefunden werden kann. Je nach Ort und Lage können Biofilme aus bis zu 1012 Bakterien, Amöben, Schimmelpilzen sowie Algen pro Millimeter und den von ihnen ausgestoßenen Metaboliten (extrazelluläre polymere Substanzen) bestehen (Flemming u. Wuertz 2019). Für potenziell mikrobielle Pathogene wie Legionella pneumophila und nichttuberkulöse Mykobakterien stellt der Biofilm eine bevorzugte ökologische Nische dar, die Schutz vor Desinfektion und eine Abundanz von Nährstoffen bereithält. Die Kontrolle und Reduzierung solcher Bakterien ist äußerst schwierig und ihre Auswirkungen auf die Gesundheit des Einzelnen und das Gesundheitssystem entsprechend groß. Eine Übersicht der aktuell im Trinkwasser oder Trinkwasserbiofilmen vorhandenen und für die Gesundheit relevanten Mikroorganismen ist in ➥ Tabelle 1 dargestellt.
Krankenhäuser und Pflegeeinrichtungen bedürfen besonders strenger Kontrolle
In Krankenhäusern und ähnlichen Einrichtungen, in denen immunsupprimierte und multimorbide Personen in Kontakt mit im Wasser enthaltenen opportunistischen oder enteralen Pathogenen kommen, stellen mit dem Trinkwasser assoziierte Pathogene eine besondere Herausforderung dar. Die für die Legionellose verantwortlichen Legionella pneumophila haben seit ihrer ersten Beschreibung während eines Treffens der Veteranen-Organisation „American Legion“ im Jahr 1976 zu jährlich mehr als 10 000 schweren Erkrankungen der Atemwege mit einer Mortalitätsrate von zwischen 5 und 30 Prozent in den USA geführt und sind auch in Europa in hohem Maße zu finden. Vor allem Personen mit Risikofaktoren sowie ältere Männer und Rauchende sind besonders betroffen. Im Lebenszyklus von L. pneumophila spielt der Biofilm von Trinkwasserleitungen eine besondere Rolle: Durch den Aufenthalt der Bakterien in im Biofilm vorkommenden Amöben der Genera Acanthamoeba und Naegleria erhalten sie Virulenzfaktoren, die ihre Pathogenität für den Menschen durch Befall von Makrophagen in der Lunge beträchtlich erhöhen.
Neben Deutschland existieren aktuell lediglich in den Niederlanden und Frankreich gesetzliche Vorgaben zur Überwachung von Trinkwasser hinsichtlich der Anwesenheit von Legionellen, während in den meisten anderen Ländern Grenzwerte für das Vorkommen von bestimmten Fäkalindikatoren, wie Escherichia coli oder Enterococcus faecalis, vorhanden sind. Die Anwesenheit dieser Indikatoren wird in der Regel durch kulturbasierte Methoden untersucht; kulturunabhängige molekulare (oft auf der Polymerase-Kettenreaktion basierend), enzymatische oder photometrische Techniken (z. B. Durchflusszytometrie) gewinnen allerdings mehr und mehr an Relevanz und sind bereits als internationaler Standard für den Nachweis von Legionellen im Trinkwasser etabliert (ISO 2019).
Labormethoden zur routinemäßigen Untersuchung der Trinkwasserqualität
Der große Vorteil von nicht auf das Wachstum von Bakterien basierenden Nachweismethoden besteht in der deutlichen Verkürzung der Untersuchungsdauer zwischen Probenahme und Ergebnis. So können Zellzahlen der beprobten Wasserleitungen in wenigen Minuten durch Durchflusszytometrie oder in einigen Stunden durch Polymerase-Kettenreaktion bestimmt werden, während die Kultivierung auf Agarplatten Tage oder sogar Wochen (10 Tage im Fall von Legionella pneumophila) dauert. Außerdem ermöglicht der kulturunabhängige Nachweis auch die Detektion von Bakterien und Amöben, die aufgrund von Nährstoffmangel oder durch widrige äußere Einflüsse in einen dormanten Dauerstatus (Zysten) oder in den viable but non-culturable (VBNC) Zustand (bekannt zum Beispiel für opportunistische Legionella spp. oder Pseudomonas aeruginosa) übergegangen sind.
Die Relevanz von Bakterien im VBNC-Status wird seit mehr als 35 Jahren diskutiert und kann erst seit der breiteren Verfügbarkeit von molekularen Techniken ausreichend erforscht und beschrieben werden. So wurde unter anderem gezeigt, dass der VBNC-Status einen Teil des natürlichen Lebenszyklus von Legionella pneumophila im Trinkwasserbiofilm darstellt und dass sie auch nach 30 bis 60 Minuten bei 70 °C (typische Konditionen zur thermischen Desinfektion von wasserführenden Systemen, wie sie zum Beispiel in Frankreich gesetzlich vorgeschrieben ist) in Amöben und in Makrophagen der menschlichen Lungen ihre Fähigkeit zur Vermehrung wiedererlangen können.
Ein ähnliches Verhalten wie für L. pneumophila wurde auch für die Familie der Staphylokokken gezeigt. Ihre Vertreter besiedeln hauptsächlich die menschliche Haut und werden durch direkten Kontakt übertragen, wodurch sie zu teils schweren Infektionen führen können. Als bekanntester Vertreter ist Staphylococcus aureus, vor allem in seiner resistenten Form, dem methicillinresistenden Staphylococcus aureus (MRSA), eine gefürchtete Ursache nosokomialer Infektionen. Staphylokokken sind aber auch im Trinkwassermikrobiom als opportunistischer Krankheitserreger weit verbreitet. In einer Studie von Shoults and Ashbolt (2019) wurde gezeigt, dass wiederholte Zyklen von UV-C-Desinfektion mit Dosen von mehr als 20 mJ*cm–2 (wie vom Deutschen Verein des Gas- und Wasserfaches, dem Branchenverband der Wasserwirtschaft im Arbeitsblatt W-294 empfohlen) bei S. epidermidis und S. aureus zu einer erhöhten Resistenz gegenüber diesem Bakterizid führen und sie in einen VBNC-Zustand überführen können. In einer anschließenden Anzucht in Nährmedium haben die Staphylokokken dann wieder ihre Viabilität – also auch Infektiosität – und somit Relevanz für die öffentliche Gesundheit erlangt.
Ein Blick in die Zukunft der Überwachung des Trinkwassernetzes
Obwohl die Fallzahlen von mit Trinkwasser assoziierten und auf mikrobielle Pathogene zurückzuführenden Infektionen in Deutschland und anderen Industrienationen immer noch verhältnismäßig gering sind, sollten vor allem mit Blick auf sich ändernde demografische Strukturen und den Klimawandel weiter an der Überwachung und Qualitätssicherung dieser wichtigsten Ressource gearbeitet werden. Dies ist besonders im Anbetracht der teilweise unklaren Übertragungsketten von neuen Krankheitserregern wie dem Coronavirus CoV2 der Fall, für das zumindest zu Beginn des Jahres 2020 nicht sichergestellt war, ob eine Eintragung auch über den Stuhl von Infizierten in den Wasserkreislauf möglich ist. Während durch neuere Erkenntnisse und Meldungen des Umweltbundesamtes und der WHO diese Route wohl auszuschließen ist, da fäkal ausgeschiedenes CoV2 nicht in der Zellkultur vervielfältigt werden konnte und somit zu vermuten ist, dass das Virus den menschlichen Verdauungstrakt nicht mit intakter Infektiosität durchwandern kann, könnte dies beim nächsten noch unbekannten Pathogen anders aussehen.
Aus diesem Grund ist es ratsam, moderne molekulare Methoden, aktuelle Trends und wissenschaftliche Errungenschaften in Umweltmedizin und Umweltingenieurswissenschaften sowie der Mikrobiologie und Biochemie auch in Zukunft für die Kontrolle und das Monitoring der Ressource Wasser zu nutzen. Die Entwicklungen der letzten Jahre machen in dieser Hinsicht jedoch durchaus Mut. Beispielsweise lassen die immer weiter verbreitete Verfügbarkeit und die sinkenden Kosten von Genomsequenzierungen in Klinik und Umweltmikrobiologie vermuten, dass in naher Zukunft die Identifikation und der Nachweis von momentan nicht bekannten oder nach Stand der Technik nicht detektierbaren Trinkwasserpathogenen leichter und zuverlässiger gelingt. Aktuell werden in den USA und in Singapur in einem Netzwerk von über 16 000 Abwasseraufbereitungsanlagen in einem Projekt des Massachusetts Institute of Technology (MIT) und des Singapore Centre for Life Science Engineering (SCELSE) der Zu- und Abfluss auf das Vorhandensein von CoV2 untersucht, um die Verbreitung von Covid19 in der Bevölkerung zu untersuchen (Wu et al. 2020).
Ebenfalls schon heute können modifizierte und optimierte Nachweismethoden, die auf bekannten Prinzipien basieren, helfen, möglichst schnell und zuverlässig auf Kontaminationen (im Katastrophenfall oder durch Bioterrorismus) zu reagieren und die Konsumierenden zu schützen. Beispiele sind die Behandlung von Wasserproben mit Propidium- und Ethidium–Monoazid, um zuverlässiger VBNC-Bakterien oder infektiöse enterale Viren zu identifizieren (Leifels et al. 2019). Hierbei wird durch eine Vorbehandlung von Umweltproben mit Reagenzien, die bei erfolgreicher Bindung mit zugänglichem Genom eine Detektion durch die Methode verhindern, eine der größten Limitierung der quantitativen Polymerasekettenreaktion (qPCR) angegangen. Während die qPCR nämlich sehr sensitiv und spezifisch ist sowie zeitnah und relativ kostengünstig Ergebnisse liefert, erlaubt sie es nicht, zwischen infektiösen und nichtinfektiösen Viren zu unterscheiden (➥ Abb. 1).
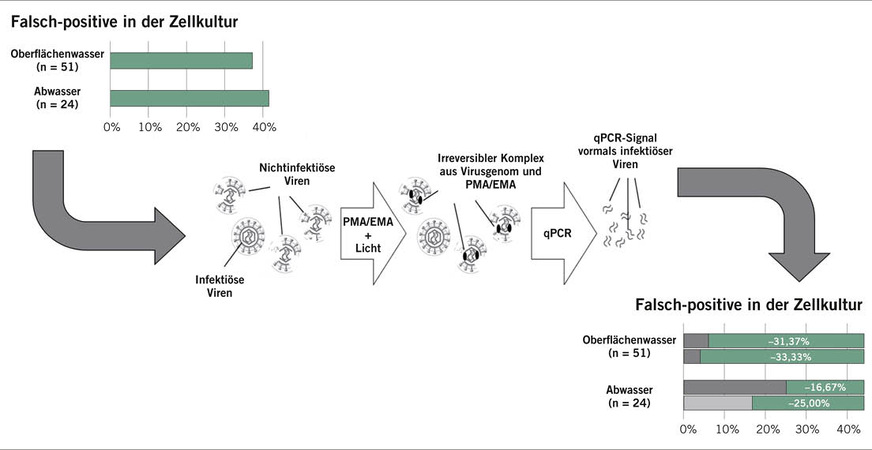
Bei der Bewertung des Risikos, das der Konsum von Wasser oder auch das Baden in einem Fließgewässer für die Bevölkerung darstellt, könnte dies helfen, eine realistischere Prognose abzugeben (Leifels et al. 2019).
Erwähnenswert ist auch die vom Center for Microbial Ecology and Technology (CMET) der Universität Ghent in Belgien entwickelte Methode Phenoflow. Hierbei wird durch die Verbindung der im klinischen und umweltmikrobiologischen Kontext immer weiter verbreiteten Durchflusszytometrie
mit der bereits erwähnten Genomsequenzierung die Zusammensetzung der mikrobiellen Gemeinschaft im Trinkwasser charakterisiert und Veränderungen beschrieben, die auf eine Kontamination des Trinkwassers, beispielsweise durch einen Rohrbruch, in Echtzeit hinweisen können (Favere et al. 2020). Somit können Behörden und Wasserversorgungsbetriebe sehr schnell auf die veränderte Situation reagieren und Abkochempfehlungen herausgeben oder Notfallchlorung durchführen und somit das Risiko für den Verbraucher möglichst gering halten.
Interessenkonflikt: Der Erstautor und seine Koautorin geben an, dass keine Interessenkonflikte vorliegen.
Literatur
Alarcon Falconi TM, Cruz MS, Naumova EN: The shift in seasonality of legionellosis in the USA. Epidemiol Infect 2018; 146: 1824–1833.
Ashbolt NJ: Environmental (Saprozoic) Pathogens of Engineered Water Systems: Understanding Their Ecology for Risk Assessment and Management. Pathogens 2015; 4 : 390–405.
Bédard E, Fey S, Charron D, Lalancette C, Cantin P, Dolcé P, Laferrière C, Déziel E, Prévost M: Temperature diagnostic to identify high risk areas and optimize Legionella pneumophila surveillance in hot water distribution systems. Water Res 2015; 71: 244–256.
Buysschaert B, Vermijs L, Naka A, Boon N, De Gusseme B: Online flow cytometric monitoring of microbial water quality in a full-scale water treatment plant. npj Clean Water 2018; 1: 16.
Collier SA, Stockman LJ, Hicks LA, Garrison LE, Zhou F, Beach MJ: Direct healthcare costs of selected diseases primarily or partially transmitted by water. Epidemiol Infect 2012; 140: 2003–2013.
Favere J, Buysschaert B, Boon N, De Gusseme B: Online microbial fingerprinting for quality management of drinking water: Full-scale event detection. Water Res 2020; 170: 115353.
Flemming H-C, Wuertz S: Bacteria and archaea on Earth and their abundance in biofilms. Nat Rev Microbiol 2019; 17: 247–260.
ISO: Water quality — Detection and quantification of Legionella spp. and/or Legionella pneumophila by concentration and genic amplification by quantitative polymerase chain reaction (qPCR). ISO, 2019.
Ji P, Parks J, Edwards MA, Pruden A: Impact of Water Chemistry, Pipe Material and Stagnation on the Building Plumbing Microbiome. PloS one 2015; 10: e0141087–e0141087.
Leifels M, Shoults D, Wiedemeyer A, Ashbolt NJ, Sozzi E, Hagemeier A, Jurzik L: Capsid integrity qPCR – an azo-dye based and culture-independent approach to estimate adenovirus infectivity after disinfection and in the aquatic environment. Water-Sui 2019; 11: 1196.
Phin N, Parry-Ford F, Harrison T, Stagg HR, Zhang N, Kumar K, Lortholary O, Zumla A, Abubakar I: Epidemiology and clinical management of Legionnaires' disease. Lancet Infect Dis 2014; 14: 1011–1021.
Reynolds KA, Mena KD, Gerba CP: Risk of waterborne illness via drinking water in the United States, In: Reviews of environmental contamination and toxicology. Berlin: Springer, 2008, S. 117–158.
Shoults DC, Ashbolt NJ: Decreased efficacy of UV inactivation of Staphylococcus aureus after multiple exposure and growth cycles. Int J Hyg Envir Heal 2019; 222: 111–116.
TrinkwV – Verordnung über die Qualität von Wasser für den menschlichen Gebrauch. Bundesrat (Hrsg.), 2019.
WHO: Guidelines for drinking-water quality. World Health Organization (WHO), 1993.
Wu F, Xiao A, Zhang J et al.: SARS-CoV-2 titers in wastewater are higher than expected from clinically confirmed cases. medRxiv 2020; 2020.2004.2005.20051540.
Weitere Infos
TrinkwV – Verordnung über die Qualität von Wasser für den menschlichen Gebrauch. Bundesrat (Hrsg.), 2019.
https://www.bundesrat.de/SharedDocs/drucksachen/2019/0501-0600/590-19.p…
WHO: Guidelines for drinking-water quality. World Health Organization (WHO), 1993
https://apps.who.int/iris/bitstream/handle/10665/259956/9241544600-eng…
Koautorin
An der Erstellung des Beitrags beteiligt war Frau Selin Temizel (MPH), Fachärztin für Hygiene und Umweltmedizin, Stabstelle Hygiene und Umweltmedizin, Universitätsklinikum Augsburg