Mikrobielle Besiedlung des Trinkwassernetzes
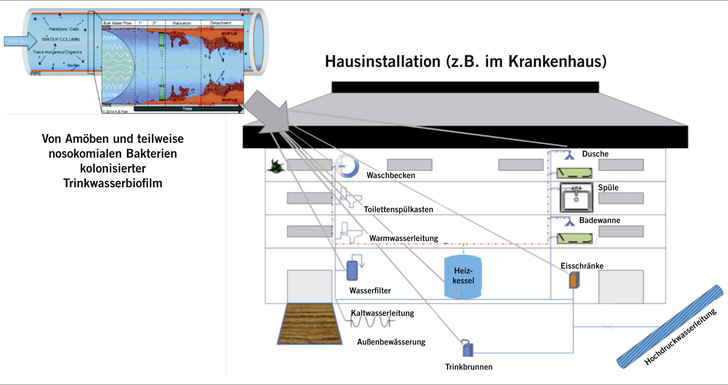
Wie in jedem wasserführenden System sind auch in Trinkwasserleitungen so genannte Biofilme zu finden, Konsortien aus bis
zu 1012 Bakterien, Amöben, Schimmelpilzsporen und Algen sowie den von ihnen sezernierten extrazellulären und auf
Polysacchariden basierenden Biopolymeren (Flemming u. Wingender 2010). Neben kosmetischen Bedenken und ihrem Einfluss auf Farbe und Durchflussgeschwindigkeit des Trinkwassers sind diese Biofilme vor allem als ökologische Nische von potenziell opportunistischen und teilweise – je nach Leitungsnetz – nosokomialen Pathogenen bekannt. Gerade in weitläufigen Leitungssystemen wie in Hotels, Universitäten und Krankenhäusern kommt es durch Schwankungen in der Nutzung und dem Alter der Rohre, Ventile und Wasseruhren oft zu Bereichen mit Stagnation und daraus folgendem erhöhten Biofilmwachstum (➥ Abb. 1). Entsprechend erhöht ist in diesen Bereichen das Vorkommen an Mikroorganismen, die für Personen mit geschwächtem Immunsystem ein beträchtliches gesundheitliches Risiko darstellen können.
Biofilme in der Patientenumgebung als Quelle von Antibiotikaresistenzgenen
Neben den viel beschriebenen Bereichen mit längerfristiger Stagnation im Krankenhausleitungsnetz (Wasserhähne in wenig genutzten Kellern oder Lagerräumen) werden seit Neuestem auch bisher vernachlässigte Abschnitte in direkter Patientenumgebung hinsichtlich ihrer Relevanz als Reservoirs für Erreger diskutiert, die die Ursache nosokomialer – also im Krankenhaus erworbener – Infektionen sein können. In einer Studie von Voigt et al. (2019) wurden zudem in Toiletten, Siphons von Waschbecken und Abflüssen von Duschen in Krankenhäusern und Altenpflegeeinrichtungen im Vergleich zu Privathaushalten bedenkliche Konzentrationen von Antibiotika nachgewiesen. Diese niedrigen Antibiotikadosen im Wasser begünstigen durch Selektion die Zunahme antibiotikaresistenter Bakterien (beispielsweise Vancomycin-resistente Enterokokken, Carbapenem-resistente Enterobacteriacae sowie Methicillin-resistenter Staphylococcus aureus), die nicht nur durch ihre oft beschriebene Fähigkeit, ihre Resistenz gegenüber den antibiotischen Substanzen im Biofilm durch horizontalen Gentransfer auf andere Mikroorganismen zu übertragen, sondern auch durch ihre teilweise inhärente Pathogenität von beträchtlicher gesundheitlicher Relevanz sind (Águila-Arcos et al. 2017).
Ähnliches wie für die von Voigt et al. (2019) beschriebenen Abflüsse gilt für die Biofilme, die sich in den Schläuchen von Duschanlagen in Patientenräumen bilden. Vor allem Legionellen mit ihrer Vorliebe für erhöhte Temperaturen und Stagnationen (beispielsweise, wenn Räume nicht durchgehend besetzt sind) sind hier zu finden und können durch den Wasserdampf in die menschliche Lunge gelangen. Hayes-Phillips et al. (2019) zeigten, dass Legionella spp. (74,6 %) und Legionella pneumophila (64,2 %) in einem Großteil der untersuchten Duschen in Privathaushalten in Adelaide, Australien, vorhanden sind und ihr Wachstum signifikant mit der Wassertemperatur und Nutzung der Anlagen sowie dem Alter von Haus und Wasserleitungssystem korrelieren. Gerade in Anbetracht der immer weiter steigenden Lebenserwartung in Australien, aber auch Deutschland, den anderen Ländern der Europäischen Union sowie England und den USA, kann diese Erkenntnis auf Krankenhäuser und Pflegeeinrichtungen übertragen werden, deren multimorbide und oft immunsupprimierte Bewohnerinnen und Bewohner besonders gefährdet sind, über diesen Weg mit den Pathogenen in Kontakt zu kommen.
Potenziell pathogene Amöben als Wirt und Rückzugsort nosokomialer Erreger
Neben der Gruppe der Legionellen sind auch andere nosokomiale Erreger in Biofilmen und oft auch in den ihn besiedelnden Amöben zu finden. Hohe Konzentrationen zeigen beispielsweise Vertreter der nichttuberkulösen Mykobakterien (NTM), die von Soto-Giron et al. (2016) im Aufwuchs von Trinkwasser-führenden System, auf Polyvinylchlorid- (PVC-)Oberflächen (ein Material, das – in Form von Ventilen verbaut – oft in Wasserleitungen vorhanden ist) und in Duschköpfen sowohl in Privathaushalten, aber auch in Krankenhäusern und Sporteinrichtungen identifiziert wurde. Dieses Vorkommen kann auch durch die Beigabe von Chlor, hohe Temperaturen (über 65 °C im zentralen und über 55 °C im peripheren Leitungsnetz) oder generell oligotrophe (minimales Vorhandensein von Nährstoffen) Verhältnisse nicht bedeutend reduziert werden, da NTM – wie zahlreiche andere nosokomiale und im Trinkwassersystem vorkommende Bakterien – dazu in der Lage sind, unter widrigen Bedingungen in den „viable but nonculturable“ (VBNC) Status überzugehen. In diesem Zustand können sie auch ungünstige Milieus über lange Zeiträume überleben und – was ein großes Problem für die Überwachung des Wassers darstellt – sind nicht durch die routinemäßig eingesetzten kulturbasierten Methoden nachweisbar (Muñoz Egea et al. 2017).
Legionellen im Trinkwasserleitungsnetz
Die Gattung der aus über 50 Spezies mit unterschiedlicher gesundheitlicher Relevanz bestehenden Legionellen wurde erstmal in den 1980er Jahren mit schweren Lungenentzündungen bei einem Veteranentreffen in einem wenig genutzten Hotel in Verbindung gebracht (Legionärskrankheit; Stout et al. 1982). Seitdem zählen Legionellen zu den wichtigsten opportunistischen und mit Trinkwasser(-biofilm) assoziierten nosokomialen Krankheitserregern, die allein in Europa zwischen 2011 und 2015 zu mehr als 30 000 Fällen von Atemwegserkrankungen in 29 Ländern führten. Kombiniert wurden in Deutschland, Frankreich, Spanien und Italien 70,3 Prozent aller Fälle in diesem Zeitraum detektiert, was mit entsprechend hohen Kosten für das Gesundheitssystem und Krankheitslast für den einzelnen Betroffenen verbunden war (Beauté 2017). Mit einer Mortalitätsrate zwischen 5 und 30 Prozent je nach Gesundheitsstatus des infizierten Individuums können Legionelloseausbrüche in Krankenhäusern, Pflegeheimen und Rehabilitationseinrichtungen ein großes Problem für die Gesundheit der Erkrankten beziehungsweise der Bewohnerinnen und Bewohner darstellen (Kanamori et al. 2016). Eine besondere Herausforderung bei der Kontrolle und Eindämmung des Legionellenwachstums im Trinkwasser ist ihre Fähigkeit, sich innerhalb des Biofilms in Amöben der Gattungen Naegleria und Acanthamöba einzunisten. Innerhalb dieser Protisten sind sie nicht nur vor Fressfeinden und der chemischen oder thermischen Desinfektion geschützt, sondern erlangen auch besondere Virulenzfaktoren, die sie erst relevant für die menschliche Gesundheit machen (Beauté 2017).
Der Legionellenausbruch in Warstein 2013
Spätestens seit dem Legionellenausbruch in Warstein im Regierungsbezirk Arnsberg im Jahr 2013 sind Legionellen im deutschsprachigen Raum in den Fokus der öffentlichen Aufmerksamkeit gerückt. Nachdem bis September eine unerklärliche Häufung von Atemwegserkrankungen mit drei Todesfällen auftraten, konnte Legionella pneumophila als Verursacher identifiziert werden (Maisa et al. 2015). Durch die Ballung der Fälle wurde festgestellt, dass die Übertragung der Bakterien über die Luft auf industrielle Verdunstungskühlungsanlagen zurückzuführen war. Erst nach Testung von über 880 Umweltproben von Biofilmen wurde die mit hoher Wahrscheinlichkeit betroffenen Anlagen identifiziert, abgeschaltet und desinfiziert. Gerade in Kühltürmen und Verdunstungsanlagen können die im Lebenszyklus der Legionellen essenziellen Amöben durch die relativ hohen Temperaturen (zwischen 20 und 40 °C) Biofilme von massiver Dichte aufbauen und entsprechend hohe Konzentrationen von Legionellen beherbergen, die dann über die Abluft in Form von Aerosolen an die Umwelt abgegeben werden und sich nach dem Einatmen in der Lunge festsetzen (Di Pippo et al. 2018). Zur Vorbeugung ähnlicher Ereignisse wurde mit der 42. Verordnung zur Durchführung des Bundes-Immissionsschutzgesetzes (Verordnung über Verdunstungskühlanlagen, Kühltürme und Nassabscheider – 42. BImSchV; s. „Weitere Infos“) die Grundlage geschaffen, solche Anlagen besser zu überwachen und einen unkontrollierten Legionellenbefall frühzeitig zu erkennen.
Die Trinkwasserverordnung als gesetzliche Leitlinie zur Überwachung des Trinkwassernetzes
In der Trinkwasserverordnung wird das Vorhandensein und die Relevanz von Legionellen je nach Anlage unterschiedlich bewertet. Für Großanlagen wie Hotels, aus denen „Trinkwasser an eine Öffentlichkeit abgegeben wird, besteht mindestens eine jährliche Untersuchungspflicht“, während solche, die „Trinkwasser in einer ausschließlich gewerblichen Tätigkeit (abgeben)“ alle drei Jahre von zertifizierten Probenehmern und akkreditierten Labors untersucht werden müssen (TrinkwV 2019; s. „Weitere Infos“). In jedem Fall muss eine Meldung an das Gesundheitsamt erfolgen, wenn der 2011 eingeführte technische Maßnahmenwert von 100 koloniebildenden Bakterien pro 100 ml überschritten wird.
Erforschung des Vorkommens von Legionellen und Amöben im Krankenhaustrinkwasser – ein Beispiel aus Südafrika
Ein Beispiel für die enge Verbindung zwischen Legionellen als Vertreter der Gruppe nosokomialer Bakterien und Amöben im Trinkwasser wurde von Muchesa et al. (2018) in drei Krankenhäusern der Maximalversorgung im südafrikanischen
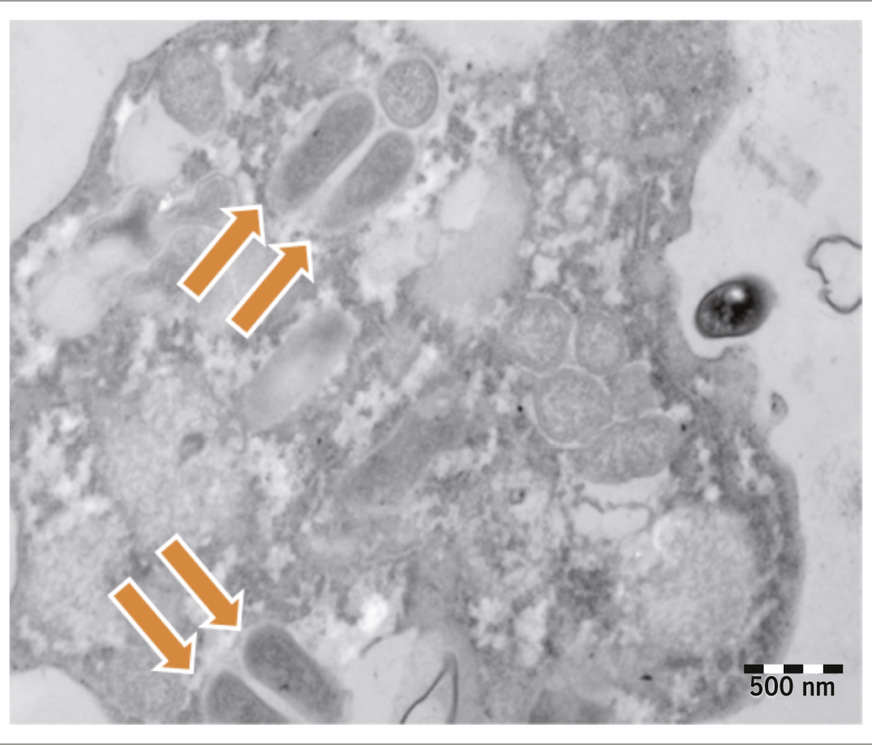
Johannesburg beschrieben. In verschiedenen medizinischen Einrichtungen wurden 98 Wasser- und Oberflächenproben genommen und innerhalb von 24 Stunden auf die Anwesenheit von Amöben untersucht. Beprobt wurden zentrale Sterilisationseinrichtungen (n=8), Operationssäle (n=42), Neugeborenstationen (n=13) sowie verschiedene Wasserhähne auf der Intensivstation (n=35). Oberflächenproben wurden im Inneren der Wasserhähne mit sterilen Tupfern genommen und in sterile Pufferlösung suspendiert. Für die Wasserproben wurden 500 ml Trinkwasser unter sterilen Bedingungen gewonnen, steril durch eine Porengröße von 0,45 µm filtriert und die Filter dann auf Wasser-Agar-Platten überführt (Muchesa et al. 2017). Nach 21 Tagen Inkubation bei 32 °C konnten durch Lichtmikroskopie lebende Amöben und Amöbenzysten beobachtet werden (➥ Abb. 2). In einem nächsten Schritt wurden die angereicherten Amöben per Polymerase-Kettenreaktion charakterisiert und auf das Vorhandensein von Legionellen hin untersucht (ISO 2019).
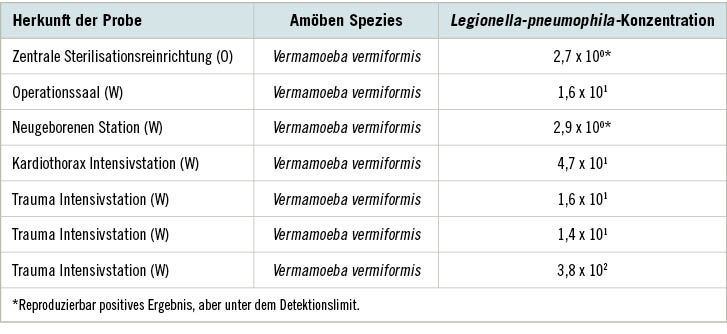
Durch diese Untersuchung wurde gezeigt, dass in 72,4 Prozent der Wasser- und Oberflächenproben Amöben detektiert werden konnten, von denen die meisten den Gattungen Vermamoeba (69,4 %) und Acanthamoeba (30,6 %) zuzuordnen waren. In 9,9 Prozent der Proben wurden Legionella pneumophila nachgewiesen
(➥ Tabelle 1).
Da diese Proben in teilweise kritischen Bereichen wie der Neugeborenenstation, der zentralen Sterilgutaufbereitung, der Intensivstation in der Herzchirurgie und der Trauma-Intensivstation gewonnen wurden, zeigt dieses Ergebnis, welche gesundheitliche Relevanz die Anwesenheit dieser Trinkwasser-assoziierten Mikroorganismen auf die Patientengesundheit haben kann. Neben dem Gesundheitsrisiko, das von der Anwesenheit von Legionellen in diesen Bereichen ausgeht, muss auch die gesundheitliche Relevanz der Acanthamöben selbst erwähnt werden. In der von Muchesa et al. (2018) verfassten Nachfolgestudie wurden die Acanthamoeba-Isolate mittels Gensequenzierung als nah verwandt mit Acanthamoeba spp. T3 und T20 charakterisiert. In anderen Arbeiten wurden genau diese Genotypen als Verursacher für Keratitis, Acanthamöbiasis (eine seltene Form der Hirnhautentzündung) und in einzelnen Fällen auch Lungenentzündungen in Verbindung gebracht. Eine Humanpathogenität für die ebenfalls in mehreren teils kritischen Bereichen der Krankenhäuser gefundenen Vermamoeba-Spezies ist bislang nicht bekannt, durch ihre Rolle als Wirt einiger der relevantesten nosokomialer Erreger ist ihr Vorhandensein jedoch nicht zu unterschätzen.
Die Verbindung zwischen Amöben und enteralen Viren
Neben der seit Langem bekannten Interaktion und Koexistenz von mit dem Trinkwasser assoziierten Amöben und potenziell humanpathogenen Bakterien gibt es spätestens seit der Beschreibung des Mimivirus, einem Virus, das sich in Acanthamoeba polyphaga vermehrt und auch den Menschen befallen kann (Raoult et al., 2007), die Theorie, dass auch Viren Amöben als ihren Wirt nutzen können. Während Mimiviren und andere nahe Verwandte wie das Pandoravirus nur in geringem Maße ein Risiko für den Menschen darstellen (opportunistisch können sie zu Erkrankungen der unteren Atemwege führen), ist aber zu befürchten, dass auch Viren die bei immunsupprimierten Individuen oder Kindern zu gastrointestinalen Infektionen oder chronischen Erkrankungen führen können, durch den Aufenthalt in Amöben vor Desinfektion geschützt werden können.
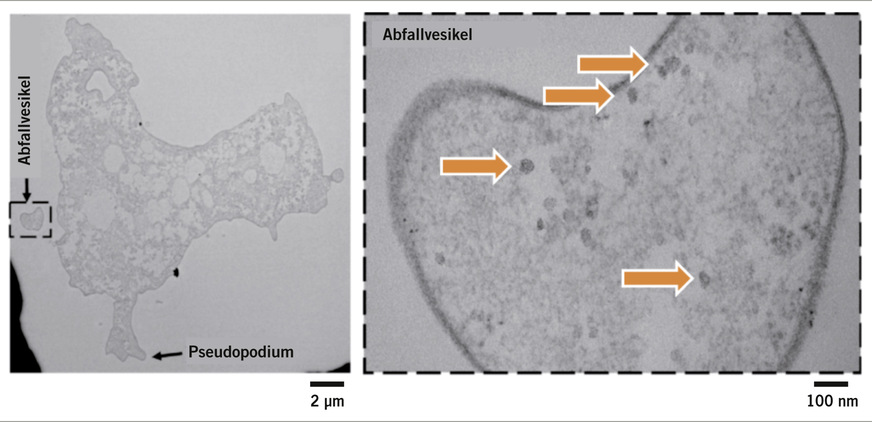
In einer viel beachteten Studie zeigten Atanasova et al. (2018), dass Enteroviren der Spezies Typ B Coxsackievirus 5 (CVB5) dazu in der Lage waren, von aus einem Trinkwasserhahn in einer kanadischen Klinik isolierten Vermamoeba vermiformis aufgenommen zu werden und in ihrem Inneren eine Verdauung zu umgehen. Anschließend ließen sich die Viren – teilweise nach mehreren Wochen oder Monaten – in Abfallvesikeln ausstoßen und folgten weiter ihrem natürlichen Lebenszyklus. Isoliert aus diesen Vesikeln und eingebracht in eine Zellkultur mit Buffalo-Green-Monkey-Stammzellen – der seit beinahe 100 Jahren genutzten Goldstandardmethode der Umweltvirologie – wurde gezeigt, dass diese Viren auch nach mehreren Monaten in den Amöben noch infektiös waren (➥ Abb. 3).
Da das Coxsackievirus bei geschwächten Personen mit schweren chronischen Erkrankungen wie Enzephalitis, Myokarditis, Perikarditis und der bei Kindern sehr weit verbreiteten Hand-Fuß-Mund-Krankheit in Verbindung gebracht wird, ist ein neuer und bisher nicht bekannter Infektionspfad über Amöben, die regelmäßig in Kühltürmen und dem Trinkwasser gefunden werden, von besonderer Relevanz für die öffentliche Gesundheit. Die nahe Verwandtschaft mit humanen Echoviren und vor allem dem für Poliomyelitis verantwortlichen Polioviren lassen außerdem vermuten, dass ähnliche Fähigkeiten auch bei anderen Viren zu finden sind.
Humane Adenoviren in Amöben – Aufenthalt nur zum Schutz oder auch zur Vermehrung?
In ersten Versuchen an der School of Public Health der University of Alberta (Edmonton, Kanada) wiesen darauf hin, dass auch humane Adenoviren der Genotypen 40 und 41 dazu in der Lage zu sein scheinen, durch Phagozytose von aus dem Trinkwasserbiofilm extrahierten Amöben aufgenommen zu werden, die Verdauung durch den Amöbenwirt zu vermeiden und sich dann in ihnen einzunisten. Eine Theorie, die diesen Übertragungsweg vermutete, wurde schon vor einigen Jahren von Scheid u. Schwarzenberger (2012) formuliert. Sogar eine potenzielle Vermehrung der Viren im Inneren ihres Amöbenwirts wird vermutet, da die Rezeptoren auf der Oberfläche des Zellkerns bestimmter Amöben hohe Übereinstimmungen mit denen von Lungen-, Leber- und Nierenzellen haben, die durch Adenoviren vom Typ 40/41 befallenen werden (Scheid u. Schwarzenberger 2012).
Seitdem die von der Weltgesundheitsorganisation initiierte Impfung gegen das Rotavirus eine beträchtliche Immunität in der Weltbevölkerung erreicht hat, ist das Adenovirus der Hauptverursacher virusassoziierter gastrointestinaler Infektionen bei Kindern unter fünf Jahren und trägt die Verantwortung für eine massive Krankheitslast bei den Betroffenen und ihren Familien. Bei unzureichender Trinkwasserhygiene wird diesen Viren sogar ein beträchtlicher Teil der mit dem Trinkwasser in Verbindung gebrachten Kindersterblichkeit in Subsahara-Afrika und Südostasien (Khanal et al. 2018) zugeschrieben. Ihre Einnistung in Amöben und die damit verbundene Erhöhung der Persistenz gegenüber Desinfektion ist somit – wie für andere nosokomiale Erreger – nicht zu unterschätzen.
Interessenkonflikt: Der Erstautor und seine Koautorin geben an, dass keine Interessenkonflikte vorliegen.
Literatur
Águila-Arcos S, Álvarez-Rodríguez I, Garaiyurrebaso O, Garbisu C, Grohmann E, Alkorta I: Biofilm-Forming Clinical Staphylococcus Isolates Harbor Horizontal Transfer and Antibiotic Resistance Genes. Front Microbiol 2017; 8: 2018–2018.
Atanasova ND, Dey R, Scott C, Li Q, Pang X-L, Ashbolt NJ: Persistence of infectious Enterovirus within free-living amoebae – A novel waterborne risk pathway? Water Res 2018; 144: 204–214.
Beauté J: Legionnaires’ disease in Europe, 2011 to 2015. Eurosurveillance 2017; 22.
Di Pippo F, Di Gregorio L, Congestri R, Tandoi V, Rossetti S: Biofilm growth and control in cooling water industrial systems. Fems Microbiol Ecol 2018; 94.
Fish KE, Osborn AM, Boxall J: Characterising and understanding the impact of microbial biofilms and the extracellular polymeric substance (EPS) matrix in drinking water distribution systems. Environ Sci Water Res Technol 2016; 2: 614–630.
Flemming H-C, Wingender J: The biofilm matrix.
Nat Rev Microbiol 2010; 8: 623–633.
Hayes-Phillips D, Bentham R, Ross K, Whiley H: Factors influencing legionella contamination of domestic household showers. Pathogens 2019; 8: 27.
ISO: Water quality – Detection and quantification of Legionella spp. and/or Legionella pneumophila by concentration and genic amplification by quantitative polymerase chain reaction (qPCR). ISO, 2019.
Kanamori H, Weber DJ, Rutala WA: Healthcare outbreaks associated with a water reservoir and infection prevention strategies. Clin Infect Dis 2016; 62: 1423–1435.
Khanal S, Ghimire P, Dhamoon AS: The repertoire of adenovirus in human disease: the innocuous to the deadly. Biomedicines 2018; 6: 30.
Maisa A, Brockmann A, Renken F, Lück C, Pleischl S, Exner M, Daniels-Haardt I, Jurke A: Epidemiological investigation and case–control study: a Legionnaires’ disease outbreak associated with cooling towers in Warstein, Germany, August–September 2013. Eurosurveillance 2015; 20: 30064.
Muchesa P, Leifels M, Jurzik L, Barnard TG, Bartie C: Detection of amoeba-associated Legionella pneumophila in hospital water networks of Johannesburg. S Afr J Infect Dis 2018; 33: 72–75.
Muchesa P, Leifels M, Jurzik L, Hoorzook KB, Barnard TG, Bartie C: Coexistence of free-living amoebae and bacteria in selected South African hospital water distribution systems. Parasitol Res 2017; 116: 155–165.
Muñoz Egea MC, Ji P, Pruden A, Falkinham III JO: Inhibition of Adherence of Mycobacterium avium to Plumbing Surface Biofilms of Methylobacterium spp. Pathogens 2017; 6: 42.
Raoult D, Scola B, Birtles R: The discovery and characterization of mimivirus, the largest known virus and putative pneumonia agent. Clin Infect Dis 2007; 45: 95–102.
Scheid P, Schwarzenberger R: Acanthamoeba spp. as vehicle and reservoir of adenoviruses. Parasitol Res 2012; 111: 479–485.
Soto-Giron MJ, Rodriguez-R LM, Luo C, Elk M, Ryu H, Hoelle J, Santo Domingo JW, Konstantinidis KT: Biofilms on Hospital Shower Hoses: Characterization and Implications for Nosocomial Infections. Appl Environ Microb 2016; 82: 2872–2883.
Stout J, Vickers R, Yu V, Shonnard J: Potable water supply as the hospital reservoir for pittsburgh pneumonia agent. Lancet 1982; 319: 471–472.
TrinkwV – Verordnung über die Qualität von Wasser für den menschlichen Gebrauch, Bundesrat (Hrsg.), 2019.
Voigt AM, Faerber HA, Wilbring G, Skutlarek D, Felder C, Mahn R, Wolf D, Brossart P, Hornung T, Engelhart S, Exner M, Schmithausen RM: The occurrence of antimicrobial substances in toilet, sink and shower drainpipes of clinical units: A neglected source of antibiotic residues. Int J Hyg Envir Heal 2019; 222: 455–467.
Wang H, Bédard E, Prévost M, Camper AK, Hill VR, Pruden A: Methodological approaches for monitoring opportunistic pathogens in premise plumbing:
A review. Water Res 2017; 117: 68-86.
Weitere Infos
Verordnung über Verdunstungskühlanlagen, Kühltürme und Nassabscheider – 42. BImSchV
https://www.gesetze-im-internet.de/bimschv_42/
TrinkwV – Verordnung über die Qualität von Wasser für den menschlichen Gebrauch. Bundesrat (Hrsg.), 2019.
https://www.bundesrat.de/SharedDocs/drucksachen/2019/0501-0600/590-19.p…

Foto: JohannesBluemel Photography / Getty Images
Koautorin
An der Erstellung des Beitrags beteiligt war Frau Selin Temizel (MPH), Fachärztin für Hygiene und Umweltmedizin, Stabstelle Hygiene und Umweltmedizin, Universitätsklinikum Augsburg