Synergistische Effekte nach Mehrfachexposition – Bewertung für die Regulation
Zielstellung: Das Problem der Bewertung von Gesundheitsrisiken nach Mehrfachexpositionen hat in den letzten Jahren an Bedeutung gewonnen. Die Gefahrstoffverordnung und die entsprechende Technische Regel für Gefahrstoffe sehen bislang keine generelle Regelung für die Bewertung des Gesamtrisikos bei Exposition gegenüber mehreren krebserzeugenden Stoffe vor. Bisherige Vorschläge zur Berücksichtigung von Mehrfachexpositionen, wenn keine konkreten Risikozahlen zu der Kombination dieser Karzinogene aus humanbasierten Studien vorliegen, haben noch nicht zu einer verbindlichen Regelung geführt. Im vorliegenden Beitrag stellen wir die üblichen Risikobegriffe und die Konzepte von Interaktion aus epidemiologischer und toxikologischer Sicht dar und diskutieren Stärken und Limitationen einer einfachen Summenbewertung beim Zusammenwirken mehrerer Noxen.
Methode: Um den aktuellen Kenntnisstand explorativ darzustellen, wurde eine selektive Literaturübersicht durchgeführt und vor dem Hintergrund der aktuellen Diskussionslage bewertet.
Ergebnis: Das Modell einer einfachen Summation der Einzelrisiken stellt aufgrund theoretischer und formaler Voraussetzungen keinen zielführenden Ansatz für die Bewertung krebserzeugender Mischexpositionen im Rahmen der arbeitsmedizinischen Prävention dar.
Schlussfolgerung: Eine zuverlässige Bewertung der Effekte zweier (oder mehrerer) Substanzen ist durch empirische Studien im Einzelfall zu belegen.
Schlüsselwörter: Effektmodifikation – Interaktion – Mischexposition – Summation – Synkanzerogenese
Synergetic effects after exposure to multiple hazardous substances – evaluation for regulation
Objective: The problem of evaluating health risks due to exposure to multiple hazardous substances has gained much significance in recent years. Neither the German Ordinance on Hazardous Substances (GefStoffV) nor associated technical rules for hazardous materials (TRGS) provide a general rule for considering the overall effects of simultaneous exposure to carcinogenic substances. Suggestions on how to take into account multiple exposures in the absence of specific data from epidemiological studies on the combination of these carcinogens have not yet led to a generally binding regulation.
This article presents common definitions of risk and concepts of interaction from an epidemiological and toxicological perspective and discusses the strengths and limitations of a simple summation approach to the interaction of multiple noxae.
Method: A selective literature review was conducted and evaluated in light of the current stage of the debate in order to present the current state of knowledge in an explorative way.
Result: The model of a simple summation of single risks does not represent a useful approach for the evaluation of mixed exposures to carcinogenic substances in the framework of preventive occupational medicine.
Conclusion: A sound evaluation of the effects after exposure to two (or more) agents needs to be proven in empirical studies in each individual case
Keywords: effect modification – interaction – mixed exposure – summation – co-carcinogenesis
Einleitung
In den letzten Jahren hat zunehmend das Problem der Bewertung von Gesundheitsrisiken nach Mehrfachexpositionen („Mischexpositionen“) an Bedeutung gewonnen. Die Gefahrstoffverordnung und die entsprechende Technische Regel für Gefahrstoffe (TRGS 910; Kapitel 4, Nr. 4) sehen bislang jedoch keine generelle Regelung für die Bewertung des Gesamtrisikos bei Exposition gegenüber mehreren krebserzeugenden Stoffe vor (Bundesanstalt für Arbeitsschutz und Arbeitsmedizin 2014).
Derzeit gilt, dass bei Exposition gegenüber mehreren Kanzerogenen aufgrund fehlender wissenschaftlicher Erkenntnisse eine Einzelstoffbewertung erfolgt. Ab 2018 soll aber auch der Aspekt der Kombinationswirkung in der entsprechenden Technischen Regel (TRGS 910) erfasst sein (Bundesanstalt für Arbeitsschutz und Arbeitsmedizin 2014). Auch im Berufskrankheitenrecht gibt es bislang keine Generalklausel für die Beurteilung gleichzeitig einwirkender Kanzerogene, obwohl dieses in der Literatur empfohlen wurde (Becker 2015).
Die Etablierung eines Konzepts für das Zusammenwirken mehrerer karzinogener Substanzen würde eine grundsätzliche Neuausrichtung und Erhöhung der Komplexität des bisherigen maßnahmenbasierten Risikokonzepts bedeuten. Aus pragmatischer Sicht hat der Unterausschuss 1 des Ausschusses für Gefahrstoffe (AGS) deshalb kürzlich diskutiert, für die Bestimmung des Gesamtrisikos mehrerer Kanzerogene eine Addition der Einzelrisiken vorzunehmen. Bei einfacher Summation von Risiken stellt bei Abwesenheit synergistischer Effekte die Summe der Einzeleffekte jedoch eine Maximalgrenze für das gemeinsame Risiko dar (Morfeld u. Spallek 2015).
Fragestellung
Ziel dieser Arbeit ist es, die verschiedenen Diskussionsaspekte zur Abschätzung des gemeinsamen Effekts von Mehrfachexpositionen zu erläutern. Weiterhin soll geprüft werden, ob der pragmatische Vorschlag des AGS, eine einfache Summenbewertung bei Exposition gegenüber mehreren Kanzerogenen vorzunehmen, als Bewertungskonzept anwendbar ist, wenn keine konkreten Risikozahlen zur Kombination dieser Karzinogene aus humanbasierten Studien vorliegen.
Zunächst möchten wir verschiedene, in der Epidemiologie übliche Risikobegriffe vorstellen und Methoden beschreiben, mit denen Expositions-Risiko-Beziehungen quantifiziert werden können, bevor wir uns eingehend den verschiedenen Konzepten zur Ermittlung von Effektmodifikationen widmen.
Epidemiologische Studientypen und Maßzahlen
In der Epidemiologie werden vorrangig die folgenden beobachtenden Studiendesigns angewandt.
Kohortenstudie
In Kohortenstudien werden gegenüber einem bestimmten Stoff exponierte und nicht-exponierte und zu Beginn der Studie mit Bezug auf die Zielerkrankung gesunde Personen auf das Neuauftreten verschiedener Erkrankungen untersucht. Die untersuchten Zielparameter in einer Kohortenstudie sind Inzidenz- bzw. Mortalitätsraten, die mit Raten aus anderen Untersuchungspopulationen oder Subgruppen verglichen werden (Miller et al. 2005). Das Verhältnis von zwei Inzidenzen ist das relative Risiko (RR), das bei einem Wert über 1 eine prozentuale Risikoerhöhung für Exponierte im Vergleich zu Nicht-Exponierten anzeigt, während ein RR kleiner eins entsprechend eine Risikominderung quantifiziert.
Fall-Kontroll-Studie
In Fall-Kontroll-Studien wird eine definierte Anzahl von Erkrankten („Fällen“) mit einer Stichprobe von nicht erkrankten Personen („Kontrollen“) retrospektiv auf das Vorliegen bestimmter Expositionen verglichen. Im idealen Fall sind die Fälle für den Untersuchungszeitraum neu erkrankt und vollständig und die Kontrollen stellen eine zufällige Stichprobe nicht erkrankter Personen aus derselben Bezugspopulation dar, aus der die Fälle stammen.
Fall-Kontroll-Studien können in eine Kohorte eingebettet sein, das heißt, alle Fälle aus einer Kohorte werden mit einer zufälligen Stichprobe der zum Zeitpunkt der Falldiagnose nicht erkrankten Kontrollpersonen aus derselben Kohorte verglichen („Incidence-Density-Sampling“), wodurch die oben genannten idealen Bedingungen erfüllt werden (Breslow 2005).
Da in Fall-Kontroll-Studien keine Inzidenzen berechnet werden können, ist in Fall-Kontroll-Studien die Odds Ratio (Chancenverhältnis) der Zielparameter der Wahl. Die Odds Ratio (OR) vergleicht die Chance einer erkrankten Person, exponiert zu sein, mit der Chance der Exposition für eine nicht erkrankte Person (Breslow 2005). Die Odds oder Chance ist definiert als die Wahrscheinlichkeit P für das Auftreten eines Ereignisses geteilt durch die Gegenwahrscheinlichkeit 1–P .
Querschnittstudie (Prävalenzstudie)
In einer Querschnittstudie werden Expositions- und Erkrankungsstatus der Studienteilnehmer gleichzeitig erhoben. Für dieses einfache und schnell durchzuführende Studiendesign fehlt also typischerweise der zeitliche Bezug zwischen Exposition und Erkrankung, wie er in Kohorten- und inzidenten Fall-Kontroll-Studien hergestellt werden kann. Deshalb kann in Querschnittstudien nur die Prävalenz einer Erkrankung bzw. einer Exposition berechnet werden (Parkin u. Bray 2005). Relative Vergleichszahlen in Querschnittstudien sind die Prävalenzratio oder die Prävalenz-Odds Ratio (Behrens et al. 2004).
Interaktion – Epidemiologischer Ansatz
In der Epidemiologie und Statistik wird unter Interaktion oder Effektmodifikation verstanden, dass der Effekt eines Risikofaktors sich unterscheidet, wenn nach einem zweiten Risikofaktor stratifiziert wird (Rothman 1986; Kap. 12). Im Gegensatz zum Confounding ist Effektmodifikation nicht eine Störgröße, die durch geeignete statistische Verfahren kontrolliert werden kann. Effektmodifikation kann dabei sowohl im Sinne einer verstärkenden Wirkung der Einzelrisiken (Synergismus) als auch einer Abschwächung (Antagonismus) auftreten.
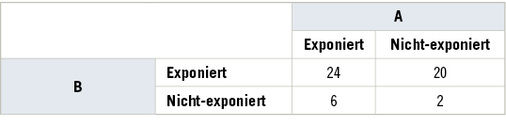
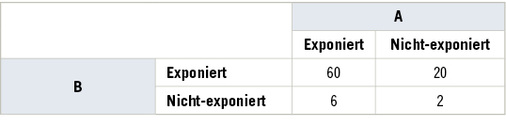
Aus statistischer Sicht unterscheidet man die Effektmodifikation auf einer additiven bzw. einer multiplikativen Skala. Eine über- oder unteradditive Effektmodifikation ist gegeben, wenn das gemeinsame Risiko AB die Summe der Einzelrisiken A und B über- oder unterschreitet. Ist das Zusammenwirken beider Expositionen dagegen größer (oder kleiner) als durch Multiplikation der Einzelrisiken erwartet werden kann, ist die Effektmodifikation über- bzw. untermultiplikativer Natur (Knol et al. 2007). Die Tabellen 1 und 2 zeigen das erwartete Zusammenwirken zweier Risikofaktoren A und B auf die Erkrankungsrate für Krebs im additiven und multiplikativen Modell.
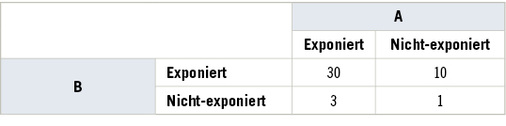
Die Zusammenhänge lassen sich auch auf Basis relativer Risiken darstellen ( Tabelle 3 ).
Aus biologischer Sicht ist Interaktion dagegen als ein natürliches biologisches Phänomen anzusehen. Sie liegt dann vor, wenn zwei Risikofaktoren kausal für eine Erkrankung sind und beide Faktoren erforderlich sind, die Erkrankung auszulösen. Unabhängigkeit zweier Krankheitsursachen oder Abwesenheit von Interaktion wird unterstellt, wenn keine gegenseitige Beeinflussung des Outcomes (z.B. bei Wirkung an verschiedenen Zielorganen) vorliegt (Rothman 1974).
Rothman (1986, Kap. 15) hat auf die Ambiguität dieses Konzepts hingewiesen. Betrachtet man die oben stehende Tabelle 2 zum Zusammenwirken von zwei Risikofaktoren auf die Inzidenz einer Krebserkrankung, so wird deutlich, dass sich je nach Anwendung des additiven oder multiplikativen Modells der Effektmodifikation widersprechende Schlüsse ziehen lassen:
Bei Betrachtung der Risikodifferenz für Faktor A bei gegenüber B exponierten Personen beobachten wir ein Risiko von 60 weniger 20 Fälle, also 40*10 –5 Personenjahre (PJ), während für nicht gegenüber B exponierten Personen eine Differenz für A von 4*10 –5 PJ, also ein 10fach niedrigeres Risiko, beobachtet wird. Faktor A wäre im Rahmen eines additiven Modells ein starker synergistischer Effektmodifikator auf den Zusammenhang zwischen B und der Krebserkrankung. Betrachten wir dagegen die multiplikative Skala, beobachten wir eine Ratio von 3 sowohl für gegenüber B als auch nicht gegenüber B exponierte Personen, also eine Abwesenheit von Effektmodifikation.
Das gleichzeitige Vorliegen von Synergismus und fehlender Interaktion nach rein statistischen Kriterien erscheint somit als ein Ansatz, der der epidemiologischen Annahme von Kausalität nicht gerecht wird.
Rothman (2002; Kap. 9) schlägt deshalb den Begriff „Effektmaßmodifikation („effect-measure modification“) vor, um die Abhängigkeit der Messung von Interaktion von der Modellierung zu betonen. Weiterhin empfiehlt er, sich bei der Betrachtung von Effektmodifikation am biologischen Modell zu orientieren. Wie oben erwähnt, beinhaltet dieses Konzept die Trennung des Gesamtrisikos in einzelne ursächliche Komponenten. Der Einfluss jeder Einzelkomponente (z.B. einer Exposition) lässt sich aus der Tabelle durch Abziehen des Basisrisikos für Nichtexponierte schätzen. Laut Rothman ist somit das additive Modell der Regelfall der Effektmodifikation und sollte auch in der Datenanalyse berücksichtigt werden. Hiermit trägt er auch dem Konzept der mechanistischen Interaktion Rechnung, wie er in der Toxikologie verwendet wird (s. Abschnitt 4).
In unserem Beispiel des additiven Zusammenwirkens beträgt die Inzidenzrate für B allein 20*10 –5 PJ und für A 6*10 –5 PJ, während das Basisrisiko (keine der beiden Expositionen) mit einer Inzidenzrate von 2*10 –5 PJ assoziiert ist. Für Personen, die gegenüber beiden Faktoren exponiert sind, würde man eine Inzidenz von (20*10 –5 + 6*10 –5 – 2*10 –5 = 24*10 –5 PJ erwarten (s. Tabelle 1), die deutlich unter den beobachteten 60*10 –5 PJ liegt. Auf einer additiven Skala liegt in Tabelle 2 also Effektmodifikation im Sinne eines Synergismus vor.
Aktuelle Überlegungen
Morfeld (2006) hat das Konzept von Rothman weiterentwickelt und adressiert das inhaltliche Problem, dass Kausalität mit einfachen Risikostatistiken nur schwer abzubilden ist. Eine Person, die an Krebs verstirbt, kann nicht an einer anderen Ursache versterben (kontrafaktische Kausaltheorie) und bei ausreichend langem Follow-up verstirbt jede Person in einer Kohorte, so dass dann das RR beim Vergleich exponierter und nicht-exponierter Personen stets 1 beträgt.
Rothman, wie auch Morfeld, weisen der Interaktion als kombiniertem Effekt zweier Einzeleffekte eine eigene Form von Kausalität zu. Unter der Prämisse, dass beim Vorliegen eines Synergismus der gemeinsame Effekt größer als jeder Einzeleffekt sein muss, liegt eindeutiger Synergismus laut Morfeld vor allem dann vor, wenn „jeder Einzeleffekt neutral ist, aber nicht der gemeinsame Effekt“ (Morfeld 2006, S. 237). Obwohl diese Definition von Synergismus unabhängig von der Annahme einer Additivität oder Multiplikativität der Einzeleffekte ist, stellt sie für die Praxis doch eher einen theoretischen Sonderfall dar, da bei der Bewertung von Gesundheitsrisiken meist von bekannten Gefahrstoffen ausgegangen wird, die einzeln für sich einen unabhängigen Risikofaktor darstellen und deren gemeinsamer Effekt abgeschätzt werden soll.
Für die Beurteilung des Effekts von mehreren gemeinsam einwirkenden Expositionen stellen Morfeld und Spallek (2015) 16 Typen vor, die allen möglichen Kombinationen von zwei binären Expositionen mit einer Erkrankung („Respons“) entsprechen. Nach Ausschluss der 10 Responstypen mit präventiver Wirkung der Exposition, bleiben sechs Typen, darunter eine, die der Definition von Synergismus entspricht, und die mit dem erhöhten Risiko einer Erkrankung assoziiert sind. Die Autoren stellen fest, dass die Summe der relativen Häufigkeiten der Responstypen maximal 100 % betragen kann. Hieraus folgt, dass
- das gemeinsame Exzessrisiko mindestens so groß wie jedes der Einzelrisiken ist,
- ein gemeinsames Exzessrisiko kleiner als die Summe der Einzelrisiken ist und
- eine Additivität bei Abwesenheit von Synergismus das Maximum des Zusammenwirkens von Einzelrisiken darstellt sowie
- die Summe der Einzelrisiken auch Unteradditivität aufweisen kann, da der kombinierten Wirkung (Synergismus) eine eigenständige kausale Komponente zukommt. Letzteres gilt auch, wenn präventive Wirkungen ausgeschlossen werden können. Wenn man unterstellt, dass sich die gesamte Eintrittswahrscheinlichkeit einer Erkrankung aus den Einzelrisiken A und B sowie der Wechselwirkung von A und B zusammensetzt, kann man vor allem unter letzterer Voraussetzung und bei Fehlen einer synergistischen Wechselwirkung eine einfache Addition der Einzelrisiken deshalb nicht mehr unterstellen (Morfeld u. Spallek 2015).
Interaktion – Toxikologischer Ansatz
Die genannten Überlegungen zum gemeinsamen Einwirkungen verschiedener Expositionen treffen auch auf toxikologische Daten zu, jedoch sind für toxikologische oder tierexperimentelle Daten Besonderheiten zu bedenken, die diese von Beobachtungsstudien unterscheiden.
Ein entscheidender Unterschied zu epidemiologischen Studien liegt in ihrem experimentellen Design. Anders als in der realen Arbeitswelt wird in Experimenten der Einfluss nur einer oder einiger weniger Chemikalien auf die Krebshäufigkeit untersucht. Durch die Auswahl vergleichbarer Versuchstiere entfällt die Berücksichtigung von Störfaktoren, während epidemiologische Studien für eine Vielzahl von Confoundern und Begleitexpositionen kontrollieren müssen.
In tierexperimentellen Studien liegen die verabreichten Dosierungen zudem deutlich über den in der Arbeitswelt üblichen Expositionskonzentrationen. Am Studienende werden üblicherweise alle Versuchstiere getötet. Dieses mag dazu führen, dass in experimentellen Studien auch mehrere Tumoren in unterschiedlichen Organen beobachtet werden können, so dass die Gesamtkrebsinzidenz dann >100 % betragen kann. Die Übertragbarkeit von toxikologischen Experimenten auf den Menschen in quantitativer Hinsicht ist deshalb schwierig (Schlüter 2006). In qualitativer Hinsicht mögen tierexperimentelle Daten jedoch auch Mechanismen der (Syn)Kanzerogenese erkennen lassen, die für den Menschen relevant sind.
Eine rein toxikologisch-mechanistische Betrachtung, wobei eine genotoxisch wirkende Substanz einen Zellschaden initiiert, um dann in einer (zweiten begleitenden oder nachfolgenden) Exposition gegenüber einem weiteren Initiator oder Promotor Krebs zu erzeugen (Greim 2006), ist eine Modellannahme, auch wenn eine einfache Addition des toxischen Effekts auf die Erbinformation mechanistisch möglicherweise gerechtfertigt ist (Hallier 2013). Die einfache Untersuchung von gentoxischen Noxen ist dabei nicht mit der Inzidenz einer Krebserkrankung gleichzusetzen, die aus einer hochkomplexen Interaktion verschiedener ineinander greifender Mechanismen zur Entstehung einer Krebszelle resultiert (Hanahan u. Weinberg 2011).
Ansätze zur Analyse von Interaktionen
Da in den meisten Studien für Confounder adjustiert wird, genügt eine einfache Beurteilung von Effektmodifikation anhand einer 2 × 2-Felder-Tafel mit binärem Expositions- und Erkrankungsstatus meistens nicht. Das Vorliegen einer Effektmodifikation wird i.d.R. durch Regressionsmodelle untersucht.
Durch Stratifikation der Ergebnisse nach dem modifizierenden Faktor ist zunächst eine qualitative Beurteilung der Interaktion möglich.
Die am weitesten verbreitete analytische Herangehensweise, den Einfluss von Interaktionen auf das Erkrankungsrisiko zu testen, ist vermutlich, einen Produktterm aus den beiden Expositionen in das Regressionsmodell zu integrieren. Die Interpretation dieses Terms hängt dabei entscheidend von der Wahl des Regressionsmodells ab. In einer linearen Regression bedeutet der Regressionskoeffizient des Produktterms eine Abweichung von der additiven Skala, während im Kontext der in der Epidemiologie üblichen logarithmierten Modelle wie der logistischen oder Cox-Regression die Multiplikativität zweier Einzelrisiken modelliert wird, der Regressionskoeffizient des Produktterms also eine Abweichung von Multiplikativität anzeigt (Knol et al. 2007).
Um die „biologische Interaktion“ untersuchen zu können, muss die Untersuchung von Effektmodifikation auf einer additiven Skala jedoch auch im Rahmen von logarithmierten Modellen möglich sein. Zur Berechnung hat Rothman verschiedene Indizes entwickelt, von denen das RERI („relative excess risk“) am häufigsten verwendet wird. RERI ist ein quantitatives Maß zur Bestimmung der Stärke einer Interaktion und gibt an, um welchen Faktor das relative Risiko bei Vorliegen einer Interaktion das Risiko übersteigt, wenn keine Interaktion der beiden Expositionsfaktoren vorliegen würde. Alternativ kann es also interpretiert werden als das Exzessrisiko durch Interaktion relativ zum Risiko der Nichtexponierten. Es wird berechnet als

wobei RR(AB) das relative Risiko bei Exposition gegenüber beiden Noxen, RR(AB) und RR(AB) das RR bei Exposition ausschließlich gegenüber Noxe A bzw. B bezeichnen. RERI=0 zeigt dann die Abwesenheit einer Interaktion auf einer additiven Skala an, Werte >0 einen Synergismus und negative Werte einen Antagonismus (Rothman 1986; Kap. 15). Aus Tabelle 3 ergeben sich relative Risiken von 10 für Faktor B, von 3 für A und von 30 für die kombinierte Exposition, also

Das relative Risiko bei Zusammenwirken übersteigt somit den erwarteten additiven Effekt (RR=12) um den Wert 18 und ist somit Folge des Synergismus dieser beiden Faktoren.
Rothmans Synergy Index S (Rothman 1974; Rothman 1986, Kap. 15) gibt das Verhältnis des gemeinsamen Effekts zweier Expositionen im Vergleich zu ihren Einzeleffekten unter Unabhängigkeit an und wird berechnet als
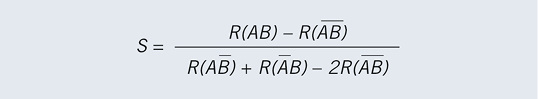
mit R als absolutem Risiko oder auf Basis von relativen Risiken
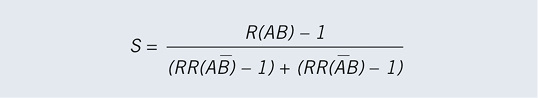
wobei S bei Additivität genau 1 beträgt und Werte >1 bzw.
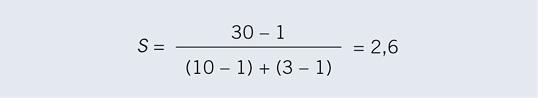
d.h., dass der gemeinsame Effekt von A und B 2,6fach höher liegt als die Summe der (unabhängigen) Einzeleffekte.
Der attributable Anteil („attributable proportion“, AP) an einer Erkrankung, der auf die Interaktion zweier Expositionen zurückgeführt werden kann, berechnet sich analog als

Also

d.h. 60 % der Krebsinzidenz durch Faktoren A und B wäre auf die Interaktion dieser beiden Risikofaktoren zurückzuführen.
Die Möglichkeit, Konfidenzintervalle zu berechnen, ist für alle vorgestellten Maße gegeben (u.a. Hosmer u. Lemeshow 1992).
Für die Verwendung der genannten Maßzahlen sind jedoch bestimmte Einschränkungen zu berücksichtigen, da die drei Maßzahlen unter gewissen Voraussetzungen Inkonsistenzen aufweisen können: So ist zu bedenken, dass diese sich nur zur Berechnung der Effektmodifikation von Risikofaktoren eignen. Wirken einer oder mehrere Faktoren präventiv, muss eine Umkodierung der Faktoren mit Neudefinition der Referenzkategorie durchgeführt werden, um inkonsistente Ergebnisse zu vermeiden (Knol et al. 2011). Darüber hinaus kann in Fall-Kontroll-Studien die Hinzunahme von weiteren Kofaktoren zu einer fehlerhaften Spezifikation des logistischen Modells führen, die jedoch durch inverse Gewichtung der im logistischen Modell vorhergesagten Wahrscheinlichkeit für die Kofaktoren vermieden werden kann (VanderWeele u. Vansteelandt 2014).
Ableitung von Expositions-Risiko-Beziehungen in der Regulation zur Grenzwertfestlegung bzw. Ermittlung von Berufskrankheitsrisiken
Zur Abschätzung von Berufserkrankungsrisiken bzw. der Ermittlung von Grenzwerten wird in der Regulation in der Regel vom Exzessrisiko ausgegangen (Bundesanstalt für Arbeitsschutz und Arbeitsmedizin 2014). Das Exzessrisiko bezeichnet die über das Hintergrundrisiko hinausgehende zusätzliche Wahrscheinlichkeit für das Auftreten einer Erkrankung innerhalb eines bestimmten Zeitraums nach Exposition gegenüber einem Risikofaktor. Häufig wird in diesem Kontext das über das Hintergrundrisiko hinausgehende durch eine bestimmte Exposition bedingte Lebenszeitrisiko verstanden. Die Lebenszeitspanne wird dabei auf ein bestimmtes Lebensalter (zum Beispiel 70 oder 90 Jahre) festgesetzt (Becher u. Steindorf 1993).
Das Exzessrisiko kann darüber hinaus als Unit Risk ausgedrückt werden, wobei das Unit Risk das Exzessrisiko zu erkranken angibt, wenn eine Person über das Arbeitsleben dauerhaft gegenüber einer konstanten Dosis eines Schadstoffs exponiert war. In der Regel erfolgt hier eine Abschätzung der lebenslang kumulierten Exposition als Produkt aus der zeitlichen Dauer der Einwirkung in Jahren und ihrer Intensität (Becher u. Steindorf 1993). Ein lebenslanges krebsbedingtes Unit Risk von 3 × 10–6 entspricht also einer geschätzten Anzahl von 3 zusätzlichen Erkrankungsfällen pro einer Million Personen, die über 40 Arbeitsjahre gegenüber einer bestimmten Konzentration eines Gefahrstoffes exponiert waren.
In der Regulation wird das Erkrankungsrisiko üblicherweise in einer linearen Regressionsanalyse als Funktion des kumulierten Expositionswerts modelliert, die einen linearen Anstieg des Risikos pro Dosiseinheit impliziert. Hierdurch wird dann durch Extrapolation in den Hoch- und Niedrigrisikobereich das Exzessrisiko einer konstanten Exposition über das gesamte (Arbeits-)Leben geschätzt, allerdings in Bereiche, die nicht datengestützt sind. Einschränkend ist bei dieser Methode zu bedenken, dass durch Verwendung des Unit Risks eine konstante Expositionsintensität über den Beobachtungszeitraum (z.B. die Dauer des Arbeitslebens von 40 Jahren) und damit auch ein konstantes Erkrankungsrisiko unterstellt wird (Behrens et al. 2009). Erschwerend kommt hinzu, dass Expositionsrisiken im Niedrigdosisbereich häufig einer links gekrümmten Dosis-Wirkungs-Beziehung folgen, so dass es bei linearer Extrapolation in diesen Bereich zu einer Unterschätzung der Risiken kommt (Timm et al. 2003). Weiterhin ist mit diesem Vorgehen kaum möglich, eine Aussage über einen von der Linearität abweichenden Kurvenverlauf zu treffen. Dennoch hat sich die Annahme einer linearen Beziehung in der Regulation als Konvention durchgesetzt.
Bisherige Vorschläge zur Ermittlung des Zusammenwirkens mehrerer krebserzeugender Substanzen bauen auf dem oben beschrieben Vorgehen zur Ermittlung von Einzelrisiken auf. So ist im AGS ein vereinfachtes Schema der Addition von Einzelrisiken nach einem Ampelmodell (das der Definition von Akzeptanz- und Toleranzrisiko folgt) diskutiert worden. Die Überlegungen konzentrieren sich hierbei auf das Zusammenwirken von Gefahrstoffen mittleren Risikos („Gelbbereich“), da die Ableitung von Risiken im Niedrigdosisbereich mit besonderen Herausforderungen verbunden ist (s. oben).
Diskussion der Ansätze zum Vorgehen bei Risikoabschätzung in Abwesenheit von Evidenz
Wenn konkrete Ergebnisse aus epidemiologischen Studien fehlen, wäre für die Einschätzung der arbeitsmedizinischen Prävention in der Praxis ein einfaches Modell zur Abschätzung des Gesamtrisikos natürlich wünschenswert (Groneberg 2015).
Es wurden deshalb verschiedene Ansatzpunkte vorgeschlagen, darunter die einfache Addition der Einzelrisiken, die Kontrolle einer einzelnen Noxe und eine parallele Kontrolle mehrerer Noxen (was dem heutigen Standardvorgehen entspricht, vgl. beispielsweise die unabhängige Kontrolle von hexavalentem Chrom (Cr(VI)) und Nickel in Schweißrauch (Deutsche Gesetzliche Unfallversicherung (DGUV) – Fachausschuss Metall- und Oberflächenbehandlung 2008).
Zu Recht ist darauf hingewiesen worden, dass der Effekt einer Reduktion beider Noxen stets kleiner ist als die Summe der Einzelkomponenten. Das bedeutet, dass selbst bei Vorliegen von Überadditivität zweier Exzessrisiken die Kontrolle einer Noxe ausreicht, um eine erhebliche Risikoreduktion zu erzielen (Panagiotou u. Wacholder 2014; Morfeld u. Spallek 2015). Leider fehlt unter diesen Voraussetzungen eine Quantifizierung des erzielbaren präventiven Effekts, der es ermöglichen würde, eine Aussage für konkrete betriebliche Präventionsmaßnahmen zu treffen. Beim Vorliegen klassischer Mischexpositionen kann es sogar ausreichend sein, für eine Leitkomponente zu kontrollieren, die nicht zwangsläufig selbst das ursächliche Karzinogen darstellen muss. So kann durch eine Reduktion des Schweißrauchs insgesamt auch eine Kontrolle der karzinogenen Einzelkomponenten (u.a. Partikel, Cr(VI) und Nickel) erzielt werden, da diese mitunter hoch korrelieren (Kendzia et al. 2013).
Der Vorteil eines einfachen Additionsmodells liegt sicherlich darin, dass eine Summation als Konvention für die Bewertung krebserzeugender Stoffe am Arbeitsplatz zu einer schnellen Beurteilung führt und zudem im Sinne des Arbeitsschutzes für die betroffenen Beschäftigten einen konservativen Ansatz darstellt. Bei Abwesenheit synergistischer Effekte stellt die Summe der Einzeleffekte jedoch eine Maximalgrenze für das gemeinsame Risiko dar (Morfeld u. Spallek 2015). Hieraus folgt, dass, selbst wenn keine antagonistischen Wirkungen auftreten, eine einfache Addition der Einzelrisiken das tatsächliche Gesamtrisiko tendenziell überschätzt.
Die Anwendung eines solchen Standardmodells stellt somit in erster Linie eine sozialpolitische Konvention dar, der kein konkreter wissenschaftlicher Bezug zugrunde liegt.
Die einfache konventionsbasierte Addition von Einzelrisiken stößt aber, auch aus praktischen Gründen, schnell an Grenzen.
Alle Überlegungen beziehen sich dabei bereits auf die vereinfachenden Annahmen, dass (1) gut begründete Einzelbewertungen der betrachteten Stoffe vorliegen, (2) keine Informationen über das Risiko zum Zusammenwirken dieser Substanzen bekannt sind und (3) dass die vorliegenden Daten der Einzeleffekte sich auf dasselbe Zielorgan beziehen. Weiterhin wird (4) vereinfachend von einer linearen Dosis-Wirkungs-Beziehung ausgegangen und von der Abwesenheit einer Wirkschwelle.
Zur Illustration nehmen wir folgendes Beispiel an: Zwei Gefahrstoffe X und Y treten am Arbeitsplatz mit einem Schichtmittelwert auf, der jeweils mit einem Krebsrisiko im mittleren Risikobereich unterhalb der Akzeptanzschwelle von 3*10 –4 assoziiert sind. Bei Summation der Risiken würde diese mit einem Gesamtrisiko von knapp 6*10 –4 aber deutlich überschritten.
Unter der Bedingung, dass alle Dosis-Wirkungs-Beziehungen streng linear sind, würde das bedeuten, dass bei Exposition gegenüber Substanzen nahe des Akzeptanzrisikos die Grenzwerte beider Einzelstoffe halbiert (oder entsprechend anders gewichtet) werden müssten. Unter Voraussetzung einer mehrfachen Exposition gegenüber drei Substanzen entspräche dieses einer Drittelung der Grenzwerte. Mit zunehmender Anzahl der untersuchten Expositionen ließe sich das Szenario immer weiter fortschreiben. Die gleiche Problematik ergibt sich dabei auch bei Anwendung des Bewertungsindex der TRGS 402, Nr. 5.2.1 für inhalative Gefahrstoffe, auch wenn hier nicht von absoluten Risiken i.S. der Akzeptanz bzw. Toleranzkonzentration ausgegangen wird.
Theoretisch könnte sich bei einer einfachen Addition auch die Situation ergeben, dass sich mehrere, in geringer Dosis nicht kanzerogene Substanzen, zu einem Risiko jenseits der Akzeptanzschwelle aufsummieren. Eine vergleichbare Situation ist auch für alle Substanzen gegeben, die im mittleren Risikobereich der Akzeptanzkonzentration keinen linearen Verlauf der Expositions-Wirkungs-Beziehung aufweisen.
Ein derartiges Vorgehen erscheint wenig faktenbasiert und widerspricht darüber hinaus der Erkenntnis, dass der Effekt einer gleichzeitigen Reduktion mehrerer Noxen stets kleiner ist als die Summe einer unabhängigen Reduktion der Einzeleffekte (Panagiotou u. Wacholder 2014).
Darüber hinaus besteht die Schwierigkeit, dass Akzeptanz- und Toleranzrisiko sich auf eine vermutete Gesamtkrebswahrscheinlichkeit beziehen, bei Beurteilung von Kombinationseffekten jedoch eher von einer organspezifischen Erkrankung ausgegangen werden muss. Bei bestimmten Tumoren (z.B. Lungenkrebs bei Männern) liegt das altersstandardisierte Basisrisiko in der Allgemeinbevölkerung bereits bei 6/10.000 Personen, also über der Akzeptanzschwelle (Robert Koch-Institut [RKI] und Gesellschaft der Epidemiologischen Krebsregister in Deutschland e.V. [GEKID] 2015).
Schlussfolgerungen
Die verlässliche, retrospektive Abschätzung von beruflichen Risiken in epidemiologischen Studien stellt generell eine große Herausforderung dar. Die Beurteilung des Risikos von Mischexpositionen für die Regulation ist dabei besonders schwierig und es liegen nur wenig belastbare Daten zu gemeinsamen Effekten verschiedener Karzinogene vor.
Offene und in der Epidemiologie bisher kaum diskutierte Fragen beziehen sich auf die Abgrenzung echter Mischexpositionen von zeitlich unabhängigen Expositionsszenarien, wenn wie häufig in der Epidemiologie kumulative Expositionsmaße, die eine konstante Exposition über das gesamte Berufsleben unterstellen, verwendet werden. Wenn Gefahrstoffe in unterschiedlichen Konzentrationseinheiten (z.B. mg/m 3 oder ppm) gemessen werden, lassen sich diese nicht direkt hinsichtlich einer gemeinsamen Dosis-Wirkungs-Beziehung vergleichen. Auch kann die Äquitoxizität zweier Karzinogene nicht automatisch unterstellt werden: aus der Epidemiologie sind Beispiele bekannt, dass bei Exposition gegenüber einem starken Karzinogen (z.B. Tabakrauch) eine zusätzliche Exposition (z.B. gegenüber Asbest) nur noch ein geringes Zusatzrisiko ausmachen kann (Olsson et al. 2017). Wenn eine parallele Exposition hoch korrelierender Stoffe (wie z.B. hexavalentes Chrom und Nickel in Schweißrauch) auftreten, erfasst der Risikoschätzer für einen Stoff auch den Teil des Risikos des anderen Stoffs, so dass sich insgesamt auch kein wesentlich höheres Gesamtrisiko ergeben kann.
Weiterhin ist zu beachten, dass sich die oben formulierten Überlegungen auf binäre Expositionsstatus beziehen, während in der Arbeitswelt meist kontinuierliche Expositionsdaten wie Messwerte vorliegen. Knol et al. (2007) haben die oben genannten Überlegungen zur Ermittlung von Interaktionen auf die Modellierung kontinuierlicher Expositionen im Rahmen einer logistischen Regression übertragen. Auch Morfeld und Spallek haben kürzlich die Vereinbarkeit ihrer Überlegungen bei intervallskalierten Expositionsdaten demonstriert (Morfeld u. Spallek 2016).
Zusammenfassend stellen wir fest, dass in Abwesenheit ausreichender Evidenz aus empirischen Studien keines der vorgeschlagenen Bewertungsschemata ausreichend ist, um das Zusammenwirkern einer oder mehrerer Noxen zu abzubilden. Auch wenn eine Summation der Einzelrisiken als Konvention für die Bewertung krebserzeugender Stoffe am Arbeitsplatz einen eher konservativen Ansatz im Sinne des Arbeitsschutzes für die betroffenen Beschäftigten darstellt, sind für die Bewertung der Effekte empirische Studien zu fordern, die den genauen Effekt einer Synkanzerogenese belegen. Bei Abwesenheit entsprechender Evidenz können deshalb nur die Einzelstoffe entsprechend der bestehenden Grenzwerte kontrolliert werden.
Anders sieht dagegen die Situation für die Bewertung von Mischexpositionen im Rahmen des Berufskrankheitenrechts aus: Hier wäre zu prüfen, ob die Möglichkeit der juristischen Feststellung einer BK über eine qualitative Bewertung der Synkanzerogenese ermöglicht wird, wenn entsprechende Evidenz eine Risikokumulation nahe legt, die durch das Zusammenwirken nicht ausreichender Einwirkungen in Kombination die Erkrankung wesentlich verursacht haben könnte (Becker 2015). Eine derartige Öffnung würde dem Gutachter ermöglichen, in Abhängigkeit von bestehender Evidenz und den objektiv festgestellten Expositionsumständen, eine BK auch bei nicht ausreichenden Einzelexpositionen qualitativ anzuerkennen. Die konkreten Rahmenbedingungen für die Anforderungen an diese Evidenz sind im Dialog zwischen Medizinern, Naturwissenschaftlern und Juristen aus wissenschaftlicher und berufskrankheitenrechtlicher Sicht zu erarbeiten.
Literatur
Becher H, Steindorf K: Epidemiologische Methoden und Wege der Risikoabschätzung. Informatik Biometrie Epidemiol Med Biol 1993; 24: 14-27.
Becker P: Synkanzerogenese als Berufskrankheit. Ein Lösungsvorschlag. Zentralbl Arbeitsmed Arbeitsschutz Ergonomie 2015; 65: 301–304.
Behrens T, Taeger D, Wellmann J, Keil U: Different methods to calculate effect estimates in cross-sectional studies – A comparison between prevalence odds ratio and prevalence ratio. Methods Inf Med 2004; 43: 505–509.
Behrens T, Pigeot I, Ahrens W: Epidemiologische und statistische Methoden der Risikoabschätzung. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz 2009; 52: 1151–1160.
Breslow N: Case-control studies. In: Ahrens W, Pigeot I (Hrsg.): Handbook of epidemiology. Berlin: Springer, 2005, S. 287–319.
Bundesanstalt für Arbeitsschutz und Arbeitsmedizin (BAuA): TRGS910: Risikobezogenes Maßnahmenkonzept für Tätigkeiten mit krebserzeugenden Gefahrstoffen (TRGS 910); 2014. www.baua.de/de/Themen-von-A-Z/Gefahrstoffe/TRGS/TRGS-910.html (zuletzt abgerufen am 01.11.2017).
Deutsche Gesetzliche Unfallversicherung (DGUV) – Fachausschuss Metall- und Oberflächenbehandlung: Chrom(VI)-Verbindungen bzw. Nickeloxide beim Schweißen und bei verwandten Verfahren – Schutzmaßnahmen am Arbeitsplatz. Fachausschuss-Informationsblatt 2008; 11 (Nr. 036): 1–3.
Greim H: Synkanzerogenese – eine Übersicht zum wissenschaftlichen Erkenntnisstand. In: Hauptverband der gewerblichen Berufsgenossenschaften (HVBG) und Deutsche Gesellschaft für Arbeits- und Umweltmedizin e.V. (DGAUM): BK-Report 2/2006: Synkanzerogenese – insbesondere Asbeststaub und PAK; Fachgespräch des HVBG und der DGAUM am 25.–26. November 2005 in Hennef und Workshop „Synkanzerogenese“ der DGAUM, 25.–26. Februar 2004; Berlin, 2006: 83–87.
Groneberg D: Betrachtung der Additivität von Exzessrisiken bei verschiedenen Expositionskonstellationen. Zbl Arbeitsmed 2015; 65: 190–191.
Hallier E: Synkanzerogenese aus medizinischer Sicht. In: Gesetzliche Unfallversicherung (DGUV) D (Hrsg.): Erfahrungen mit der Anwendung von § 9 Abs. 2 SGB VII (6. Erfahrungsbericht). Berlin: Eigenverlag, 2013: 72–79.
Hanahan D, Weinberg RA: Hallmarks of ca ncer: the next generation. Cell 2011; 144: 646–674.
Hosmer DW, Lemeshow S: Confidence interval estimation of interaction. Epidemiology 1992; 3: 452–456.
Kendzia B, Behrens T, Jöckel KH et al.: Welding and lung cancer in a pooled analysis of case-control studies. Am J Epidemiol 2013; 178: 1513–1525.
Knol MJ, van der Tweel I, Grobbee DE, Numans ME, Geerlings MI: Estimating interaction on an additive scale between continuous determinants in a logistic regression model. Int J Epidemiol 2007; 36: 1111–1118.
Knol MJ, VanderWeele TJ, Groenwold RH, Klungel OH, Rovers MM, Grobbee DE: Estimating measures of interaction on an additive scale for preventive exposures. Eur J Epidemiol 2011; 26: 433–438.
Miller A, Goff Jr. D, Bammann K, Wild P: Cohort studies. In: Ahrens W, Pigeot I (Hrsg.): Handbook of epidemiology. Berlin: Springer, 2005, S. 253–285.
Morfeld P: Synergetische Effekte – Definition und Terminologie aus epidemiologischer Sicht. In: Hauptverband der gewerblichen Berufsgenossenschaften (HVBG) und Deutsche Gesellschaft für Arbeits- und Umweltmedizin e.V. (DGAUM): BK-Report 2/2006: Synkanzerogenese – insbesondere Asbeststaub und PAK; Fachgespräch des HVBG und der DGAUM am 25.–26. November 2005 in Hennef und Workshop “Synkanzerogenese” der DGAUM, 25.–26. Februar 2004. Berlin, 2006, S. 223–254.
Morfeld P, Spallek M: Gefährdungsbeurteilung bei Exposition gegenüber mehreren krebserzeugenden Arbeitsstoffen. Zbl Arbeitsmed 2015; 65: 192–202.
Morfeld P, Spallek M: Gefährdungsbeurteilung bei Expositionen gegenüber mehreren krebserzeugenden Arbeitsstoffen-Ergänzungen und Erweiterungen zu Morfeld und Spallek 2015. Zbl Arbeitsmed 2016; 66: 337–344.
Olsson AC, Vermeulen R, Schüz J et al.: Exposure-response analyses of asbestos and lung cancer subtypes in a pooled analysis of case-control studies. Epidemiology 2017; 28: 288–299.
Panagiotou OA, Wacholder S: Invited commentary: How big is that interaction (in my community) – and in which direction? Am J Epidemiol 2014; 180: 1150–1158.
Parkin M, Bray F: Descriptive studies. In: Ahrens W, Pigeot I (Hrsg.): Handbook of epidemiology. Berlin: Springer, 2005, S. 157–230.
Robert Koch-Institut (RKI), Gesellschaft der Epidemiologischen Krebsregister in Deutschland e.V. (GEKID) (Hrsg.): Krebs in Deutschland 2011/2012. Berlin: RKI, 2015.
Rothman KJ: Synergy and antagonism in cause-effect relationships. Am J Epidemiol 1974; 99: 385–388.
Rothman KJ: Modern epidemiology. Boston, Toronto: Little Brown & Company, 1986.
Rothman KJ: Epidemiology: An Introduction. Oxford: Oxford University Press; 2002.
Schlüter G: Synkanzerogenese-Übertragbarkeit vom Tier auf den Menschen. In: Hauptverband der gewerblichen Berufsgenossenschaften (HVBG) und Deutsche Gesellschaft für Arbeits- und Umweltmedizin e.V. (DGAUM): BK-Report 2/2006: Synkanzerogenese – insbesondere Asbeststaub und PAK; Fachgespräch des HVBG und der DGAUM am 25.–26. November 2005 in Hennef und Workshop “Synkanzerogenese” der DGAUM, 25.–26. Februar 2004. Berlin: 2006, S. 211–222.
Strahlenschutzkommission: Möglichkeiten und Grenzen epidemiologischer Studien zur natürlichen Strahlenexposition. In: Bundesministerium für Umwelt, Naturschutz und Reaktorsicherheit (Hrsg.): Einfluss der natürlichen Strahlenexposition auf die Krebsentstehung in Deutschland – Stellungnahme der Strahlenschutzkommission mit wissenschaftlicher Begründung. Veröffentlichungen der Strahlenschutzkommission, Bd. 62. Berlin: Hoffmann Fachverlag, 2008, S. 73–114.
Timm J, Ahrens W, Pigeot I: Methodische Aspekte der Risikoabschätzung. Bundesgesundheitsbl Gesundheitsforschung Gesundheitsschutz 2003; 46: 555–563.
VanderWeele TJ, Vansteelandt S: Invited commentary: Some advantages of the relative excess risk due to interaction (RERI) – towards better estimators of additive interaction. Am J Epidemiol 2014; 179: 670–671.
Interessenskonflikt: Die Autoren erklären, dass kein Interessenskonflikt besteht.
FÜR DIE VERFASSER
Prof. Dr. med. Thomas Behrens, MPH
Institut für Prävention und Arbeitsmedizin der Deutschen Gesetzlichen Unfallversicherung, Institut der Ruhr-Universität Bochum (IPA)
Bürkle-de-la-Camp-Platz 1
44789 Bochum
ASU Arbeitsmed Sozialmed Umweltmed 2018; 53: 452–458
Fußnoten
Institut für Prävention und Arbeitsmedizin der Deutschen Gesetzlichen Unfallversicherung, Institut der Ruhr-Universität Bochum (IPA) (Direktor: Prof. Dr. med. Thomas Brüning)