Konsenspapier zur Nachsorge von Stich- und Schnittverletzungen mit infektiösem Material
Einleitung: Berufsgenossenschaften und Unfallkassen sind als Träger der Unfallversicherung (UVT) verpflichtet, für die Versorgung von Arbeitsunfällen wie Nadelstichverletzungen (NSV) aufzukommen und die Folgeschäden für Versicherte zu verhindern oder zu begrenzen. Die unterschiedlichen Schemata zur Nachsorge der NSV wurden überarbeitet und ein aktualisiertes Konsenspapier zwischen den UVT abgestimmt.
Methoden: Die aktuellen Leitlinien und Empfehlungen der Fachgesellschaften und der Ständigen Impfkommission des Robert Koch-Instituts (STIKO) zur NSV-Nachsorge wurden gesichtet und durch eigene Literaturrecherchen und Expertenbefragung ergänzt. Für die schwerwiegendsten Infektionsrisiken durch Hepatitis-B-Viren (HBV), Hepatitis-C-Viren (HCV) und HIV wurden Vorgehensweisen für den Regelfall beschrieben.
Ergebnisse: Hepatitis B: Entsprechend den Empfehlungen der STIKO zur postexpositionellen Hepatitis-B-Impfung ist nach einer NSV keine Maßnahme notwendig, wenn eine erfolgreiche Grundimmunisierung dokumentiert wurde und die positive Titerkontrolle (Anti-HBs >100 IE/L) nicht älter als zehn Jahre ist.
Hepatitis C: Der Verletzte sollte durch einen Nukleinsäureamplifikationstest (NAT) sechs Wochen nach einer gefährdenden Verletzung auf HCV-RNA untersucht werden. Bei unbekanntem oder bekanntem positiven HCV-Status der Indexperson bietet eine negative HCV-Diagnostik mittels eines NAT nach sechs Wochen eine hohe diagnostische Sicherheit. Zum Schutz von Dritten kann jedoch eine HCV-Diagnostik bereits zwischen der zweiten und vierten Woche indiziert sein.
HIV: Nach einer potenziell infektiösen Stich- und Schnittverletzung ist die Entscheidung über eine HIV-PEP schnell zu treffen. Ein HIV-Screeningtest der vierten Generation nach sechs Wochen schließt eine HIV-Infektion zuverlässig aus. Nach zwei negativen HIV-Screeningtests der vierten Generation nach der sechsten und zwölften Woche ist ein weiterer HIV-Test nach sechs Monaten nicht mehr erforderlich.
Diskussion: Das Programm ist primär als Empfehlung für D-Ärzte zu verstehen, um Orientierung bei der Nachsorge der NSV und Sicherheit bei der Abrechnung von Leistungen zu geben. Im Einzelfall kann auch ein begründetes abweichendes Vorgehen sinnvoll sein.
Schlussfolgerung: Die Hepatitis-C-Diagnostik nach einer NSV sollte derzeit noch über 24 Wochen fortgesetzt werden. Aufgrund der deutlich verbesserten Testsysteme kann sie möglicherweise in Zukunft bereits nach 12 Wochen beendet werden, wie dies für die HIV-Diagnostik aktuell schon der Fall ist. Das Nachsorgeprogramm wird erneut angepasst, sobald sich die gesicherten Erkenntnisse zu Diagnose, Impfungen, PEP oder Therapie von Infektionen mit HBV, HCV und HIV sowie die entsprechenden Empfehlungen der Fachgesellschaften ändern.
Schlüsselwörter: Nadelstichverletzung (NSV) – Beschäftigte im Gesundheitsdienst (BiG) – Laboruntersuchungen – Postexpositionsprophylaxe (PEP) – Impfung – Regeluntersuchungsprogramm
Consensus paper on the follow-up care of needlestick and sharps injuries with infectious materials
Introduction: As providers of accident insurance (PAI), professional associations and accident insurance agencies (AIA) are obliged to pay for the care of occupational accidents such as needlestick injuries (NSI) and to prevent or limit resulting complications for the insured person. The various schemes for the follow-up care of NSI have been revised and a consensus paper has been agreed among the AIA.
Methods: Current guidelines and recommendations from professional associations and the Standing Committee on Vaccinations of the Robert Koch Institute (STIKO) were scrutinised and complemented by our own literature searches and interviews with experts. Hepatitis B viruses (HBV), hepatitis C viruses and HIV present the most severe risk of infection; procedures for typical cases have been described.
Results: Hepatitis B: In accordance with the recommendations of the STIKO on post-exposure hepatitis B vaccination, no action must be taken after an NSI if effective basic immunisation is documented and a positive titre control (anti-HBs >100 IU/L) is no older than 10 years.
Hepatitis C: Six weeks after a potentially risky injury, the patient should be tested for HCV-RNA by means of a nucleic acid amplification test (NAT). If the HCV status of the index person is either unknown or known to be positive, a negative HCV test with NAT after six weeks assures high diagnostic reliability. However, for the protection of third parties, the HCV diagnostic testing can already be indicated between the second and fourth week.
HIV: After a potentially infectious needlestick or sharps injury, it must be rapidly decided whether an HIV-PEP is to be carried out. A fourth-generation HIV screening test after six weeks reliably excludes HIV infection. After two negative fourth-generation HIV screening tests after the sixth and twelfth weeks, it is no longer necessary to perform another HIV test after six months.
Discussion: This programme is primarily to be regarded as a recommendation for accident insurance doctors and is intended to give guidance in the follow-up care of NSI and to help in the preparation of reliable invoices. In individual cases, a different procedure may be desirable.
Conclusion: At the present time, hepatitis C diagnostic testing should be continued for 24 weeks after an NSI. As there have been marked improvements in the test systems, it may be possible to reduce this to 12 weeks in future – as is currently the case for HIV diagnostic testing. The programme of follow-up care will be adapted as soon as there is reliable new information on the diagnosis, vaccination, PEP or treatment of infections with HBV, HCV and HIV, as well as the relevant recommendations from professional societies.
Keywords: needlestick injuries (NSI) – health service employees (HSE) – laboratory tests – post-exposure prophylaxis (PEP) – vaccination – regular examination programme
ASU Arbeitsmed Sozialmed Umweltmed 2018; 53: 249–255
doi: 10.17147/ASU.2018-04-05-01
Einleitung
Bei der Nachsorge von Nadelstichverletzungen (NSV) sind die Berufsgenossenschaften und Unfallkassen (Unfallversicherungs träger, UVT) in den vergangenen Jahren unterschiedlich vorgegangen. Dies führte zur Verunsicherung bei den behandelnden Ärzten. Daher bestand die Notwendigkeit einer Harmonisierung der Schemata.
Es ging dabei primär um die Anpassung der Labordiagnostik der Hepatitis B (HBV), Hepatitis C (HCV) und HIV. Bei den Themen Untersuchung der Indexperson (Donor), Dauer der Nachsorge und Einsatz von Nukleinsäureamplifikationsverfahren (NAT/PCR) bestand besonderer Abstimmungsbedarf. Die Empfehlungen zu Hepatitis-B-Impfungen, zur spezifischen Hepatitis-B-Immunglobulingabe und zur HIV-Postexpositionsprophylaxe (PEP) werden dagegen von den jeweils aktuellen Empfehlungen der Fachgesellschaften und der Ständigen Impfkommission des Robert Koch-Instituts (STIKO) vorgegeben.
Mit dieser Überarbeitung waren verschiedene Ziele verbunden: Das Nachsorgeprogramm sollte
- evidenzbasiert sein/die neuesten Erkenntnisse berücksichtigen,
- der verletzten Person einen frühzeitigen Ausschluss einer Infektion mit HBV, HCV und HIV ermöglichen und
- den beteiligten Ärzten als Orientierung dienen.
Das Vorgehen kann im Einzelfall abweichen, wenn dafür besondere Gründe vorliegen.
Methode
An dem Konsenspapier zum Nachsorgeprogramm waren folgende UVT beteiligt: Berufsgenossenschaft für Gesundheitsdienst und Wohlfahrtspflege (BGW) und die Unfallkassen Berlin, Baden-Württemberg (UK BW) und Nordrhein-Westfalen (UK NRW). Die unterschiedlichen Schemata der UVT wurden gegenübergestellt und mit der aktuellen Literatur abgeglichen (März 2017) (JStr). Bei Unstimmigkeiten wurde epidemiologische und virologische Expertise eingeholt (WW, SP). Die Konsensfindung erfolgte unter den Arbeitsmedizinerinnen der beteiligten UVT (BK, JSt, StJ, JStr). Parallel dazu war es erforderlich, die Veränderungen jeweils mit den operativen Ebenen und Entscheidungsträgern in den beteiligten UVT zu besprechen, um die Umsetzung der geänderten Regelungen zu garantieren.
Nach Konsensfindung wurde das erarbeitete Nachsorgeprogramm bei verschiedenen Anlässen vorgestellt (u.a. betriebsärztliche Fortbildung, FFAS-Symposium 2017, Jahrestagung der Deutschen Gesellschaft für Arbeits- und Umweltmedizin 2018). Diese Gelegenheiten wurden genutzt, um die ausgearbeiteten Empfehlungen auf Verständlichkeit und Praxistauglichkeit zu prüfen. Die Publikation wurde unter Federführung der BGW (JStr) vorbereitet.
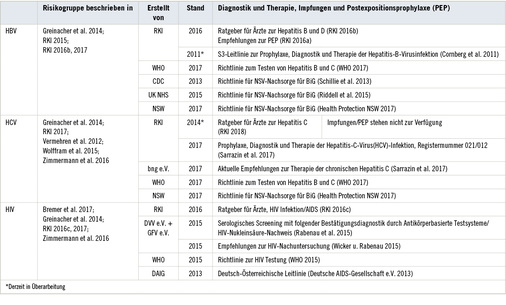
Gesichtete Leitlinien
Siehe Tabelle 1. Begleitend und ergänzend wurden Publikationen zum Management von NSV vorwiegend aus dem deutschsprachigen Raum gesichtet (Baars 2016; Himmelreich et al. 2013a, b; Jost et al. 2011). In der Abstimmung wurde den Empfehlungen nationaler Gremien eine höhere Priorität zugesprochen (Kuhar et al. 2013; Schillie et al. 2013).
Ergebnisse
Abgestimmtes Nachsorgeschema nach NSV (Stand 27.02.2018)
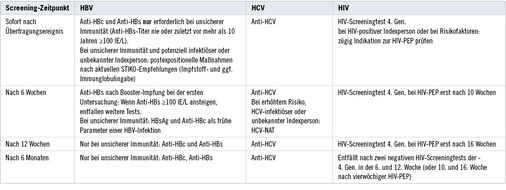
Verletzte Person: Laboruntersuchungen, ggf. HIV-PEP und HB-Impfung: nach individueller Risikoabschätzung, Aufklärung und informiertem Einverständnis der verletzten Person ( Tabelle 2 ).
Indexperson: Sofern der aktuelle Infektionsstatus der Indexperson nicht bekannt ist, wird eine Untersuchung der Indexperson nach individueller Risikoabschätzung, Aufklärung und informiertem Einverständnis empfohlen. Die Untersuchung ist jedoch keinesfalls Voraussetzung zur Nachsorge bei der verletzten Person ( Tabelle 3 ).
HBV-Immunschutz und -Impfungen
HBV-Diagnostik: Eine HBV-Diagnostik wird den verletzten Personen mit unsicherem Immunschutz nach gefährdenden Kontakten angeboten. Die HBsAg-, Anti-HBc- und Anti-HBs-Bestimmung sowie HBV-Impfungen sind nicht erforderlich bei sicherem Immunschutz der verletzten Person.
- Als HBsAg wird das immunogen wirksame Hüllprotein des HBV bezeichnet. Es tritt während der Inkubationszeit in der Regel 4–12 Wochen nach HBV-Infektion im Serum auf. Das HBsAg ist zudem der wirksame Bestandteil in den zugelassenen HBV-Impfstoffen. Es ist als isolierter Bestandteil des HBV allein nicht vermehrungsfähig. Ein HBsAg-Test weist HBV-Hüllproteine nach einer HBV-Infektion nach. Es wird zur Verlaufsdiagnostik einer akuten oder chronischen HBV-Infektion eingesetzt. HBsAg tritt in 95 % der Fälle auf, ist meist schon Wochen vor Erkrankungsbeginn im Serum vorhanden und bleibt bei einer akuten Hepatitis B ein bis vier Monate nachweisbar. Verbleibt es länger als sechs Monate, spricht man von einer chronischen Hepatitis B.
- Anti-HBs ist ein Indikator für Immunität nach ausgeheilter HBV-Infektion sowie nach HB-Impfung. Ein „reaktiver“ (positiver) Test auf Anti-HBs zeigt eine Immunreaktion gegen HBsAg an. Nach einer abgelaufenen HBV-Infektion wird es in der späten Rekonvaleszenzphase drei bis vier Monate nach der ikterischen Phase (Gelbsucht) gebildet.
- Anti-HBc (c = core) ist dagegen ein Indikator für eine Immunreaktion ausschließlich nach Erregerkontakt und weist auf eine akute oder zurückliegende Infektion mit HBV hin. Es hat eine hohe diagnostische Sicherheit. Es tritt während der akuten Phase als erster Antikörper oft fast zeitgleich mit HBsAg auf und persistiert in der Regel lebenslang.
- Anti-HBc-IgM wird bereits kurz nach dem Beginn der Virusvermehrung gebildet und bleibt mehrere Monate nachweisbar (RKI 2016b).
- In der Frühphase der HBV-Infektion ist HBV-DNA der erste positive Infektionsmarker (meist aber erst mehrere Wochen nach der Exposition), wenn sie mit empfindlichen NAT nachgewiesen wird. Einige Wochen später folgt das HBsAg als erster serologischer Marker. Der Nachweis von HBV-DNA im Serum mittels quantitativer NAT, z.B. mit der Real-time-Polymerasekettenreaktion (PCR) ist ein Marker für die Höhe der Virämie und damit ein Maß für die Infektiosität. HBV-DNA wird bei fast allen Patienten mit akuter und chronischer Infektion gefunden, sie kann aber auch noch Monate bis Jahre nach Verschwinden des HBsAg nachweisbar sein. Ein NAT bei der Indexperson wird bei isoliertem Anti-HBc in seltenen Einzelfällen zum Ausschluss einer Virämie empfohlen (RKI 2016b).
Hepatits-B-Impfungen: Man unterscheidet eine so genannte aktive Impfung von einer passiven Immunisierung gegen HBV. Eine aktive HBV-Grundimmunisierung besteht aus mehreren Teilimpfungen. Zur Überprüfung des HBV-Impfschutzes weicht man auf Anti-HBs als Surrogatparameter für die immunologische Reaktionsfähigkeit aus. Man geht davon aus, dass ab einem Antikörperspiegel (Anti-HBs) von 10 IE/L ein sicherer Schutz vor einer HBV-Erkrankung besteht, jedoch kein „Langzeitschutz oder Vollschutz“ gewährleistet ist. Hier widersprechen sich nationale und internationale Empfehlungen (Cornberg et al. 2011; RKI 2016a; Schillie et al. 2013). Dagegen besteht nach nationaler Definition erst ein sicherer Langzeitschutz, wenn sechs Wochen nach der letzten Teilimpfung der Grundimmunisierung ein Anti-HBs von 100 IE/L nachgewiesen wird. Es besteht mindestens für die nächsten 15 Jahre ein Schutz vor einer HBV-Infektion. Personen mit erhöhtem Hepatitis-B-Infektionsrisiko sollten allerdings aus Sicherheitsgründen weiterhin nach zehn Jahren wieder eine Impfung erhalten (Cornberg et al. 2011). Von sicherem HBV-Immunschutz spricht die STIKO deshalb in diesem Zusammenhang, wenn ein Anti-HBs innerhalb der vergangenen zehn Jahre von 100 IE/L vorliegt. Sollte bei der verletzten Person ein Nachweis über einen leitliniengerechten sicheren HBV-Immunschutz vorhanden sein, kann auf weitere HBV-Untersuchungen und Impfungen verzichtet werden. Sollte dies nicht der Fall sein, wird der Serostatus und die Indikation für HBV-Impfungen der verletzten Person nach dem Schema der STIKO geprüft. Die Kosten für die notwendigen HBV-Impfungen (aktive Impfung und/oder passive Immunisierung mit Immunglobulin) im Rahmen der Erstversorgung des Verletzten werden von den Unfallkassen und Berufsgenossenschaften übernommen, weitere aktive Impfungen zur Vervollständigung des HBV-Impfschutzes gehen auf Kosten des Arbeitgebers.
Besondere Aufmerksamkeit erfordern Low- und Non-Responder und ungeimpfte Personen nach Kontakt mit infektiöser oder unbekannter Indexperson. Bei ihnen geht man von einer unsicheren Langzeitimmunität oder fehlenden HBV-Immunität aus, das Vorgehen nach NSV ist deshalb unterschiedlich und richtet sich bei Low-Respondern nach dem aktuell erhobenen Anti-HBs.
- Von Low-Respondern spricht man nach nationalen Empfehlungen dann, wenn nach HBV-Grundimmunisierung sowie weiteren HBV-Impfungen zwar Immunschutz, aber nie ein sicherer Langzeitimmunschutz erreicht wurde (Anti-HBs 10–99 IE/L, nie 100 IE/L). Bei ihnen wird nach einer NSV sofort Anti-HBs bestimmt. Ist Anti-HBs
- Bei „Non-Respondern“ (Anti-HBs immer sollte zum Ausschluss einer bestehenden chronischen HBV-Infektion Blut für die Bestimmung von HBsAg- und Anti-HBc abgenommen werden, vorausgesetzt diese Informationen liegen nicht schon vor. Danach sollte sofort eine simultane Gabe von HBV-Impfstoff und HBV-Immunglobulin erfolgen, ohne das Testergebnis abzuwarten. Dieses Vorgehen wird auch für ungeimpfte Personen empfohlen (Cornberg et al. 2011; RKI 2016a).
In der Praxis kommt es vor, dass Verletzte keinen Impfausweis mitbringen und/oder sich nur an zwei HBV-Teilimpfungen erinnern. Hier soll Anti-HBs und Anti-HBc innerhalb von 48 Stunden bestimmt sowie die HBV-Impfserie vervollständigt werden. Ist Anti-HBs
HCV-Diagnostik
Eine HCV-Diagnostik wird den verletzten Personen nach gefährdenden Kontakten angeboten. In Krankenhäusern ist immer von einer HCV-Gefährdung auszugehen, solange keine Informationen über Risikofaktoren und Immunstatus der Indexperson vorliegen.
- Ein Anti-HCV-Test erfasst IgG-Antikörper und wird in der Regel nach mehreren Wochen positiv, es kann in Einzelfällen jedoch zu einer stark verzögerten Antikörperbildung kommen. Deshalb wird nach Kontakt mit infektiösen oder unbekannten Indexpersonen und bei Kontextfaktoren, die eine Infektion nicht ausschließen, eine abschließende Anti-HCV-Kontrolle nach sechs Monaten empfohlen.
- IgM-Antikörper spielen in der Diagnostik bei HCV bisher keine Rolle, weil sie im Fall der akuten Infektion nicht immer gefunden werden (falsch-negatives Ergebnis) und andererseits im Verlauf der chronischen Infektion immer wieder auftreten können (falsch-positives Ergebnis).
- Ein HCV-NAT erfasst dagegen Virus-RNA und kann deshalb eine HCV-Infektion und die damit einhergehende Virus vermehrung als Viruslast bereits zwei bis vier Wochen nach der Infektion anzeigen; es sind jedoch zu diesem frühen Zeitpunkt noch falsch-negative Befunde möglich. Ein HCV-NAT nach sechs Wochen bietet dagegen eine hohe diagnostische Sicherheit.
Im Regelfall ist nach einem ersten negativen HCV-NAT nach sechs Wochen ein Anti-HCV-Test nach 12 Wochen ausreichend, um eine HCV-Infektion mit hoher Wahrscheinlichkeit auszuschließen. Weiterhin ist jedoch ein Anti-HCV-Test nach sechs Monaten abschließend zum HCV-Ausschluss vorgesehen (Haamann 2009; RKI 2018; Sarrazin et al. 2010; Sarrazin et al. 2017).
HIV-Diagnostik und -PEP
Eine HIV-Diagnostik wird den verletzten Personen nach potenziell gefährdenden Kontakten angeboten. Sie verzögert sich durch eine vierwöchige HIV-PEP jeweils um vier Wochen.
- Das HIV-Screening erfolgt aktuell mit Testsystemen der vierten Generation (HIV-Screeningtest). Ein moderner HIV-Screeningtest erfasst vor dem Auftauchen von HIV-Antikörpern bereits ein HIV-Antigen (Anti-HIV-1, Anti-HIV-2 sowie HIV-p24-Antigen). Er weist spätestens nach sechs Wochen eine HIV-Infektion nach einer Übertragung nach, frühestens nach zwei Wochen (diagnostisches Fenster). Damit gilt, dass ein negatives Ergebnis im HIV-Screeningtest der vierten Generation eine HIV-Infektion mit großer Sicherheit ausschließt, wenn die letzte HIV-Exposition oder NSV länger als sechs Wochen zurückliegt.
- Dennoch wird auch hier ein abschließender HIV-Ausschluss mit einem Screeningtest der vierten Generation drei Monate nach der NSV empfohlen (Rabenau et al. 2015; RKI 2016c; Wicker u. Rabenau 2015).
Im Unterschied dazu war bei den HIV-Screeningtests der dritten Generation noch eine abschließende Diagnostik sechs Monate nach der Verletzung erforderlich.
Nach einem ersten positiven/reaktiven HIV-Screeningtest beim Verletzten wird in einer unabhängigen Blutprobe ein zweiter HIV-Screeningtest durchgeführt; anschließend erfolgt ein Bestätigungstest mit einem HIV-Immunoblot (erfasst Anti-HIV) oder mit der HIV-NAT (erfasst Virus-RNA; Rabenau et al. 2015).
Indexperson: Nach einem positiven/reaktiven Anti-HIV-Screeningtest bei der Indexperson wird auch ihre HI-Viruslast bestimmt (HIV-NAT quantitativ). Sie dient als Entscheidungshilfe zur Weiterführung der HIV-PEP beim Verletzten.
Auf die Formulierung von Empfehlungen zum Vorgehen bei der HIV-PEP wird verzichtet, da es dazu eine gültige Leitlinie gibt (Deutsche AIDS-Gesellschaft e.V. 2013). Solange unter Berücksichtigung der deutsch-österreichischen HIV-Leitlinie eine HIV-Infektionsgefährdung nicht ausgeschlossen werden kann, wird in Zweifelsfällen die unverzügliche Einleitung einer HIV-PEP (innerhalb von zwei Stunden) empfohlen, bis durch eine spezialisierte HIV-Beratung und/oder den Ausschluss einer HIV-Infektion bei der Indexperson mehr Handlungssicherheit erreicht werden kann. Die HIV-PEP kann innerhalb von 24 Stunden verabreicht werden. Allerdings ist sie in den ersten zwei Stunden nach der NSV am wirksamsten.
Diskussion
Von den parenteral übertragenen Infektionen sind HBV, HCV und HIV bei Beschäftigten im Gesundheitsdienst (BiG) am bedeutendsten. Die vorliegende Publikation konzentriert sich deshalb vorwiegend auf das Diagnostikprogramm zu HBV, HCV und HIV sowie auf die Indikation zu Hepatitis-B-Impfungen nach NSV, da es bei diesen Punkten den größten Diskussionsbedarf gab.
Als Erfolg der vielfältigen Präventionsbemühungen sind HBV-, HCV- und HIV-Neuinfektionen, die als Berufskrankheit anerkannt wurden, zwischen 2007 und 2015 um 78 % gesunken. Im selben Zeitraum waren die registrierten NSV-Fälle um 36,5 % gestiegen. Überwiegend handelte es sich dabei um nicht meldepflichtige Fälle, die nicht zu Arbeitsunfähigkeit führten (Dulon et al. 2018). Allerdings wurden ärztliche Beratungen und Behandlungen in Anspruch genommen, die über die UVT abgerechnet wurden. Ob es im Gesundheitswesen nicht gemeldete tätigkeitsbedingte Infektionsfälle gibt und wenn ja, wie viele, ist nicht bekannt. Bei den NSV geht man dagegen von einer hohen Dunkelziffer aus (Health Protection NSW 2017; Kubitschke et al. 2007). Wegen der großen Menge der gemeldeten NSV, die über alle UVT hinweg in den vergangenen Jahren weiter zugenommen haben, sind abgestimmte Empfehlungen zur Nachsorge sinnvoll und notwendig, besonders dort, wo evidenzbasierte Standards, formuliert von medizinischen Fachgesellschaften, noch fehlen. Bezogen auf Hepatitis-B-Impfungen und HIV-PEP kann auf Leitlinien von Fachgesellschaften und Empfehlungen der nationalen Impfkommission zurückgegriffen werden. Diese werden von den UVT in der aktuellen Fassung jeweils übernommen und dienen den D-Ärzten und Betriebsärzten als Entscheidungsgrundlage. In Bezug auf die Empfehlungen zur Hepatitis-B-Impfung entstehen jedoch häufig Diskussionen bei der Unterscheidung zwischen Immunität (Anti-HBs 10 IE/L) und sicherer Langzeitimmunität (Anti-HBs 100 IE/L) sowie den Konsequenzen für das postexpositionelle Vorgehen und die Folgeimpfungen.
Zusätzlich zur Klärung des HBV-Immunstatus sprechen auch versicherungsrechtliche Überlegungen für eine Serodiagnostik zum Zeitpunkt der NSV („sofort nach Übertragungsereignis“). Die serologische Diagnostik erleichtert später im Rahmen eines Berufskrankheiten(BK)-Verfahrens gegebenenfalls die Anerkennung einer blutübertragenen Viruserkrankung im Sinne einer BK 3101, wenn zum Zeitpunkt der NSV noch ein negativer Serostatus erhoben wurde und es nach der NSV zur Serokonversion kommt. Allerdings gibt es für Beschäftigte im Gesundheitsdienst bei bestimmten gefährdeten Einwirkungen während der beruflichen Tätigkeit zusätzlich so genannte Beweiserleichterungskriterien, durch die sich der Stellenwert der Diagnostik zum Zeitpunkt der NSV in der Einzelfallprüfung relativiert. Sollte tatsächlich bereits zum Zeitpunkt der NSV ein positiver Serostatus erhoben werden, muss dies in jedem Fall auf einen früheren Infektionszeitpunkt zurückgeführt werden. Trotzdem sollte ein BK-Verfahren eröffnet und die berufliche Verursachung vom UVT geprüft werden. Zusammenfassend ist die generelle Beweislastumkehr im BK-Verfahren zwar ein zusätzlicher Aspekt, der bei der Beratung nach einer NSV eine gewisse Rolle spielt, die Serodiagnostik zum Zeitpunkt der NSV hat aber bei BiG, bei denen bei der Einzelfallprüfung gegebenenfalls Beweiserleichterungskriterien angewendet werden können und bei denen es keinen Hinweis auf eine privat erworbene Krankheit gibt, nur eine untergeordnete Bedeutung (Remé 2007). Alternativ zur sofortigen Serodiagnostik wird in anderen Ländern eine Blutentnahme mit anschließendem Einfrieren einer Serumprobe ermöglicht (Riddell et al. 2015).
Klärungsbedarf bestand hauptsächlich bei uneinheitlichen Empfehlungen zur Labordiagnostik nach NSV, da die Empfehlungen der UVT voneinander abwichen und nicht auf aktuelle Standards der Fachgesellschaften zurückgegriffen werden konnte, die die besondere Situation nach NSV berücksichtigten. Es wurde auch kontrovers diskutiert, ob die Serodiagnostik über drei oder sechs Monate weitergeführt werden sollte und inwieweit eine Immundefizienz bei Beschäftigen für die Standarddiagnostik berücksichtigt werden müsste.
Es bestand weitgehender Konsens, dass man im Allgemeinen bei aktiv Berufstätigen von immunkompetenten Personen ausgehen kann und dass den versicherten Beschäftigten nach beruflicher Exposition Tests über die maximale Inkubationszeit angeboten werden. Dafür sprechen weniger versicherungsrechtliche, sondern vorrangig virologische Argumente: Durch die geringe Anzahl von Viren, die bei einer NSV übertragen werden, scheint auch bei Immungesunden eine verzögerte Immunreaktion und damit auch ein verzögertes Ansprechen auf die vorhandenen Testverfahren immerhin denkbar (pers. Mitteilung Herr Prof. Rabenau).
Außerdem soll durch die aktualisierten Empfehlungen der UVT der Stellenwert der Diagnostik bei den Indexpatienten gestärkt werden. Falls die Indexperson bekannt und eine Infektion mit HBV, HCV und/oder HIV nicht ausgeschlossen ist, sollte nach Aufklärung und mit dem Einverständnis der Indexperson eine entsprechende Serodiagnostik vorgenommen werden. Eine Untersuchung der Indexperson ist nicht in jedem Fall notwendig oder realisierbar. Wenn eine Befragung und Untersuchung indiziert und unter Beachtung der rechtlichen Rahmenbedingungen möglich ist, können die Ergebnisse jedoch dazu beitragen, die verletzte Person von Infektionsängsten zu befreien, postexpositionelle Maßnahmen zu vermeiden oder wieder abzusetzen und die weitere Labordiagnostik abhängig von Kontextfaktoren zu reduzieren. Dieses differenzierte Eingehen auf die Befindlichkeit der verletzten Person berücksichtigt auch Hinweise über einen möglichen negativen Einfluss einer NSV auf die psychische Gesundheit und Einstellung zur Arbeit (Loerbroks et al. 2015).
Auf nationaler Ebene wird Personen nach infektionsgefährdenden Vorkommnissen eher zu vorsichtigem Verhalten und zur künftigen Vermeidung von verletzungsträchtigen Tätigkeiten geraten. Internationale Leitlinien bestärken dagegen die verletzte Person, ihre Tätigkeit fortzusetzen und betrachten sie nicht primär als potenziell infektiös. Sie sollten dennoch für den Zeitraum von mindestens 12 Wochen von Blut- und Gewebespenden absehen, Schwangerschaften verhüten oder das Stillen einstellen (Riddell et al. 2015).
Hepatitis B
Die Hepatitis B tritt inzwischen bei Beschäftigten im Gesundheitsdienst seltener auf als eine Hepatitis C (Nienhaus et al. 2017). Dieser immense Präventionserfolg wird allgemein auf die Impfstrategien im Gesundheitsdienst und in der Allgemeinbevölkerung der vergangenen Jahrzehnte zurückgeführt. Die nationalen Empfehlungen der STIKO (RKI 2016a) zu Hepatitis-B-Impfschemata nach NSV erfordern ein sehr differenziertes Vorgehen auf Basis einer HBV-Antikörperdiagnostik (Anti-HBs), die lediglich als Surrogatparameter für die Immunabwehr dienen kann. Dadurch entstehen regelmäßig Irritationen in der Versorgung der BiG mit Hepatitis-B-Impfungen, da die zusätzlich eingebauten Sicherheitsstufen des HBV-Langzeitimmunschutzes mit Minimalanforderungen zum HBV-Immunschutz verwechselt werden: Zusätzlich zur Kategorie „Hepatitis-B-Immunschutz ab Anti HBs 10 IE/L“ gibt es noch den „effektiven Langzeitimpfschutz“ über mindestens 15 Jahre, wenn Anti-HBs auf 100 IE/L nach einer HBV-Grundimmunisierung ansteigt. Auch nach späterem Absinken des Anti-HBs-Spiegels unter 100 IE/l wird aufgrund des immunologischen Gedächtnisses in der Regel von einem weiter bestehenden Impfschutz ausgegangen. Gegebenenfalls kann eine bestehende Immunität durch den Anti-HBs-Anstieg nach einer weiteren Impfdosis nachgewiesen werden (RKI 2016b). Kein Immunschutz besteht nach internationaler Übereinkunft bei bekanntem „Non-Responder mit Anti HBs nie 10 IE/L“. Nach nationalen Kriterien wird noch der „Low-Responder mit Anti-HBs 10 bis 99 IE/l“ definiert; bei ihm wird zwar ein HBV-Immunschutz angenommen, aber es besteht gleichzeitig ein unsicherer Langzeitschutz. Sollte bei einem Low-Responder zum Zeitpunkt der NSV der Anti HBs 10 IE/l sein, ist ein Schutz vor Erkrankung dennoch wahrscheinlich, da das Immunsystem eine Reaktion auf vorangegangene Impfungen aufweist. Dennoch sollte der verletzten Person sofort eine weitere Hepatitis-B-Impfung empfohlen werden. Beim Low-Responder mit Anti-HBs
Hepatitis C
Für die Prävention der Hepatitis C steht weder eine Impfung noch eine PEP oder eine zugelassene Frühtherapie zur Verfügung. Deshalb konzentriert man sich bei der Hepatitis C auf die Labordiagnostik und zu einem späteren Zeitpunkt auf die Therapie der chronischen Hepatitis C. Die HCV-Diagnostik nach einer NSV stützt sich im Standardprogramm auf antikörperbasierte Testsysteme. Es gibt jedoch mit dem HCV-NAT zusätzlich eine frühzeitige Nachweismöglichkeit von Virus-RNA. Ein HCV-NAT sollte nach einer NSV bei erhöhtem Risiko abhängig von Kontextfaktoren (z.B. nicht bekannter Serostatus oder unbekannte Indexperson im Krankenhaus) oder bekannt infizierten Indexpersonen eingesetzt werden. Der Virusnachweis bei der verletzten Person ist mit dem HCV-NAT bereits zwischen der zweiten und vierten Woche nach einer Transmission möglich. Es kann jedoch zu diesem frühen Zeitpunkt noch zu falsch-negativen Befunden kommen, insbesondere wenn die übertragene Virusmenge sehr niedrig ist, wie es bei der NSV der Regelfall ist. Die diagnostische Sicherheit eines HCV-NAT ist nach sechs Wochen deutlich höher, deshalb stellt eine Blutabnahme zu einem früheren Zeitpunkt möglicherweise eine unnötige Zusatzbelastung dar. Aus diesen Gründen empfehlen Praktiker, den ersten HCV-NAT gemeinsam mit den anderen Suchtests für HIV und gegebenenfalls Hepatitis B erst nach sechs Wochen zu beauftragen. Davon abweichend spielen bei der Wahl des Zeitpunkts der HCV-Diagnostik in Einzelfällen noch Aspekte des Schutzes von Dritten eine Rolle (z.B. Patientenschutz bei Chirurgen). In diesen Ausnahmefällen kann deshalb ein HCV-NAT zwei bis vier Wochen nach einer NSV sinnvoll sein.
In der Diskussion über den besten Zeitpunkt des ersten HCV-NAT war gleichzeitig der Stand der neuen Therapieempfehlungen zur Hepatitis C zu berücksichtigen. Ein möglichst frühzeitiger Nachweis bei fehlenden Empfehlungen zur Frühtherapie und nicht zugelassenen Therapeutika ist nur von begrenztem therapeutischem Nutzen. Die Therapie der Hepatitis C erfolgt heute interferonfrei durch DAA mit exzellenten Chancen für eine dauerhafte Viruseradikation (Falade-Nwulia et al. 2017; Zeuzem 2017). Deshalb wird eine interferonhaltige Frühtherapie nicht mehr empfohlen und eher zu einem abwartenden therapeutischen Verhalten geraten.
Einschränkend wirkte, dass die Empfehlungen der Fachgesellschaften zur Therapie der akuten Hepatitis C zum Zeitpunkt der Literaturrecherchen noch überarbeitet wurden. Die zukünftigen Empfehlung der Fachgesellschaften zur Therapie der akuten Hepatitis C oder eventuellen PEP nach NSV müssen bei einer weiteren Anpassung des Laborschemas berücksichtigt werden.
HIV
Zur HIV-Diagnostik wird aktuell der HIV-Screeningtest der vierten Generation empfohlen. Es handelt sich dabei um einen Mehrkomponententest, der bereits sechs Wochen nach einer HIV-Transmission eine hohe diagnostische Verlässlichkeit aufweist. Im Unterschied dazu schloss der antiköperbasierte Test der dritten Generation erst nach zwei negativen Ergebnissen nach der sechsten und 12. Woche eine HIV-Infektion mit hoher Wahrscheinlichkeit aus (Wicker u. Rabenau 2015). Außerdem wurde früher ein weiterer Ausschlusstest sechs Monate nach der NSV empfohlen. Mit der neuen Testgeneration kann der abschließende HIV-Ausschluss bereits nach drei Monaten erfolgen und die HIV-Diagnostik somit um drei Monate verkürzt werden. Es wurde deshalb vereinbart, dass bei Anwendung der modernen HIV-Screeningtests ab der vierten Generation auf einen weiteren Test nach sechs Monaten verzichtet wird. Bei einer vierwöchigen HIV-PEP verschiebt sich die Diagnostik jeweils um vier Wochen. Zukünftig werden HIV-Tests der fünften Generation zur Verfügung stehen, die im Unterschied zum Screeningtest der vierten Generation in der Lage sind, Virusbestandteile und die Immunreaktion darauf getrennt anzuzeigen und damit sofort die inzidente von der prävalenten Infektion abzugrenzen (Alexander 2016). Hervorzuheben ist, dass eine HIV-PEP auch im Zweifel zügig begonnen werden sollte, weil sie innerhalb der ersten beiden Stunden nach einer NSV am wirksamsten ist. Anschließend sollte an einen HIV-Spezialisten verwiesen werden.
Schlussfolgerungen
Die Sofortmaßnahmen und das weitere Nachsorgeprogramm nach NSV sind seit vielen Jahren Standard im Arbeitsschutz von Beschäftigten im Gesundheitsdienst. Als Entscheidungshilfen für HIV-PEP und Hepatitis-B-Impfungen stehen nationale Leitlinien zur Verfügung. Die Empfehlungen zur Serodiagnostik wurden zwischen den Unfallkassen und Berufsgenossenschaften abgestimmt. Nach einer NSV muss sofort eine Risikoabschätzung vorgenommen werden. Die Serodiagnostik sofort nach der NSV dient dem Ausschluss einer bereits bestehenden Infektion sowie der Entscheidung über Impfungen bei unsicherem Hepatitis-B-Immunschutz.
Verletzten Personen ohne aktuellen Hepatitis-B-Immunschutz (Ungeimpfte, Non-Responder und Low-Responder mit aktuellem Anti-HBs
Das Nachsorgeprogramm wird erneut angepasst, sobald sich die gesicherten Erkenntnisse zu Diagnose, Impfungen, PEP oder Therapie von Infektionen mit HBV, HCV und HIV sowie die entsprechenden Empfehlungen der Fachgesellschaften ändern. Eine engere Zusammenarbeit mit virologischen Fachgesellschaften wird angestrebt.
Literatur
Alexander TS: Human immunodeficiency virus diagnostic testing: 30 years of evolution. Clin Vaccine Immunol 2016; 23: 249–253.
Baars S: Vermeidung von Nadelstichverletzungen in der Arztpraxis – Was muss der Praxisinhaber beachten? 2016. Retrieved 06.03.2018, from www.runder-tisch-hannover.de/?ddownload=1543 .
Bremer V, Dudareva-Vizule S, Buder S, An der Heiden M, Jansen K: [Sexually transmitted infections in Germany: The current epidemiological situation]. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz 2017; 60: 948–957.
Cornberg M, Protzer U, Petersen J et al.: [Prophylaxis, diagnosis and therapy of hepatitis B virus infection – the German guideline]. Z Gastroenterol 2011; 49: 871–930.
Deutsche AIDS-Gesellschaft e.V.: Deutsch-Österreichische Leitlinie zur Postexpositionellen Prophylaxe der HIV-Infektion. AWMF Leitlinie Nr: 055/004. Berlin, 2013.
Dulon M, Lisiak B, Wendeler D, Nienhaus A: [Workers‘ compensation claims for needlestick injuries among healthcare personnel in hospitals, doctors‘ surgeries and nursing institutions]. Gesundheitswesen 2018; 80: 176–182.
Falade-Nwulia O, Suarez-Cuervo C, Nelson DR, Fried MW, Segal JB, Sulkowski MS: Oral direct-acting agent therapy for hepatitis C virus infection: a systematic review. Ann Intern Med 2017; 166: 637–648.
Greinacher A, Heim MUH et al.: Querschnitts-Leitlinien (BÄK) zur Therapie mit Blutkomponenten und Plasmaderivaten. 4. Aufl. Berlin: BÄK, 2014, S. 137.
Haamann F: Vorgehen nach Stich- und Schnittverletzungen – Begründung für das Regeluntersuchungsprogramm der BGW. Arbeitsmed Sozialmed Umweltmed 2009; 44: 29–33.
Health Protection NSW: HIV, Hepatitis B and Hepatitis C – Management of Health Care Workers Potentially Exposed. 2017. Retrieved 05.03.2018, from www1.health.nsw.gov.au/pds/ActivePDSDocuments/PD2017_010.pdf?bcsi_scan_e09ff2199bb3916e=/xjNngW+BwGIeH7WZOKBowzQ8F0HAAAA+IbaMw==&bcsi_scan_filename=PD2017_010.pdf .
Himmelreich H, Rabenau HF, Rindermann M et al.: The management of needlestick injuries. Dtsch Arztebl Int 2013a; 110: 61–67.
Himmelreich H, Walcher F, Marzi I, Wicker S: Nadelstichverletzungen Diagnose und Behandlungsanforderungen. Trauma und Berufskrankheit 2013b; 15: 174–178.
Jost M, Francioli P, Iten A et al.: Verhütung blutübertragbarer Infektionen im Gesundheitswesen. 16. Aufl. Luzern: suvaPro, 2011.
Kubitschke A, Bader C, Tillmann HL, Manns MP, Kuhn S, Wedemeyer H: [Injuries from needles contaminated with hepatitis C virus: how high is the risk of seroconversion for medical personnel really?]. Internist (Berl) 2007; 48: 1165–1172.
Kuhar DT, Henderson DK, Struble KA et al.: Updated US Public Health Service guidelines for the management of occupational exposures to human immunodeficiency virus and recommendations for postexposure prophylaxis. Infect Control Hosp Epidemiol 2013; 34: 875–892.
Loerbroks A, Shang L, Angerer P, Li J: Chinese Next Study Group: Psychosocial work characteristics and needle stick and sharps injuries among nurses in China: a prospective study. Int Arch Occup Environ Health 2015; 88: 925–932.
Nienhaus A, Dulon M, Wendeler D: Beruflich bedingte Infektionen im Gesundheitswesen. Arbeitsmed Sozialmed Umweltmed 2017; 52: 35–37.
Rabenau HF, Bannert N, Berger A et al.: Nachweis einer Infektion mit Humanem Immundefizienzvirus (HIV): Serologisches Screening mit nachfolgender Bestätigungsdiagnostik durch Antikörper-basierte Testsysteme und/oder durch HIV-Nukleinsäure-Nachweis: Stellungnahme der Gemeinsamen Diagnostikkommission der Deutschen Vereinigung zur Bekämpfung von Viruskrankheiten e. V.(DVV e. V.) und der Gesellschaft für Virologie e. V. (GfV e. V.). Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz 2015; 58: 877–886.
Remé T: Arbeitsmedizinische Grundlagen für die Konkretisierung von Beweiserleichterungen im Berufskrankheitenfeststellungsverfahren – Fallgruppen und Einzelfallermittlungen. In: Selmair H, Manns MP (Hrsg.): Virushepatitis als Berufskrankheit – Ein Leitfaden zur Begutachtung. Landsberg: ecomed, 2007, S. 227–238.
Riddell A, Kennedy I, Tong CY: Management of sharps injuries in the healthcare setting. BMJ 2015; 351: h3733.
RKI: HIV, Hepatitis B und C bei injizierenden Drogengebrauchenden in Deutschland – Ergebnisse der DRUCK-Studie des RKI. Epidemiologisches Bulletin 2015: 191–197.
RKI: Mitteilung der Ständigen Impfkommission am Robert Koch-Institut (RKI). Empfehlungen der Ständigen Impfkommission (STIKO) am Robert Koch-Institut – 2016/2017. Epidemiologisches Bulletin 2016a: 301–340.
RKI: RKI Ratgeber für Ärzte Hepatitis B und D. 2016b. Retrieved 15.02.2018, from https://www.rki.de/DE/Content/Infekt/EpidBull/Merkblaetter/Ratgeber_HepatitisB.html .
RKI: RKI Ratgeber für Ärzte HIV-Infektion/AIDS. 2016c. Retrieved 15.02.2018, 2016, from https://www.rki.de/DE/Content/Infekt/EpidBull/Merkblaetter/Ratgeber_HIV_AIDS.html .
RKI: Infektionsepidemiologisches Jahrbuch meldepflichtiger Krankheiten für 2016. Berlin: Robert-Koch-Institut, 2017.
RKI: Hepatitis C – RKI-Ratgeber Infektionskrankheiten – Merkblätter für Ärzte. 2018. Retrieved 21.02.2018, from https://www.rki.de/DE/Content/Infekt/EpidBull/Merkblaetter/Ratgeber_HepatitisC.html .
Sarrazin C, Berg T, Ross RS et al.: [Prophylaxis, diagnosis and therapy of hepatitis C virus (HCV) infection: the German guidelines on the management of HCV infection]. Z Gastroenterol 2010; 48: 289–351.
Sarrazin C, Zimmermann T, Berg T et al.: „Prophylaxe, Diagnostik und Therapie der Hepatitis-C-Virus(HCV)-Infektion. AWMF Registernummer 021/012. 2017. Retrieved 06.03.2018, from https://www.awmf.org/uploads/tx_szleitlinien/021-012 l_S3_Hepatitis-C-Virus_HCV-Infektion_2018-02.pdf .
Schillie S, Murphy TV, Sawyer M et al.: CDC guidance for evaluating health-care personnel for hepatitis B virus protection and for administering postexposure management. MMWR Recomm Rep 2013; 62: 1–19.
Vermehren J, Schlosser B, Domke D et al.: High prevalence of anti-HCV antibodies in two metropolitan emergency departments in Germany: a prospective screening analysis of 28,809 patients. PLoS One 2012; 7: e41206.
WHO: Consolidated guidelines on HIV testing services. 5Cs: Consent, confidentiality, counselling, correct results and connection. Geneva: World Health Organization, 2015.
WHO: Guidelines on hepatitis B and C testing. Geneva: World Health Organization, 2017.
Wicker S, Rabenau HF: Infektionsprophylaxe: Update Nadelstichverletzungen. Dtsch Ärztebl 2015; 112: A1883.
Wolffram I, Petroff D, Batz O et al.: Prevalence of elevated ALT values, HBsAg, and anti-HCV in the primary care setting and evaluation of guideline defined hepatitis risk scenarios. J Hepatol 2015; 62: 1256–1264.
Zeuzem S: Treatment Options in Hepatitis C. Dtsch Arztebl Int 2017; 114: 11–21.
Zimmermann R, Siedel J, Simeonova Y, Schmidt D, Dudareva-Vizule S, Bremer V: Hepatitis C im Jahr 2016. Epidemiologisches Bulletin 2016; 2017: 279–290.
Interessenkonflikt: Die Autoren BK, JSt, StJ und JStr waren zum Zeitpunkt der Konsensusfindung beim Unfallversicherungsträger beschäftigt. Alle Autoren geben an, dass keine Interessenkonflikte vorliegen.
Für die Verfasser
Dr. med. Johanna Stranzinger
Berufsgenossenschaft für Gesundheitsdienst und Wohlfahrtspflege (BGW)
Abteilung Arbeitsmedizin, Gefahrstoffe und Gesundheitswissenschaften
Pappelallee 33/ 35/ 37
22089 Hamburg
Fußnoten
1 Berufsgenossenschaft für Gesundheitsdienst und Wohlfahrtspflege (BGW), Gesamtbereich Grundlagen der Prävention und Rehabilitation, Bereich Arbeitsmedizin, Hamburg
2 Betriebsärztlicher Dienst, Klinikum Bremen-Mitte
3 Kompetenzzentrum Epidemiologie und Versorgungsforschung bei Pflegeberufen (CVcare), Universitätsklinikum Hamburg-Eppendorf (UKE)
4 Unfallkasse Berlin, Abteilung Prävention
5 Unfallkasse Nordrhein-Westfalen, Regionaldirektion Rheinland, Hauptabteilung Prävention
6 Fachärztin für Arbeitsmedizin, Breckerfeld
7 Institut für Medizinische Mikrobiologie, Virologie und Hygiene (Direktor: Prof. Dr. med. Martin Aepfelbacher), Universitätsklinikum Hamburg-Eppendorf (UKE)
Zusammenfassung
- Wenn bei verletzten Beschäftigten im Gesundheitsdienst innerhalb der vorangegangenen zehn Jahre das Anti-HBs 100 IE/L war, sind weder Impfungen noch Folgeuntersuchungen auf HBsAg, Anti-HBc oder Anti-HBs notwendig.
- Wenn Anti-HBs in der Vergangenheit immer war oder nie eine Hepatitis-B-Impfung erfolgte, ist nach einem gefährdenden Kontakt (NSV) dringend eine simultane, aktiv-passive HBV-Immunisierung (HB-Simultanimpfung) des Verletzten zu prüfen, vorausgesetzt, die Indexperson wird als infektiös eingestuft oder ist unbekannt und die Unfallumstände lassen eine HBV-Infektionsgefährdung nicht ausschließen. Die HBV-Simultanimpfung des Verletzten wird dann innerhalb von sechs bis maximal 48 Stunden empfohlen (RKI 2016a). In diesen Fällen sollte nach Empfehlung des RKI nicht auf das Laborergebnis (Anti-HBs) gewartet werden. Weitere Untersuchungen auf Anti-HBc und Anti-HBs folgen nach sechs und 12 Wochen sowie sechs Monate nach der NSV. Dies gilt auch für Low-Responder, deren Anti-HBs zum Zeitpunkt der NSV
- Dagegen wird bei Personen, deren Anti-HBs zuletzt vor mehr als zehn Jahren 100 IE/L war oder bei Low-Respondern mit aktuellem Anti-HBs 10 IE/L ausschließlich eine weitere Impfstoffdosis (aktive HBV-Impfung) empfohlen und keine Immunglobulingabe.