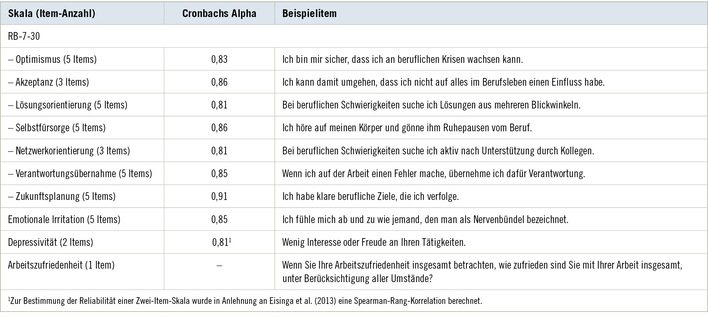
Zur Frage einer unwirksamen Dosis genotoxischer Agenzien
Trotz ständiger Herausforderung durch endogene oder exogene Faktoren, die zu DNA-Schäden führen, wird die zelluläre Homöostase zumindest bei niedriger Exposition aufrechterhalten. Um dies zu gewährleisten, werden je nach Schwere des Schadens verschiedene Mechanismen in Gang gesetzt. Geringe DNA-Schäden werden üblicherweise durch DNA-Reparatur eliminiert, während bei größeren oder irreparablen Schäden Mechanismen wie Apoptose oder Nekrose induziert werden, um zu verhindern, dass der Schaden bei der Zellteilung weitergegeben wird. Diese Mechanismen sind sehr effektiv, denn obwohl pro Zelle und Tag allein durch oxidative Stoffwechselprozesse etwa 10.000 DNA-Läsionen erzeugt werden, enthält die normale Zelle nur etwa 500 veränderte Basen. Obwohl diese Schutzmechanismen zunehmend aufgeklärt sind, gibt es kaum Informationen über Dosis-Wirkungs-Beziehungen und damit ihre Belastbarkeit gegenüber DNA-schädigenden Agenzien. Indem wir die verschiedenen zellulären Abwehrmechanismen und ihre Regulation beschreiben, weisen wir auf die Notwendigkeit hin, bei entsprechenden Untersuchungen Dosis-Wirkungs-Beziehungen zu ermitteln, nicht zuletzt, um das Postulat unwirksamer Konzentrationen auch bei geno-toxischen Kanzerogenen plausibel zu machen. Dies würde auch erlauben, für genotoxische Kanzerogene unwirksame Konzentrationen zu identifizieren und damit gesundheitsbasierte Grenzwerte abzuleiten.
Schlüsselwörter: DNA-Addukte – DNA-Reparatur – Apoptose – Nekrose – DNA Damage Response – Basen-Exzision-Reparatur – genotoxische Kanzerogene – Schwellenwert/NOEL
The question of an ineffective dose of genotoxic agents
Although cellular integrity is constantly threatened by DNA damage arising from numerous intrinsic and environmental sources, cellular homeostasis remains unaffected at least at low dose exposures. To ensure protection of the genome, mammalian cells have developed different mechanisms. Mild DNA damage is normally eliminated by DNA repair; more severe or irreparable DNA damage triggers the induction of cell death programmes such as apoptosis or necrosis to avoid multiplication of damaged DNA by cell division. These mechanisms are quite effective. Whereas endogenous, mostly oxidative metabolism creates about 10,000 DNA lesions per cell per day, the steady state level of DNA adducts of a normal cell is about 500 altered bases. Although these defence mechanisms are increasingly being understood, the critical and rate limiting parameters and their dose response to the insulting agent are poorly evaluated. By describing the different mechanisms and their regulation, we intend to stress the need for such information to further evaluate the plausibility of a dose-dependent and threshold mechanism of genotoxic carcinogens. Besides its scientific value, a better understanding of cellular defence and the onset of such counterbalancing reactions is of regulatory importance, because a scientifically de-fendable threshold concept for genotoxic carcinogens will allow identification of NOAELs and the derivation of health-based exposure limits.
Keywords: DNA adducts – DNA repair – apoptosis – necrosis – DNA damage response – base excision repair – genotoxic carcinogens – threshold value/NOEL
ASU Arbeitsmed Sozialmed Umweltmed 2015; 50: 896–903
Einleitung
Generell wird davon ausgegangen, dass genetische Veränderungen an der Krebsentstehung beteiligt sind und sich für genotoxische Kanzerogene keine unwirksame Konzentration, d. h. kein „no ob-served effect level“ (NOEL), ableiten lässt. Allerdings gibt es aus Tierversuchen viele Hinweise auf unwirksame Konzentration sol-cher Kanzerogene und daran, dass die Dosis-Wirkungs-Kurven von DNA-Addukten und den daraus folgenden Mutationen nicht übereinstimmen; die Dosis-Wirkungs-Kurven der entstehenden Mutationen steigen erst bei höheren Konzentrationen an. Unbestritten ist auch, dass sich bei niedriger Exposition die spontane Mutations-rate nicht mehr erhöht. Dies und die Kenntnis der zellulären Abwehrmechanismen stellen die Annahme infrage, dass auch die geringste Exposition gegenüber einem genotoxischen Kanzerogen das Krebsrisiko erhöhen kann.
Dementsprechend gehen sowohl das wissenschaftliche Experten-gremium der European Food Safety Authority (EFSA 2005) und die drei wissenschaftlichen Kommissionen der Generaldirektion Gesundheit der Europäischen Kommission (EC 2009) davon aus, dass es eine Dosis gibt, unterhalb derer keine genotoxische Wirkung und damit Kanzerogenität mehr auftritt. Von einer nichtlinearen Dosis-Wirkungs-Beziehung wird auch in den Guidelines for Carcinogenic Risk Assessment der US Environmental Protection Agency (EPA 2005) ausgegangen. Darüber hinaus hat Calabrese (2011) die dem Konzept der Linearität der Dosis-Wirkungs-Beziehung mutagener Wirkungen zugrunde liegenden Daten überprüft und festgestellt, dass sie für die Annahme einer Linearität nicht beweisend sind. Es basiert auf Studien an Drosophila, die gegenüber radioaktiven Strah-len exponiert waren und im Einzelnen durchaus auf ein Eintauchen in die spontanen Mutationsraten hinweisen. Dennoch wurde die Nicht-Linearität zunächst für Strahlenkrebs postuliert und 1977 vom US National Academy of Sciences Safe Drinking Water Committee für alle genotoxischen chemischen Kanzerogene übernommen.
Seither haben zahlreiche zumeist deskriptive In-vitro- oder In-vivo-Studien dieses Konzept bestätigt oder widerlegt. Allerdings werden Untersuchungen mit genotoxischen Kanzerogenen, die eine unwirksame Konzentration ergaben, immer wieder dadurch infrage gestellt, dass eine Unterscheidung zwischen Wirkungen bei niedriger Dosierung und der spontanen Tumorrate aufgrund statistischer Probleme nicht möglich ist. Selbst ein Kanzerogenitätsversuch mit 40.800 Forellen hat nach Meinung der Autoren keinen Nachweis einer unwirksamen Konzentration ergeben (Bailey et al 2009). Damit dürfte es kaum möglich sein, anhand solcher Untersuchungen den Beweis für eine unwirksame Dosis von genotoxischen Kanzerogenen zu erbringen. Wir haben es daher für überzeugender angesehen zu überprüfen, mit welchen Abwehrmechanismen die Zelle auf einen durch DNA-reaktive, d. h. genotoxische Kanzerogene ausgelösten Schaden reagiert. Wir haben diese Information zunächst in einem Buch (Greim u. Albertini 2012) und darauf Bezug nehmend in einer Übersichtsarbeit zusammengestellt (Greim u. Albertini 2015), auf die sich die jetzt vorliegende Veröffentlichung bezieht und die auch weitere Literatur zu den Details enthält.
Krebsentstehung durch genotoxische Kanzerogene
Nach Preston und Williams (2005) läuft der initiale Prozess der Krebsentstehung in folgenden Schritten ab:
- Exposition der Zielzellen gegenüber der DNA-reaktiven und da-mit potenziell mutagenen Substanz,
- Reaktion mit der DNA,
- Fehlerhafte Replikation eines geschädigten DNA-Abschnittes oder fehlerhafte Reparatur des DNA-Schadens,
- Mutationen in kritischen Genen der Tochterzellen.
Obwohl viele weitere Schritte bis zur endgültigen Krebsentstehung erforderlich sind, ist davon auszugehen, dass zelluläre Abwehrmechanismen diese ersten Schritte beeinflussen können und damit die Entstehung von Mutationen zumindest bis zu einer bestimmten Expositionshöhe verhindern.
Exposition der Zielzellen
Zunächst bestimmen toxikokinetische Faktoren, d. h. Aufnahme, Ver-teilung, metabolische Aktivierung und Inaktivierung, ob eine potenziell genotoxische Substanz eine Zielzelle erreicht. Ein klassisches Beispiel ist Formaldehyd, eine reaktive Substanz, die im endogenen Stoffwechsel gebildet wird und mit Proteinen und DNA reagiert. Dementsprechend kommt es im Tierversuch bei ausreichend hoher inhalativer Exposition zu Mutationen und Tumoren in Bereichen des direkten Kontakts, d. h. im oberen Atemtrakt. Wie umfangreiche Untersuchungen gezeigt haben, ist Formaldehyd jedoch aufgrund seiner raschen Metabolisierung systemisch nicht verfügbar und kann damit den endogenen Formaldehydpool nicht erhöhen (IARC 2006; Swenberg et al. 2011).
Reaktion mit DNA und DNA-Schaden
Säugetierzellen sind ständig gegenüber DNA-reaktiven Substanzen exponiert. Sie entstehen entweder im endogenen Stoffwechsel (z. B. Acetaldehyd, Ethylenoxid, Formaldehyd oder Isopren) oder bei exogener Exposition (z. B. Acetaldehyd aus Vinylacetat oder Ethylenoxid aus Ethylen). Für Ethylenoxid und Acetaldehyd konnte gezeigt werden, dass bis zu einer bestimmten Exposition die entstehenden DNA-Addukte im Vergleich zu den endogenen nicht signifikant sind. Daraus wird geschlossen, dass sich die Zellen bei niedriger Exposi-tion nicht mit einem zusätzlichen DNA-Schaden auseinandersetzen müssen (Moeller et al. 2013).
Die zelluläre Reaktion auf einen DNA-Schaden
Die Zelle hat verschiedene Mechanismen, um einen DNA-Schaden zu verhindern:
- Metabolische Inaktivierung des reaktiven Agens
- Schutz des genetischen Materials durch Membranen oder durch Proteine, die das reaktive Agens abfangen
- Reparatur der DNA-Läsionen
- Elimination geschädigter Zellen durch Apoptose oder Nekrose.
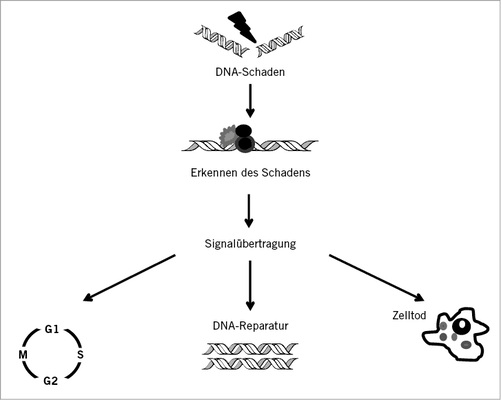
Entsprechend der umfangreichen Literatur wird allgemein aner-kannt, dass die metabolische Inaktivierung endogener und exoge-ner genotoxischer Agenzien die Exposition der kritischen zellulären Strukturen wie der DNA vermindern und Membranen und Prote-ine reaktive Agenzien abfangen. Dazu kommen die verschiedenen DNA-Reparatur-Mechanismen (homologe Rekombination, nicht-homologes End Joining, Nukleotid-Exzisionsreparatur und Mismatch-Reparatur), die in Abhängigkeit vom Zellzyklus aktiv sind, wobei eine DNA-Interaktion während der DNA-Synthese am kri-tischsten ist, da der Schaden auf die Tochterzellen übertragen werden kann. Der gesamte Reparaturprozess wird durch das DNA-Damage-Response-(DDR-)System reguliert, das Reparatur, Zellteilungsrate und die Mechanismen der Apoptose und Nekrose steuert. Im Folgenden werden die einzelnen Mechanismen kurz beschrieben ( Abb. 1 ).
DNA-Reparatur
Bei einem DNA-Schaden wird nicht nur die DNA-Reparatur aktiviert, sondern es kommt gleichzeitig zu einer Reduktion der Zellteilungsrate. Damit wird der Reparatur mehr Zeit gegeben und die Weitergabe von DNA-Schäden an die Tochterzellen verhindert.
Basen-Exzision-Reparatur-(BER-)System
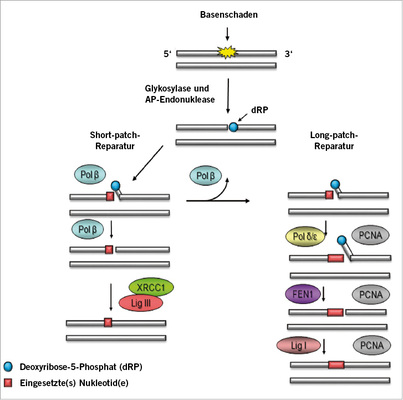
Durch Oxidation und Alkylierungen infolge endogener Stoffwechsel-vorgänge kommt es täglich zu etwa 10.000 DNA-Schäden pro Zelle (Almaida u. Sobol 2007), wobei die oxidativen Schäden aus der Bildung reaktiver Sauerstoffspezies infolge der mitochodrialen Atmung, Cytochrom-P-450-Reaktionen und Entzündungen im Vordergrund stehen, aber auch durch intrazelluläre Metabolisierung von Fremdstoffen einschließlich Arzneimitteln oder ionisierende und UV- Strahlung entstehen (Jezek u. Hlavata 2005). Von den dabei entstehenden reaktiven Sauerstoffspezies (ROS) ist das *OH-Radikal am reaktivsten und für die meisten der dabei entstehen-den oxidativen DNA-Schäden verantwortlich. Nakamura u. Swenberg (1999) gehen sogar davon aus, dass es täglich je nach Gewebe zu bis zu 200.000 DNA-Basenverlusten pro Zelle kommt. Da die normale Zelle nur etwa 500 veränderte Basen ent-hält (Lindahl 1993), wird ersichtlich, welch hohe Kapazität das Basen-Reparatur-System besitzt.
Die meisten der oxidativen DNA-Schäden werden vom BER-System repariert (Izumi et al. 2003; Fromme u. Verdine 2004; Barnes u. Lindahl 2004). Dabei wird der Schaden zunächst von einer Glykosylase erkannt, die die veränderte Base von der Desoxyribose abtrennt. An der apurinen Stelle wird der DNA-Strang von einer Endonuklease aufgetrennt, der apurine Rest von einer Polymerase eliminiert, durch das entsprechende intakte Nukleotid ergänzt und mithilfe einer DNA-Ligase der intakte DNA-Strang wieder hergestellt (Stievers u. Jiang 2003). Gegenwärtig sind 11 für oxidativ veränderte Basen spezifische Glykosylasen bekannt, wobei die Aktivität einzelner Glykosylasen bei ihrem Fehlen durch andere kompensiert werden kann ( Abb. 2 ). Es gibt Hinweise darauf, dass die intakte DNA elektrische Leitfähigkeit besitzt, die bei DNA-Schäden unterbrochen wird, wodurch die an der DNA-Reparatur beteiligten Enzyme angelockt werden (Service 2015).
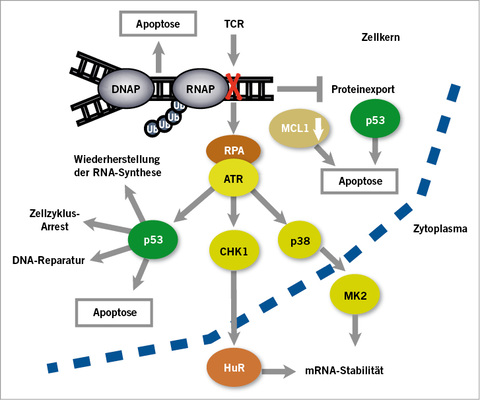
Die auf der DNA gespeicherte Information wird von der RNA abgelesen, die die Synthese spezifischer Proteine an den Proteosomen steuert. An einem DNA-Schaden wird der vom RNA-Polymerase-Komplex gesteuerte Ablesevorgang an der veränderten Base angehalten und aktiviert die transkriptionsabhängige Reparatur („transcription coupled repair“, TCR). Dabei werden Stress-Kinasen aktiviert, wodurch es über eine Aktivierung des Tumorsuppressor-Gens p53 zu einer Blockierung der Zellteilung kommt, bis der DNA-Schaden repariert ist und die RNA-Synthese wieder einsetzt. Die Proteinsynthese kommt allerdings erst dann zum Erliegen, wenn die freie noch im Zytoplasma vorhandene RNA aufgebraucht ist. Ist dieser Pool erschöpft, werden „short lived survival factors“ wie der antiapoptotische Faktor MCL-1 inaktiviert, so dass der bis dahin gehemmte Apoptose-Mechanismus anläuft ( Abb. 3 ).
Bemerkenswert ist, dass auch das BER-System streng kontrolliert ist. Übersteigt die Aktivität seiner wichtigsten Enzyme (XRCC1, Ligase III und Polymerase b) die vorhandenen DNA-Schäden, werden die Enzyme durch Ubiquitin-Ketten markiert und somit von proteosomalen Enzymen erkannt und abgebaut. Bei DNA-Schäden sind die Ubiquitin-Ligasen inaktiviert (Parsons et al. 2008; Meisenberg et al. 2010).
ATM und ATR bei der Reparatur von DNA-Schäden
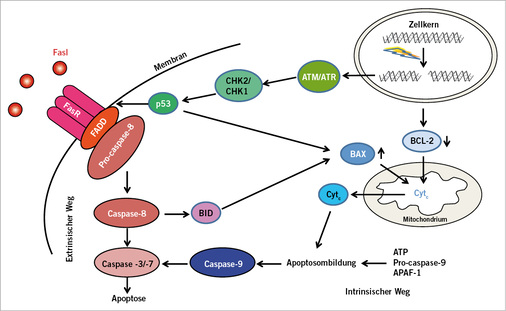
Doppelstrangbrüche (DSB) und DNA-Crosslinks, Schäden, die die DNA-Replikation stoppen, induzieren eine Kaskade von Reparaturmechanismen. Das ATM-Protein („ataxia-telangiectasia mutated protein“) wird durch Doppelstrangbrüche (DSB) aktiviert, das ATR-Protein („ATRad-3 related protein“) von Einzelstrangbrüchen und bei blockierter DNA-Synthese. Beides sind Proteinkinasen und aktivieren verschiedene Mechanismen, die DNA, die Reparatur, Zellteilungsrate und Apoptose steuern ( Abb. 4 ). ATM aktiviert Exo- und Endonukleasen, ATR wird von vom ATRIP („ATR-inter-acting protein“) bei blockierter DNA-Replikation aktiviert und der resultierende Komplex bindet an den RPA-(„replication protein A“-)DNA-Einzelstrang-Komplex. Dies führt zur Phosphorylierung verschiedener Proteine und damit zur homologen Rekombination, so dass der Replikationsblock aufgehoben wird. Eines der phosphorylierten Proteine ist das Histon 2AX, das sich mittels Immunfluoreszenz mikroskopisch nachweisen lässt und als Marker für Doppelstrangbrüche infolge von Genotoxizität und deren Reparatur verwendet wird.
Darüber hinaus steuern ATR und ATM den Zellzyklus vermittels Chk1 und Chk2 (Checkpoint Kinasen 1 und 2). Bei blockierter DNA-Replikation wird Chk1 durch ATR aktiviert, bei Doppelstrang-brüchen Chk2 durch ATM. Beide phosphorylieren auch den Tumorsuppressor p53, der dadurch stabilisiert und nicht abgebaut wird. Dieser Tumorsuppressor aktiviert p21, wodurch die Bildung des Cyclin E-Cdk2-Komplexes gehemmt wird und damit der Eintritt der Zellen in die S-Phase, so dass Zellteilungsrate und DNA-Replikation reduziert werden. Gleichzeitig aktiviert p53 ERCC3, eines der DNA-Exzisions-Enzyme, die geschädigte DNA-Abschnitte erkennen und eliminieren.
Somit spielt p53 eine zentrale Rolle in der Reparatur von DNA-Schäden, da es über verschiedene Mechanismen den Zellzyklus hemmt und die DNA-Reparatur aktiviert. Die Bedeutung der Zellteilungsrate für die Krebsentstehung wurde kürzlich erneut hervor-gehoben (Tomasetti u. Vogelstein 2015). Gewebe mit hoher Zellteilungsrate haben eine höhere Krebsrate als solche mit niedriger. Die Autoren erklären das mit den bei der DNA-Replikation immer auftretenden spontanen DNA-Schäden.
Unterschiedliche Persistenz von DNA-Addukten
Goggin et al. (2011) haben die Persistenz und Reparatur von DNA-Addukten, die bei inhalativer Exposition von Mäusen gegenüber Butadien und metabolischer Aktivierung zu 1,2,3,4-Diepoxibutan ent-stehen, untersucht. Die Halbwertszeit der quantitativ bedeutendsten DNA-Crosslinks (bis-N7G-Butadien) in Leber, Niere und Lunge betrug wenige Tage, während die N7G-N1A-BD- und die 1,N6-HMHP-dA-Addukte persistierten und möglicherweise für die durch Butadien ausgelöste Genotoxizität und Kanzerogenität verantwortlich sind. Obwohl die Untersuchungen zeigen, dass spezifische DNA-Addukte persistieren oder nur langsam eliminiert werden, ist zu berücksichtigen, dass die Butadien-Expositionen hoch waren und niedrigere Dosierungen nicht untersucht wurden, so dass die Möglichkeit besteht, dass bei den hohen Dosierungen die Reparatur-mechanismen übersättigt waren.
Ob langfristige Expositionen im Gegensatz zu akuten zu einer Verminderungen der DNA-Reparaturkapazität führen, ist unklar. Eine diskutierte Möglichkeit ist aber, dass DNA-Reparaturproteine bei einer längerfristigen Exposition durch Mutationen infolge lang-sam akkumulierender DNA-Addukte in ihrer Aktivität beeinträchtigt werden.
Apoptose und Nekrose
Bei schweren oder irreparablen DNA-Schäden werden Programme initiiert, die über die Mechanismen der Apoptose, den programmierten Zelltod, oder Nekrose zum Absterben der Zellen führen. Apoptose wird durch die ATM- und ATR-vermittelte Stabilisierung von p53 aktiviert. Interaktion des p53 mit dem FasR/FADD-Rezeptor aktiviert den Caspase-8-getriggerten Apoptose-Mechanismus. Beim mitochondrialen Mechanismus aktiviert p53 Bax und es kommt zu einer Hemmung von Bcl-2. Freisetzung von Cytochrom C aus den Mitochondrien aktiviert die Apaf-Monomeren, die sich zum Apoptosom zusammenfügen. Dadurch aktiviert Caspase 9 die Caspasen 7 und 3 (Abb. 4). Durch beide Mechanismen wird die Hemmung der DNAse aufgehoben, so dass die DNA gespalten wird und es zur Bildung nukleosomaler Fragmente kommt.
Schwere DNA-Schäden führen auch zu einer Aktivierung von PARP-1, das die mitochondriale Atmung blockiert und zum Absenken von NAD und ATP führt. ATP-Mangel führt zur Nekrose. Da die verschiedenen Mechanismen der Apoptose Energie benötigen, kann Apoptose nur bei intakter mitochondrialer Atmung ablaufen. Damit scheint der zelluläre Energiestatus zu bestimmen, ob es zu Apoptose oder Nekrose kommt. Nekrotische Zellen schwellen an, die Membranen werden durchlässig, es kommt zur Freisetzung zytoplasmatischer Bestandteile und zum Zelltod.
Epigenetische Mechanismen
Die wichtigsten Prozesse der DNA-Reparatur (Erkennen des Scha-dens, Aufschneiden des DNA-Stranges, Elimination der geschädig-ten Base, DNA-Synthese und Verknüpfung des reparierten Stranges) wird über die XRCC1/Ligasekomplex III und die sog. Scaffold-Proteine (Good et al. 2011) gesteuert. Die daran beteiligten Enzymproteine werden wiederum durch epigenetische Mechanismen wie Phosphorylierungen, Acetylierungen, Sumoylierungen, Ubiquitylierungen und Methylierungen reguliert. Diese Posttranlationsmechanismen steuern die Bindungseigenschaften der Enzymproteine, ihren Umsatz sowie ihre subzelluläre Lokalisation und Aktivität. Die Regulierung der wichtigsten am BER-System beteiligten Enzyme durch Ubiquitylierung wurde oben beschrieben. Durch die Methylierung von Histonen werden spezifische chromosomale Regionen an- oder abgeschaltet, wobei die Methylierung selbst über Argonautenproteine gesteuert werden kann. Diese Proteine binden an mikroRNA und kleinere RNA-Abschnitte und reduzieren dadurch die Translation und Stabilität von mRNA. Sie steuern die Aktivität von etwa 30 % aller Gene (Aravin et al. 2007).
Interzelluläre Kommunikation über Gap Junctions
Im Zellverband sind die einzelnen Zellen durch „gap junctions“, d. h. Kanäle miteinander verbunden, über die kleine und hydrophile Moleküle ausgetauscht werden. Es kann davon ausgegangen werden, dass über diesen Austausch eine Vielzahl physiologischer Prozesse gesteuert wird und er damit zur Aufrechterhaltung der Homöostase beiträgt. Die Kanäle bestehen aus 6 Connexineinheiten, deren Synthese in Tumorzellen infolge einer hohen Methylierungsrate des Connexin-Promotors vermindert ist. Während genotoxische Kanzerogene die Funktion der „gap junctions“ nicht zu beeinflussen scheinen, werden sie durch nichtgenotoxische Substanzen wie TCDD, d. h. Tumorpromotoren, beeinflusst, indem sie das Gleichgewicht zwischen Proliferation und Zelltod stören. Inwieweit diese Störung bei niedriger Exposition gegenüber solchen Promotoren z. B. durch gesteigerte Connexinsynthese gegenreguliert wird, wurde bisher nicht untersucht.
Beispiele für dosisabhängige Reaktionen bei Genotoxizität
Die bisher vorliegenden Beispiele betreffen vor allem die unterschiedlichen Dosis-Wirkungs-Kurven zwischen DNA-Addukten und Mutationen. Daraus wird geschlossen, dass DNA-Addukte als Marker für eine Exposition anzusehen sind, aber als solche noch keine Genotoxizität bedeuten. Dies trifft erst für die daraus entstehenden Mutationen zu, die bei höherer Exposition auftreten. Dies ist in mehreren Beispielen gezeigt worden.
Nach Exposition transgener Big-Blue-Ratten gegenüber Cyproteron-Acetat stiegen die DNA-Addukte zwischen 25 und 75 mg/kg linear an, die Mutationsrate erst ab 75 mg/kg (Krebs et al. 1998). In früheren Studien zeigten Schulte-Herrmann et al. (1980), dass DNA- und RNA-Synthese, Mitoserate und Lebervergrößerung erst ab 40–100 mg/kg Cyproteron-Acetat anstiegen. Die Autoren schlossen daraus, dass aus DNA-Addukten erst dann Mutationen entstehen, wenn bei höherer Dosierung eine mitogene Wirkung hinzukommt, d. h. die Zellteilungsrate stimuliert wird.
Auch für Vinylchlorid wurde eine entsprechende Parallelität der Dosis-Wirkungs-Kurven zwischen DNA-Addukten und dem Auftreten von Tumoren gezeigt, wobei die DNA-Veränderungen im Vergleich zu den Tumoren noch bei niedrigeren Dosierungen nachweis-bar waren (Rozman et al. 1996).
Nach einer Behandlung von CD1- und Muta TM -Mäusen mit EMS (Ethylmethansulfonat) betrugen die NOAELs für die klastogene Wirkung bei der CD-Maus 80 mg/kg und 25 mg/kg für die Induktio-nen von Mutationen in Knochenmarkzellen bei den Muta TM -Mäusen, während Ethyl-Addukte an den Proteinen und der DNA bei niedrigeren Konzentrationen nachweisbar waren (Gocke et al. 2009).
Sowohl in vitro als auch in vivo konnte für das direkte Alkylans Methylmethansulfonat ein NOGEL („no observed genotoxic effect level“) nachgewiesen werden, was mit einer Aktivierung der O 6 MeG-DNA Methyltransferase (MGMT) korrelierte (Doak et al. 2008).
Thomas et al. (2013) untersuchten die dosisabhängige Muta-genität des direkten Alkylans Methylnitrosoharnstoff in Säugetierzellen in vitro. Der NOGEL von 0,0075 g/ml verschob sich nach der Inaktivierung der MGMT nach links, d. h. nach Ausschalten der DNA-Reparatur war die Mutationsrate erhöht.
Bei ihren Untersuchungen über die Korrelierbarkeit von Adduk-ten mit Mutationen nach Exposition gegenüber DNA-reaktiven Substanzen wie Ethylenoxid oder Formaldehyd zeigte die Gruppe um Swenberg, dass Mutationen erst bei höheren Expositionen als die Addukte induziert werden (Swenberg et al. 2008; Moeller et al. 2013). Daraus schließen sie, dass Addukte als Biomarker einer Exposition an-zusehen sind, die sich linear bis zu niedrigster Exposition verfolgen lassen und dann niedriger sind als die spontane Adduktrate. Muta-tionen als Biomarker für Genotoxizität werden erst bei höherer Dosis induziert und korrelieren erst dann mit der Exposition, wenn sie die spontane Mutationsrate übersteigen.
In einer kürzlich veröffentlichten Studie haben Williams et al. (2015) Ratten 16 Wochen lang mit dem genotoxischen Kanzerogen Acetylaminofluoren behandelt. Nach Versuchsende induzierte die kumulative Dosis von 0,125 mg/kg 0,6 pro 10 8 spezifisch veränderte Nukleotide bei 1–3,1 pro 10 8 veränderten Nukleotiden in der Kontrollgruppe. Diese Dosis wurde als NOAEL angesehen.
Schlussfolgerung
Normal funktionierende Zellen sind ständig gegenüber DNA-reakti-ven Substanzen exponiert, die wie Ethylenoxid oder reaktive Sauerstoffspezies (ROS) zumeist endogen gebildet werden. Dazu kommen Schäden infolge fehlerhafter Reparatur und exogen ausgelöste Schä-den z. B. durch ionisierende Strahlung, Virusinfekte oder reaktive genotoxische Chemikalien. Die zelluläre Homöostase wird jedoch durch mehrere effiziente Mechanismen aufrechterhalten. Dazu gehören
- toxikokinetische Faktoren, die verhindern, dass das reaktive Agens die DNA erreicht, wie metabolische Inaktivierung, Reaktion mit Proteinen, durch Membranen gehinderter Zugang zur DNA;
- enzymatische intrazelluläre Entgiftungsmechanismen, die reaktive Agenzien wie reaktive Sauerstoffspezies nicht über physio-logische Konzentrationen hinaus ansteigen lassen;
- ein effizientes System, das DNA-Schäden nicht über das physio-logische Gleichgewicht ansteigen lässt. Dadurch werden die stän-dig auftretenden DNA-Schäden repariert, wobei die Wirkung durch Hemmung der Zellproliferation verstärkt wird. Dadurch ergibt sich einerseits mehr Zeit für die Reparatur, andererseits wird verhindert, dass Schäden des Genoms durch die Zellteilung weitergegeben werden.
- Elimination schwer geschädigter Zellen durch Apoptose und Nekrose.
In einer Zelle liegen im Gleichgewichtszustand etwa 500 veränderte Basen vor, was etwa 1 Läsion pro 10 6 Basen entspricht. Täglich werden jedoch etwa 10.000 Basen verändert, was die hohe Effizienz dieser Reparatursysteme belegt. Da man zumindest generell davon ausgehen kann, dass die durch endogene und exogene Agenzien ausgelösten DNA-Schäden identisch sind, bedeutet dies, dass kleinere zusätzliche exogene Belastungen repariert werden und nicht zu Mutationen führen.
Hinzu kommt, dass bei schweren DNA-Schäden die so genannten Todesprogramme induziert werden, die über Apoptose oder Nekrose zu einer Elimination der Zellen mit nicht mehr reparabler DNA führen.
Es ist daher nicht plausibel, dass geringe Expositionen gegenüber genotoxischen Chemikalien zu einer Störung der intrazellulären Homöostase führen und damit die spontane Mutationsrate und die Entartung zu Krebszellen erhöhen.
Obwohl in einer großen Anzahl von Studien die einzelnen Me-chanismen zur Elimination veränderter DNA und geschädigter Zel-len untersucht worden sind, fehlen zumeist Angaben zur Dosisabhängigkeit des An- oder Abschaltens der einzelnen Reaktionen, so dass daraus keine Hinweise auf eine Konzentration ableitbar sind, bei denen keine Wirkung auftritt oder das System übersättigt, d. h. an die Grenze seiner Belastbarkeit gekommen ist. Letzteres ist schon deshalb interessant, weil in vielen Kanzerogenitätsstudien Wirkungen erst bei sehr hoher Exposition auftreten, die einerseits für den Menschen irrelevant sind, es sich andererseits aber um Versuchsbedingungen handelt, bei denen die von uns beschriebenen zellulären Abwehrmechanismen überfordert sein können und damit für die Exposition des Menschen ebenfalls nicht relevant sind. Dennoch werden Stoffe, die unter solchen Bedingungen im Tierversuch zu Tumoren geführt haben als kanzerogen eingestuft.
Literatur
Almaida KH, Sobol RW: A unified view of base excision repair: Lesion-dependent protein complexes regulated by post-translational modification. DNA Repair 2007; 6: 695–711.
Aravin AA, Hannon GJ, Brennecke J: The PiWi-piRNA pathway provides an andaptive defense in the transoson arms race. Science 2007; 318: 761–764.
Barnes DE, Lindahl: Repair and genetic consequences of endogenous DNA base damage in mammalian cells. Annu Rev Genet 2004; 38: 445–476.
Bailey GS, Reddy AP, Pereira CB, Harttig U, Baird JM, Spitsbergen JM, Hen-dricks JD, Orner GA, Williams DE, Swenberg JA: Nonlinear cancer response of ultralow dose: a 40.800-animal ED001 tumour and biomarker study. Chem Res Toxicol 2009; 22: 1264–1276.
Calabrese EJ: Key studies to support cancer risk assessment questioned. Environ Mol Mutagen 2011; 52: 595–606.
Doak SH, Brusehafer K, Dudley E, Quick E, Johnson G, Newton RP, Jenkins GJ: No-observed effect levels are associated with up-regulation of MGMT following MMS exposure. Mutat Res 2008; 648: 9–14.
EC (European Commission): Risk Assessment Methodologies and Approaches for Genotoxic and Carcinogenic Substances. Joint opinion of the Scientific Committee on Health and Environmental Risks (SCHER), Scientific Committee on Consumer Products (SCPP) and Scientific Committee on Emerging and Newly Identified Risks (SCENIHR), Health and Consumer Protection Directorate, 2009.
EFSA (European Food Safety Authority): Opinion of the Scientific Committee on a Request from EFSA related to a harmonised approach for riskassessment of substances which are both genotoxic and carcinogenic. EFSA Journal 2005; 282: 1–31.
EPA (US Environmental Protection Agency): Guidelines for Carcinogenic Risk Assessment, Washington DC, 2005.
Fromme JC, Verdine GL: Base excision repair. Adv Protein Chem 2004; 69: 1–41.
Gocke E, Ballantyne M, Whitwell J, Müller L: MNT and MutaTMmouse studies to define the in vivo dose response relations of the genotoxicity of EMS and ENU. Toxicol Lett 2009; 190: 286–297.
Goggin M, Sangaraju D, Walker VE, Wickliffe J, Swenberg JA, Tretyakova N: Persistence and repair of bifunctional DNA adducts in tissues of laboratory animals exposed to 1,3-Butadiene by inhalation. Chem Res Toxicol 2011; 24: 809–817.
Good MC, Zalatan JG, Lim WA: Scaffold proteins: Hubs for controlling the flow of cellular information. Science 2011; 332: 680–686.
Greim H, Albertini RJ: The cellular response to the genotoxic impact: The ques-tion of threshold for genotoxic carcinogens. RSC Publishing, 2012.
Greim H, Albertini RJ: Cellular response to the genotoxic impact: The question of threshold for genotoxic carcinogens. Toxicol Res 2015; 4: 36–45.
IARC: Monographs on the Evaluation of the Carcinogenic Risks to Humans, Vol. 88, Formaldehyde. Lyon: WHO, 2006.
Izumi T, Wiederholt LR, Roy G, Roy R, Jaisval A, Bhakat KK, Mitra S, Hazra TK: Mammalian DNA base excision repair proteins: their interactions and role in repair of oxidative DNA damage. Toxicol 2003; 193: 43–65.
Jezek P, Hlavata L: Mitochondria in homeostasis of reactive oxygen species in cell, tissues, and organism. Int J Biochem Cell Biol 2005; 37: 2478–2503.
Krebs O, Schäfer B, Wolff T, Oesterle D, Deml E, Sund M, Favor J: The DNA-damaging drug cyproterone acetate causes gene mutations and induces gluta-thione-S-transferase P in the liver of female big BlueTM transgeneic F344 rats. Carcinogenesis 1998; 19: 241–245.
Lindahl T: Instability and decay of the primary structure of DNA. Nature 1993; 362: 709–715.
Meisenberg C, Tait PS, Dianova II, Wrigth K, Edelmann MJ, Ternette N, Tasaki T, Kessler BM, Parsons JL, Kwon YT, Dianov GL: Ubiquitin ligase UBR3 regulates cellular levels oft he essential DNA repair protein APE1 andis required for genome stability. Nucleic Acid Res 2012; 40: 701–711.
Moeller BC, Recio L, Green A, Sun W, Wright FA, Bodnar WM, Swenberg JA: Biomarkers of exposure and effect in human lymphoblasoid TK6 cells following [13C2]-acetaldehyde exposure. Toxicol Sci 2013; 133: 1–12.
Nakamura J, Swenberg JA: Endogenous apurinic/apyrimidinic sites in genomic DNA of mammalian tissues. Cancer Res 1999; 59: 2522–2526.
Parsons JL, Tait PS, Finch D, Dianova II, Allison SL, Dianov GL: CHIP-mediated degradation and DNA damage-dependent stabilization regulate base excision repair proteins. Mol Cell 2008; 29: 477–487.
Preston RJ, Williams GM: DNA-reactive carcinogens: Mode of action and human cancer hazard. Crit Rev Toxicol 2005; 35: 673–683.
Rozman KK, Kerecsen L, Viluksela MK, Österle D, Deml E, Vilksela M, Stahl BU, Greim H, Doull J: A oxicologists’ view of cancer risk assessment. Drug Metab Rev 1996; 28: 29–52.
Schulte-Herrmann R, Hoffman V, Parzefall W, Kallenbach M, Gerhardt A, Schupp-ler J: Adaptive response of rat liver tot he gestagen and antiandrogen cyproterone acetate and other inducers, II, Induction and growth. Chem-biol Inetract 1980; 31: 287–300.
Service RF: Live wire. Do cells use electricity to repair DNA? Science 2015; 346: 1284–1287.
Swenberg JA, Fryar-Tita E, Jeong YC, Boyson G, Starr T, Walker VE, Albertini RJ: Biomarkers in toxicology and risk assessment: Informing critical dose-response re-lationships. Chem Res Toxicol 2008; 21: 253–265.
Swenberg JA, Lu K, Moeller BC, Gao L, Upton PB, Nakamura J, Starr TB: Endo-genous versus exogenous DNA adducts: Their role in carcinogenesis, epidemiology, and risk assessment. Toxicol Sci 2011; 120: S130–S145.
Stievers JT, Jiang YL: A mechanistic perspective on the chemistry of DNA repair glycosylases. Chem Rev 2003; 103: 2729–2759.
Thomas AD, Jenkins GJ, Kaina B, Bodger OG, Tomaszowski KH, Lewis PD, Doak SH, Johnson GE: Influence of DNA repair on nonlinear dose-responses for mutation. Toxicol Sci 2013; 132: 87–95.
Tomasetti C, Vogelsten B: Variation in cancer risk among tissues can be explained by the number of stem cell divisions. Science 2015; 347: 78–80.
Williams GM, Iatropoulos MJ, Jeffrey AM: Mechanistic basis for nonlinearities and thresholds in rat liver carcinogenesis by the DNA-reactive carcinogens 2-acetyl-aminouorene and diethylnitrosamine. Toxicol Pathol 2000; 28: 388–395.
Williams GM, Duan J-D, Iatropulos MJ: A no observed effect level for DNA adduct formation in rat liver with prolonged dosing of the hepatocarcinogen 2-acetylamini-fluorene. Toxicol Res 2015 in the press
Interessenkonflikt: Für beide Autoren besteht kein Interessenkonflikt.
Für die Verfasser
Prof. Dr. med. Helmut Greim
Institut für Toxikologie und Umwelthygiene
Technische Universität München
Hohenbachernstraße 15–17
85350 Freising-Weihenstephan
Fußnoten
1 Institut für Toxikologie und Umwelthygiene (Direktor: Univ.-Prof. Dr. med. Martin Göttlicher), Technische Universität München
2 Department of VCC Genetic Toxicology Lab, University of Vermont, Burlington, Vermont, USA