Berufsbedingte exogen-allergische Alveolitis
Die Krankheitsbilder der exogen-allergischen Alveolitis (EAA) wie die Farmer-lunge, Befeuchterlunge oder Holzarbeiterlunge sind häufig berufsbedingt. Da die EAA eine seltene Krankheit („orphan disease“) ist, die sich oft mit anderen interstitiellen Lungenkrankheiten überlappt, kann die Diagnostik und Begutachtung große Schwierigkeiten machen. Daher wird die berufsbedingte EAA hier auf dem aktuellen Wissensstand umfangreich dargestellt, insbesondere im Hinblick auf neue Antigene. Neue eigene Erkenntnisse zur Wertigkeit der IgG-Antikörper werden hier erstmals vorgestellt.
Schlüsselwörter: exogen-allergische Alveolitis – Berufskrankheit – Farmerlunge – IgG-Antikörper – Antigene
Work-related extrinsic allergic alveolitis
Conditions like farmer’s lung, humidifier lung, woodworker’s lung and other types of extrinsic allergic alveolitis- EAA (hypersensitivity pneumonitis) are frequently related to occupation. Since they are rare diseases (orphan diseases) which often overlap with other interstitial lung diseases, the diagnosis and assessment (expert opinion) of these conditions may be difficult. Therefore, we give an extensive account of occupational extrinsic allergic alveolitis based on latest scientific findings, particularly with regard to new antigens. We also provide our own insights into the significance of IgG anti-bodies for the first time.
Keywords: extrinsic allergic alveolitis – hypersensitivity pneumonitis – occu-pational lung disease – farmer’s lung – IgG antibody – antigens
ASU Arbeitsmed Sozialmed Umweltmed 2015; 50: 38–52
Für die Arbeitsmedizin ist die wachsende Anzahl seltener berufsbedingter exogen-allergischer Alveolitiden eine diagnostische und gutachterliche Herausforderung. Dieser Beitrag hat sich zum Ziel gesetzt, die heutigen Möglichkeiten der Diagnostik aufzuzeigen, Ratschläge zur Begutachtung zu geben, alle zur Zeit bekannten Berufsantigene und berufsbedingten Krankheitsbilder aufzulisten (Antigenkatalog) sowie aktuelle eigene Untersuchungen zur Beurteilung der IgG-Antikörper mitzuteilen. Die meiste Originalliteratur hierzu finden Sie in der umfangreichen deutsch- oder der aktuelleren englischsprachigen Monographie von J. Sennekamp: Exogen-allergische Alveolitis 1998 bzw. 2004, und bei Sennekamp 2007.
Einführung
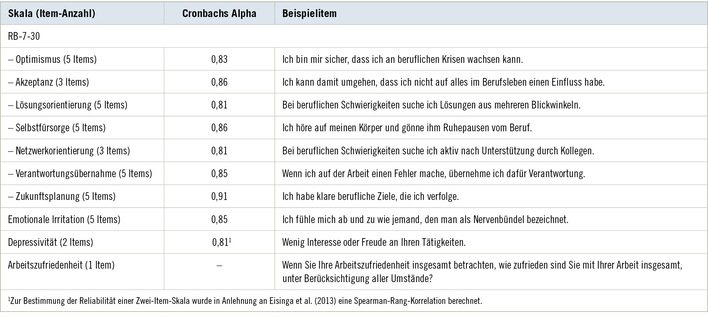
Die exogen-allergische Alveolitis (EAA) (engl. „extrinsic allergic al-veolitis“ oder „hypersensitivity pneumonitis“) ist eine allergische Entzündung der Alveolen in den Lungen. Sie ist eine kombinierte ver-zögerte und späte Immunreaktion auf exogene Antigene (Allergene), die eingeatmet werden oder über die Blutbahn (z. B. Medikamente) ins Alveolargewebe gelangen. Diese allergische Entzündung verursacht Dyspnoe, Husten, Fieber, Schwäche, Frösteln bis Schüttelfrost und zahlreiche weitere klinische und Laborbefunde, von denen die häufigsten in Abb. 1 aufgeführt sind.
Die Antigene sind Vogelstäube, Bakterien und Schimmelpilze; seltener sind es auch pflanzliche Stäube, Hefe- und Speisepilzsporen, Chemikalien und Arzneimittel. Sie rufen die Vogelhalterlunge, die Farmerlunge, die Befeuchterlunge und viele seltene Krankheitsbilder hervor, die am Ende dieses Beitrags ausführlich in einem Katalog aufgelistet sind.
Insgesamt ist die EAA zwar eine seltene Krankheit („orphan disease“), aber nur bei wenigen anderen Krankheiten ist ein so hoher Anteil berufsbedingt, wie bei der EAA.
Die in der Regel nicht berufsbedingte Vogelhalterlunge ist mit Abstand die häufigste EAA, vor allem die Taubenzüchterlunge und die Wellensittichhalterlunge. In den letzten Jahren wird zunehmend häufiger die Bettfedern-Alveolitis diagnostiziert, was auch nicht verwundert, da viele Menschen in Federbetten schlafen (Morell et al. 2008).
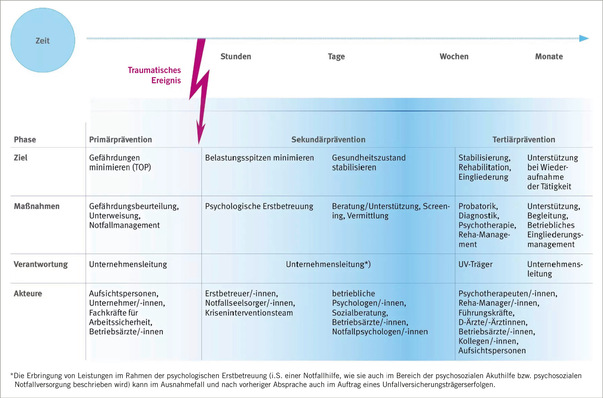
Im Gegensatz zum klassischen Asthma setzen die klinischen Symptome erst zwischen dreieinhalb und zwölf Stunden nach Kontakt mit dem Allergen ein, denn es han-delt sich hier um eine verzögerte allergische Reaktion, also um eine IgG-vermittelte granulozytäre und eine daran anschließende lymphozytäre Immunreaktion und nicht um eine IgE-vermittelte Reaktion ( Abb. 2 ).
Bei Patienten mit einer EAA kann jedoch auch gleichzeitig ein allergisches Asthma vom Sofort- oder Spätreaktionstyp vorliegen.
Die klinische Symptomatik der EAA ähnelt der einer Pneumonie mit auskultierbaren Rasselgeräuschen über der Lungenbasis. Daher verwenden die Amerikaner den Begriff „hypersensitivity pneumonitis“ (HP), der weltweit zunehmend häufiger verwendet wird.
Man unterscheidet eine akute, subakute oder chronische Verlaufsform der EAA (Costabel et al. 2012). Neuerdings wird oft auch nur noch von der akuten und der chronischen Verlaufsform gesprochen, da sich die subakute schlecht abgrenzen lässt.
Ab einer Krankheitsdauer von einem Jahr, insbesondere bei der chronischen Verlaufsform, kann die Alveolitis in einen fibrotischen und/oder emphysematösen Umbau der Lunge münden, was dann auch radiologisch und funktionell nachweisbar ist. Fibrose und/oder Emphysem sind jedoch bei der EAA nicht obligat (Ochmann et al. 2014; Sennekamp 2004).
Körperliche Untersuchung
Bei der klinischen Untersuchung der Lunge fällt häufig ein basales inspiratorisches Knisterrasseln auf, das ein wichtiges klinisches Merkmal der EAA darstellt.
Die Körpertemperatur kann in der akuten Krankheitsphase (nach Antigeninhalation) bis auf über 40 °C erhöht sein. Häufig ist auch eine Tachypnoe zu beobachten.
Giemen, Brummen und Pfeifen als Ausdruck einer zusätzlichen Bronchialobstruktion infolge Übergreifens der allergischen Alveolitis auf die Bronchiolen (Bronchioloalveolitis) kommen bei einem Viertel der Patienten vor (Sennekamp u. Forster 2012).
Trommelschlägelfinger und Zyanose können sich bei langem Krankheitsverlauf, insbesondere bei Fibrose und Emphysem, entwickeln.
Wichtig ist nun herauszufinden, ob diese klinischen Symptome und die vom Patienten angegebenen Beschwerden (s. Abb. 1) in zeitlichem Zusammenhang mit dem Antigenkontakt stehen. Bei Verdacht bietet sich die Empfehlung an, den Patienten das verdächtige Antigen probeweise meiden zu lassen.
Laborparameter
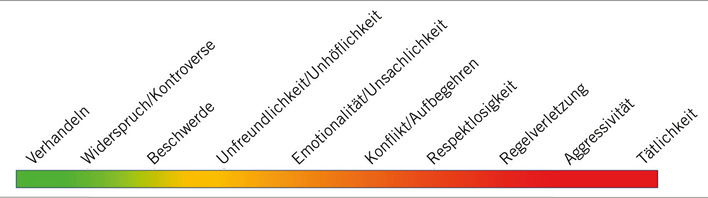
Unspezifische Entzündungszeichen wie eine Leukozytose mit vermehrten neutrophilen, aber nicht eosinophilen Granulozyten, eine erhöhte LDH, ein erhöhtes C-reaktives Protein, eine beschleunigte Blutkörperchensenkung und ein erhöhter Serum-IgG-Spiegel (Hypergammaglobulinämie) kommen in der Mehrzahl der Fälle vor ( Abb. 3 ). Zudem sind oft das ACE und der IL-2-Rezeptor geringgradig erhöht (granulomatöse Erkrankung).
Eosinophilie und erhöhtes Gesamt-IgE hingegen sind keine Merkmale der EAA.
Röntgen
Im konventionellen Röntgen-Thorax sind am häufigsten noduläre und retikulonoduläre Infiltrate sowie milchglasartige Trübungen zu sehen. Im Endstadium der fibrosierenden EAA kommen Fibrose, Emphysem, Bullae, deformierende Bronchiolitis/Bronchitis und Zeichen der Rechtsherzbelastung vor. In 20–30 % ist das konventionelle Röntgenbild bei der EAA unauffällig.
Hier führt die hochauflösende Spiral- oder HR-CT (High Resolution Computer-Tomographie) der Lunge weiter, die außerdem eine bessere Abgrenzung zu anderen interstitiellen Lungenkrankheiten wie Sarkoidose oder idiopathischer Lungenfibrose (IPF) ermöglicht.
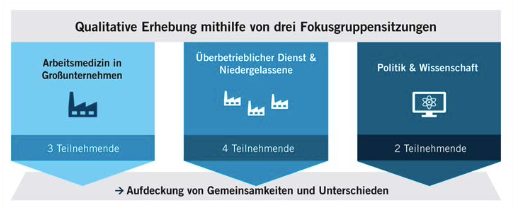
Die wichtigsten radiologischen Zeichen in der HR-CT sind Milch-glastrübung ( Abb. 4 ), noduläre Infiltrate und Fibrose. Seltener sind Honigwabenbildung, Emphysem und erweiterte Pulmonal-arterien als Hinweis auf pulmonale Hypertonie. Auf einen Mitbefall der Bronchiolen und Bronchien weisen das Blütenzweig-Zeichen („tree in bud“), Mosaikmuster und Überblähungsareale (Airtrapp-ing) hin (Hirschmann et al. 2009).
Das früher nur histologisch erkennbare UIP-Muster der Lunge lässt sich heute auch mit der HR-CT erkennen (Costabel et al. 2012).
Lungenfunktion, Blutgase und Pulmonalisdruck
Die Lungenfunktionsmessung zeigt typischerweise eine verminderte Total- und Vitalkapazität bei normalem oder vermindertem Residualvolumen an (restriktive Lungenfunktionsstörung).
Die Gasaustauschstörung infolge der verdickten Alveolarwände (lymphozytäre Infiltration) gibt sich als erniedrigte Diffusionskapazität (DCO) oder in der Blutgasanalyse als Hypoxämie zu erkennen. Besonders sensitiv ist die Messung des arteriellen Sauerstoffpartialdruckes (pO2) unter körperlicher Belastung.
In der Spiroergometrie zeigen sich eine erhöhte aaDO2 (alveolo-arterielle Sauerstoffpartialdruckdifferenz), eine vermehrte Totraumventilation und eine eingeschränkte Atemreserve (Kroidl 2006).
Hat die entzündliche Immunreaktion auch die Bronchiolen und Bronchien miterfasst (Bronchioloalveolitis), so kann die Lungenfunktionsmessung zusätzlich eine Obstruktion (erniedrigte FEV1, erniedrigte MEF25–75-Werte, erhöhter Atemwiderstand) anzeigen. Dabei besteht oft eine Lungenüberblähung mit einem erhöhten Residualvolumen, im Spätstadium auch ein Emphysem (Ochmann et al. 2014).
Selten kommt eine exogen-allergische Bronchiolobronchitis bei fehlenden funktionellen Anzeichen einer Alveolitis, d. h. bei normalen Lungenvolumina, normalen Blutgasen und normaler Sauerstoffdiffusion vor (Sennekamp u. Forster 2012).
Eine unspezifische bronchiale Hyperreagibilität, z. B. im Metacholintest, kommt nicht nur beim Asthma und dem ODTS (Organic Dust Toxic Syndrome) vor, sondern auch bei Patienten mit EAA (Sennekamp 1998, 2004, 2008).
Ein erhöhter Druck in der Arteria pulmonalis zeigt sich besonders bei der chronischen Verlaufsform und im Fibrosestadium in ca. 20 % der Fälle. Der Pulmonalisdruck kann bei Vorliegen einer Trikuspidalinsuffizienz mittels transthorakaler Echokardiographie und als Goldstandard durch einen Rechtsherzkatheter bestimmt werden (Koschel et al. 2012).
Immunologie
Die serologische Diagnostik erfasst die spezifischen IgG-Antikörper (Präzipitine) gegen die Antigene der EAA. Heute werden dafür die sensitiven Techniken des Enzym-Immunoassays (ELISA) und des Fluoreszenz-Immunoassays (FEIA) eingesetzt. Damit werden bei bis zu 95 % der Patienten mit EAA spezifische IgG-Antikörper gefunden. Eine sog. „seronegative EAA“ ohne Nachweis von spezifischen IgG-Antikörpern ist somit selten.
Wird das Allergen (Antigen) vom Patienten gemieden (Karenz), so zeigt sich in der Regel bereits innerhalb von 2 Monaten ein Abfall der Antikörperkonzentration. Im weiteren Verlauf können die Antikörper unter kompletter Allergenkarenz vollständig verschwinden. Eine orale Steroidtherapie beeinflusst die IgG-Antikörper nicht (Sennekamp 1998, 2004).
Antigenspezifische IgG-Antikörper kommen auch bei gesunden antigenexponierten Personen, in der Regel nur in geringer Konzentration, vor. Diese Antikörper können diagnostisch als Expositions-marker angesehen werden, was in der Arbeitsmedizin beispielsweise bei Getreidearbeitern von Bedeutung ist (Raulf-Heimsoth et al. 2008). Somit sind die IgG-Antikörper nicht die Ursache der EAA; vielmehr wird die Krankheit durch antigenspezifische T-Lympho-zyten (CD4-Lymphozyten) verursacht (Sennekamp 1998, 2004).
Bronchoalveoläre Lavage (BAL)
Während einer Bronchoskopie erfolgt eine Spülung mit mindestens 100 ml Spülflüssigkeit in einem okkludierbaren Areal (vorzugsweise Mittellappen, wenn dieser radiologisch betroffen ist) mit Rückgewinnung der Bronchial- und Alveolarflüssigkeit (bronchoalveoläre Lavage), wodurch sich die Zellen in den Alveolen und Bronchien beurteilen lassen.
Die Gesamtzellzahl der bronchoalveolären Lavage (BAL) ist bei der von Inhalationsantigenen verursachten EAA auf das Zwei- bis Neunfache – im Mittel um das Fünffache – gesunder nichtrauchen-der Kontrollpersonen erhöht. Die Gesamtzellzahl hängt vom Grad der Sensibilisierung, der Intensität des Antigenkontakts und dem zeitlichen Abstand vom letzten Antigenkontakt ab. Je länger der Abstand, desto niedriger die Zellzahl. Von allen interstitiellen Lungen-krankheiten hat die EAA die höchste Gesamtzellzahl in der BAL.
Die Lymphozyten der BAL sind bei der EAA fast immer vermehrt. Während sie bei gesunden Nichtrauchern 5–10 % der BAL-Zellen ausmachen, überschreiten sie bei der EAA in der Regel 30 %. Ähnlich wie bei den Antikörpern wird auch eine leichte Lymphozytose in der BAL (
Die T-Lymphozyten sind deutlicher als die B-Lymphozyten ver-mehrt. Schlüsselt man die T-Lymphozyten in CD4- und CD8-positive Lymphozyten auf, so überwiegen bei der akuten EAA meist die CD8-T-Lymphozyten. Damit ist typischerweise der CD4/CD8-Quotient bei der akuten EAA erniedrigt (unter 1,3). Bei der chronischen Verlaufsform hingegen ist der CD4/CD8-Quotient oft erhöht (Costabel et al. 2012).
Weitere Merkmale der Lavage bei einer EAA sind vermehrte Mastzellen, Plasmazellen und schaumige Makrophagen (Schaumzellen).
Die neutrophilen Granulozyten sind an den ersten beiden Tagen einer erneuten Antigenexposition bei gleichzeitiger Lymphozytose vermehrt und normalisieren sich in den nächsten Tagen. Eine permanente neutrophile Granulozytose in der BAL bei der chronischen Verlaufsform hingegen ist ein prognostisch schlechtes Zeichen (Costabel et al. 2012).
Eine Eosinophilie liegt in der Regel nicht vor.
Histologie
Eine Verbreiterung der Alveolarsepten der Lunge durch Infiltration von Entzündungszellen ist das häufigste histologische Merkmal (murale Alveolitis; Tabelle 1 , Abb. 5 ). Die Infiltration der Septen besteht in erster Linie aus Lymphozyten. Meistens werden auch Zellen ins Alveolarlumen abgestoßen, insbesondere schaumig aufgetriebene Makrophagen (Schaumzellen), Mastzellen und Plasmazellen, die auch in der bronchoalveolären Lavage zu finden sind (luminale oder desquamative Alveolitis).
Granulome (nicht nekrotisierend, häufig mit Fremdkörpereinschlüssen) werden in 68 % der Fälle gefunden (s. Tabelle 1, Abb. 5). Wegen der Granulome gehört die EAA in die Gruppe der granulomatösen interstitiellen Lungenkrankheiten, auch wenn sich nicht in jedem Falle Granulome nachweisen lassen.
Die Bronchiolen und weniger ausgeprägt die Bronchien sind histologisch meist mitbefallen, obgleich funktionell eine Bronchialobstruktion nur bei einem Viertel der Patienten nachweisbar ist.
Häufig sind intraalveoläre Bindegewebsknospen, sog. Masson-Körperchen („buds“), zu beobachten, was auch als BOOP-Reak-tion (Bronchiolitis obliterans mit organisierender Pneumonie) bezeichnet wird. Davon abzugrenzen ist die eigenständige Krankheit BOOP, die heute besser als COP (cryptogene organisierende Pneumonie) bezeichnet wird (Amthor 2003).
Ab einer Krankheitsdauer von einem Jahr können sich nichtreversible Lungenschäden in Form einer Lungenfibrose oder eines Lungenemphysems gebildet haben, die histologisch bereits nachweisbar sein können, wenn sie radiologisch und funktionell noch nicht erkennbar sind. Das Emphysem ist besonders häufig bei der Farmerlunge zu finden (Ochmann et al. 2013).
Da die transbronchiale Lungenbiopsie in fast 50 % unspezifische Befunde liefert, ist bei der Notwendigkeit einer histologischen Sicherung die chirurgische Lungenbiopsie vorzuziehen. Hierfür bietet sich die wenig invasive videoassistierte Thorakoskopie (VATS) an (Kirsten 2003).
Verschiedene histologische Muster interstitieller Lungenkrankheiten (BOOP-Muster, zelluläre NSIP, fibrosierende NSIP und die UIP) bei der EAA zeigen unterschiedliche Prognosen. Die fibrosierende NSIP und insbesondere die UIP haben eine besonders schlechte Prognose. Die chronische Verlaufsform der EAA weist histologisch Übergänge in die idiopathische Lungenfibrose auf (Costabel et al. 2012).
Somit bleibt festzuhalten, dass auch eine chirurgische Lungen-biopsie häufig keine definitive EAA-Diagnose ermöglicht, da die histologischen Veränderungen je nach Stadium der EAA vielgestaltig sein können und Überlappungen mit anderen interstitiellen Lungenerkrankungen aufweisen.
Karenztest
Der Allergenkarenz-Versuch – die probatorische Elimination des verdächtigen Antigens für einige Tage – ist ein ungefährliches wertvolles Diagnosekriterium. Oft ergibt sich diese Allergenkarenz, wenn der Patient aus seinem häuslichen und beruflichen Milieu heraus sta-tionär in ein Krankenhaus aufgenommen wird (Sennekamp 1998, 2004).
Ambulant lässt sich ein Karenzversuch durch Entfernen etwa eines verdächtigen Vogels oder Zimmerspringbrunnens arrangieren. Dabei ist darauf zu achten, dass auch die Wohnung danach gründ-lich gereinigt wird, da sich die Allergene wie Vogelfedern im Hause ausgebreitet haben. Besonders hartnäckige Allergenreservoire sind Teppiche.
Bei einem positiven Karenztest bessern sich die klinischen Sym-ptome, der Röntgenbefund, die Entzündungswerte im Blut (Leukozyten, CRP, BKS, LDH) sowie die Lungenfunktions- und Blutgasparameter. Bei monatelanger Karenz kommt ein messbarer Abfall der IgG-Antikörperkonzentration hinzu.
Expositions- und Provokationstests
Ein weiteres wertvolles diagnostisches Verfahren ist, den Patienten mit dem verdächtigen Antigen versuchsweise zu konfrontieren.
Setzt sich der Patient wie gewohnt wieder dem verdächtigen Allergen wie einem Federbett, einem Taubenschlag oder einer Klima-anlage aus, so spricht man von einem Expositionstest.
Sofern die Exposition mit mobilen Antigenen wie beispielsweise einem transportablen Zimmerspringbrunnen auch stationär unter ärztlicher Überwachung durchgeführt werden kann, sollte dies ge-schehen. Sind Antigene nicht transportabel, so kann eine Exposition unter realen Arbeitsbedingungen vorgenommen werden (Müller-Wening 1992; Zacharisen u. Fink 2011). Da die allergische Reaktion erst Stunden nach Beginn der Exposition auftritt, besteht für den Patienten die Möglichkeit, sich nach einer Exposition unter realen Arbeitsbedingungen von etwa einer halben Stunde anschließend zum Arzt (am besten zur stationären Beobachtung) zu begeben, wo die Untersuchungen vorgenommen und mit aktuell erhobenen Voruntersuchungen ohne Antigenkontakt verglichen werden können. Zwischen dem Beginn des Allergenkontakts und dem Eintreffen beim Arzt sollten nicht mehr als zwei Stunden vergehen. Bei nicht transportablen Antigenen ist dies die einzige Möglichkeit, die Einwirkung des Antigens auf die Lunge zu prüfen.
Bei geringfügigen Beschwerden werden auch Arbeitsversuche über einen ganzen oder mehrere Tage gemacht; dabei erfolgen die Funktions- und Blutanalysen erst an dem nächsten darauffolgenden Tag. Mehrere Tage später sollten diese Kontrollen besser nicht erfolgen, da sich die Symptome dann schon wieder teilweise oder ganz zurückgebildet haben.
Bei transportablen Antigenen ist die Provokation immer stationär im Krankenhaus als inhalativer Provokationstest durchzuführen (Bergmann et al. 1998). Es sind dabei viele Kontraindikationen nach Tabelle 2 , Durchführungsbestimmungen und eine schriftliche Aufklärung zu beachten. Die Kriterien für eine positive inhalative Allergenprovokation sind in Tabelle 3 aufgeführt.
Diagnostisches Prozedere
Die EAA überlappt sich in vielen Symptomen mit der Lungen-sarkoidose und anderen granulomatösen, infektiösen, neoplastischen und autoimmunen Lungenkrankheiten sowie dem ODTS. Daher kann die Diagnose nur mittels mehrerer Diagnosekriterien mit hinreichender Sicherheit gestellt werden. Von den in Deutschland üblichen Diagnosekriterien der Arbeitsgemeinschaft exogen-allergischer Alveolitis sollten wenigstens 6 Kriterien erfüllt sein ( Tabelle 4 ) (Arbeitsgemeinschaft EAA 2007). Die aufwändigen Diagnoseverfahren müssen nach dieser Empfehlung nur dann eingesetzt werden, wenn die einfacher zu erstellenden Kriterien zur Diagnosesicherung nicht ausreichen.
Bei jeder EAA, insbesondere bei der chronischen Verlaufsform, sollte auch an ein Cor pulmonale gedacht werden. Dies wird mittels Röntgen-Thorax, Herz-Ultraschall und Rechtsherzkatheter er-kannt.
Schwierig kann die Diagnostik sein, wenn als Endstadium der EAA ein Emphysem vorliegt, bei dem das Symptom Rasselgeräusche fehlt, eine inhalative Provokation kontraindiziert und wegen gerin-ger Zellausbeute die BAL wenig aussagefähig sein kann. Hier kann die Diagnose EAA bereits bei fünf Diagnosekriterien gestellt werden (Ochmann et al. 2013).
Die speziellen Krankheitsbilder und deren Antigene
Aufgrund eigener Literaturstudien sind in Tabelle 5 alle EAA-induzierten Berufe und Arbeitsplätze aufgeführt.
In Tabelle 6 sind die dazugehörigen Antigene, die Namen der Krankheitsbilder, das Vorkommen (die Herkunft) der Antigene und die Berufe in Form eines EAA-Antigenkatalogs der beruflichen Antigene aufgelistet (Originalliteratur in Sennekamp 2004, 2007). Weitaus die häufigsten Antigene sind die Stäube von Vogelfedern und Vogelkot ( Abb. 6 ). Die nur 1–2 µm großen Federnpuderpartikel gelangen mit der Atemluft in die terminalen Bronchiolen und in die Alveolen. Die Federnantigene sind für manche Patienten so potent, dass schon indirekter Antigenkontakt, z. B. über die Kleidung oder einen Teppich, ausreichen kann, die EAA zu induzieren. Federbetten (Bettfedern-Alveolitis), Federkissen im Wohnzimmer, warme Winterjacken und Wintermäntel mit Daunenfüllungen (Enten- und Gänsefedern) sind wichtige Allergenquellen der Bettfedern-Alveo-litis (Koschel et al. 2008). Beruflich exponiert sind Geflügelzüchter, Vogelhändler, Federleser, Tierärzte und weitere in den Tabellen 5 und 6 aufgeführte Berufe.
Andere in Tabelle 6 aufgeführte tierische Antigene wie Schalentiere, Fischmehl und Seidenraupen sind Raritäten. Auch pflanzliche Antigene wie Holz- und Getreidestäube kommen auch nur selten als Verursacher der berufsbedingten EAA vor. Von den Chemikalien, die ebenfalls selten eine EAA hervorrufen, stehen die Isozyanate und die Anhydride (besonders Trimellith-Anhydrid) der Häufigkeit nach an der Spitze. Besonders betroffen sind Spritzlackierer in der Autoindustrie und Chemielaboranten. Die spezifischen IgG-Antikörper haben nur niedrige Titer.
Die größte Gruppe von Antigenen ist die der Bakterien, Schimmelpilze und Hefen (Tabelle 6). Am längsten bekannt und mit Abstand die häufigste berufsbedingte EAA ist die Farmerlunge. Sie wird von den thermophilen Mikroorganismen (Thermoactinomyceten) Saccharopolyspora rectivirgula und Thermoactinomyces vulgaris sowie Aspergillus-Schimmelpilzen in modrigem Heu, Stroh und anderem biologischem Material hervorgerufen.
In den letzten Jahren ergaben serologische Untersuchungen unserer Arbeitsgruppe, dass weitere Antigene ( Absidia [ Lichtheimia ] corymbifera, Erwinia herbicola und Streptomyces albus ) als Verursacher der Farmerlunge in Deutschland in Betracht kommen (Joest et al. 2010).
Zunehmend häufiger wird die Befeuchterlunge beobachtet. Sie wird von Bakterien, Schimmel- und Hefepilzen in Wasseraerosolen verursacht. Brutstätten der allergenen Keime sind Wasserzerstäuber, Verdunster, Vernebler, Klimaanlagen, Abwasserverregnungsanlagen, Kühlsysteme, Schwimmbäder und Whirlpools. Besonders gefährdet sind Bademeister und Drucker. Extrem gefährlich sind Ultraschallnebel, weil diese sehr kleine, alveolengängige Wasserpartikel enthalten, beispielsweise in Ultraschall-Zimmerspringbrunnen. Bei der großen Vielfalt der allergenen Bakterien und Pilze (Tabelle 6) kann die serologische Antikörperdiagnostik langwierig und aufwändig sein. Bei fehlendem Antikörpernachweis sollte von der Möglichkeit Gebrauch gemacht werden, das Serum des Patienten im Ouchterlony-Test gegen das Wasser der Befeuchteranlage laufen zu lassen, um so die präzipitierenden Antikörper gegen die Keime im Wasser zu detektieren. Sensitiver, aber auch kostspieliger ist, das kontami-nierte Befeuchterwasser an ELISA-Näpfchen von Mikrotiterplatten zu binden (coaten) und diese antigenhaltigen Näpfchen als Antigenträger im ELISA einzusetzen (Sennekamp 2007).
Die Maschinenarbeiterlunge, verursacht durch mikrobiell verunreinigte, wassermischbare und nicht wassermischbare Kühlschmier-flüssigkeiten, bereitet ebenfalls häufig Probleme bei der Suche nach dem ursächlichen Antigen. Pseudomonas fluorescens, Aureobasidium pullulans und Cephalosporium acremonium sind solche Keime. Mitunter handelt es sich um atypische schnellwüchsige Mykobakterien ( Mykobacterium immunogenum, chelonae, avium und fortuitum ), für die Antikörpernachweise nur in wenigen spezialisierten Labors begrenzt möglich sind. Hier hilft ein bakteriologischer Keimnachweis weiter (Koschel 2006).
Die Innenraum-Alveolitis wird von Bakterien- und Schimmelpilz-Antigenen in Büro- und Arbeitsräumen, aber auch in Wohnräumen, hervorgerufen. Häufige Antigene sind die Thermoactinomyceten Saccharopolyspora rectivirgula (früher Micropolyspora faeni ) und Thermoactinomyces vulgaris sowie die Schimmelpilze Aspergilli, Penicillia, Aureobasidium pullulans und Cephalosporium acremonium ( Acremonium kiliense ).
Die Pilzzüchterlunge wird durch Sporen von Speisepilzen wie Pleurotus oder Shiitake hervorgerufen, die in großer Menge freigesetzt werden und so allergen sein können, dass in einer Publikation 40 % der in einer Pilzzucht beschäftigten Personen an einer EAA erkrankten.
Candida albicans wurde nicht nur als berufsbedingtes Antigen bei einem Landwirt, bei Blasmusikern, bei Klimaanlagen induzierter EAA, einer Schwimmbad-Alveolitis und bei einer Fußpflegerin beschrieben, sondern kommt auch im menschlichen Darm vor. Schreiber et al. (2001) konnten nachweisen, dass Candida-Hefe im Darm Ursache einer EAA in der Lunge sein kann.
Für die Suche nach den verursachenden Antigenen werden in erster Linie Analysen von IgG-Antikörpern im Serum der Patienten eingesetzt. Das Spektrum der Antigene (Allergene) unterscheidet sich von dem der IgE-vermittelten Allergien. So sind Pollen, Milben, Latex und Birkenfeige keine EAA-Antigene; hingegen können Schimmelpilze und Vogelfedern sowohl allergische Sofortreaktionen als auch die EAA hervorrufen.
Leider stehen nur für die häufigsten Antigene der EAA kommerziell erhältliche IgG-Antikörper-Tests zur Verfügung. Darüber hinaus geben viele Labore nur den Messwert und den Grenzwert des Normbereichs an, so dass man nicht wie bei den RAST-Klassen der IgE-Antikörper erkennen kann, ob der IgG-Antikörper schwach, mittelstark oder stark positiv ist. Dies ist aber von Bedeutung, da erwiesen ist, dass eine EAA umso wahrscheinlicher ist, je stärker positiv der Antikörper nachgewiesen wurde (Sennekamp 1998, 2004).
Der in Deutschland wohl am weitesten verbreitete IgG-Antikörpertest ist das Phadia-ImmunoCAP-System (Fa. Thermo Fisher Scientific). Mit diesem System haben wir für einige wichtige Antigene eigene Normgrenzen (Cut-off-Werte) ermittelt. Dazu wurde für jedes Antigen das spezifische IgG im Serum von 20 gesunden Personen bestimmt. Diese Personen waren Vogelstäuben und Schimmel nicht exponiert und litten nicht an Erkrankungen der Lunge, hatten keine Allergien, Tumoren oder chronische Entzündungen. Da bekannt ist, dass die IgG-Antikörper gegen die EAA-Antigene nicht in einer Gauß’schen Verteilungskurve normalverteilt sind (Bañales et al. 1997), wurde die 95 % Perzentile als Cut-off festgelegt. Diese Cut-off-Werte sind in Abb. 7 grafisch und zahlenmäßig aufgeführt.
Die Grenzen von fraglich zu schwach, von schwach zu mittelstark und von mittelstark zu stark positiv wurden mittels positiver Seren von Einsendungen aus allen Regionen Deutschlands ermittelt. In Abb. 7 sind diese Grenzen grafisch und tabellarisch dargestellt.
Fraglich positiv sind in unserem Labor die 10 % niedrigsten über dem Cut-off liegenden positiven Werte. Stark positiv sind die 10 % höchsten aller positiven Werte. Die Grenze von schwach zu mittelstark positiv ist der Median zwischen dem Grenzwert fraglich zu schwach und mittelstark zu stark positiv. Mit den hierdurch ermittelten Bereichen erfolgt in unserem Labor die semiquantitative Beurteilung der über dem Cut-off liegenden IgG-Antikörper.
Zurzeit wird eine multizentrische deutsche Studie initiiert, die die Normgrenzen (Cut-offs) anhand eines größeren Kollektivs von gesunden Personen aus verschiedenen Regionen Deutschlands ermittelt.
Reagiert ein Serum auf die Mehrzahl der getesteten Antigene positiv (breites Antigenspektrum), liegt nach einer aktuellen Studie die Wahrscheinlichkeit, dass bei dem Patienten eine gesicherte oder wahrscheinliche EAA vorliegt, bei über 80 % (Joest et al. 2014).
Differenzialdiagnosen
Eine wichtige Differenzialdiagnose ist die toxische Alveolitis sowohl der anorganischen (Metallrauchfieber, Polymerrauchfieber, Silofüllerkrankheit, toxische Gase, Brandgase) als auch der organischen Stoffe, das Organic Dust Toxic Syndrome (ODTS) (z. B. Drescherfieber, Befeuchterfieber) mit den klinischen Hauptsymptomen Fieber, Schüttelfrost, Husten, Dyspnoe, Myalgien, Abgeschlagenheit und Kopfschmerzen, bei dem das Röntgenbild in der Regel normal ist, keine Ventilations- oder Diffusionsstörung der Lunge vorliegt und Antikörper fehlen oder nur in niedriger Konzentration vorkommen (Sennekamp 2007; Sennekamp u. Merget 2009).
Die toxischen Alveolitiden organischer Ursache (ODTS) werden von Endotoxin aus gramnegativen Bakterien, Glukanen aus Pilzen und Hefen und anderen PAMP („pathogen-associated molecular patterns“) wie Pflanzenfaserbestandteilen, DNA, Peptidoglycanen und Pollen hervorgerufen. In der bronchoalveolären Lavage ist zu erkennen, dass die Endotoxine und Glukane eine neutrophile Alveolitis hervorrufen. Die initial bei Antigenkontakt erscheinende neutrophile Alveolitis bei der Farmerlunge, möglicherweise auch anderer allergischer Alveolitiden, könnte eine ODTS-Reaktion sein, da in Heustaub, Vogelstäuben und Befeuchteraerosolen Endotoxine und Glukane enthalten sind (Lorenzen 2003).
Bei langem Krankheitsverlauf kann bei den toxischen Alveolitiden eine unspezifische Hyperreagibilität mit Husten, Schleimdrüsenhypertrophie, viskösem Sputum sowie einer eingeschränkten mukoziliären Clearance die Folge sein. Das durch berufliche Tätigkeit erworbene ODTS gilt in Deutschland nicht als Berufskrankheit, sondern als Arbeitsunfall.
Zu den weiteren Differenzialdiagnosen der EAA zählen rezidivierende virale oder bakterielle Atemwegsinfekte und Pneumonien, allergische und immunologische Lungenerkrankungen wie beispiels-weise das Asthma, die bronchopulmonalen Mykosen und insbesondere die Sarkoidose und die idiopathische Lungenfibrose (IPF). Somit besteht für die EAA eine lange Liste von Differenzialdiagnosen ( Tabelle 7 ).
EAA als Berufskrankheit in Deutschland
Bei der EAA handelt es sich in Deutschland um die Berufskrankheit (BK) mit der BK-Ziffer 4201 (exogen-allergische Alveolitis; Müsch 2006). Bei der Isocyanat-Alveolitis muss die BK 1315 (Erkrankungen durch Isozyanate) verwendet werden. In diesem Fall wird die Beendigung der beruflichen Tätigkeit gefordert.
In Österreich steht seit dem 01.01.1981 auf der Liste der Berufskrankheiten die „Exogen-allergische Alveolitis mit objektiv nachweisbarem Funktionsverlust der Lunge, sofern das als ursächlich festgestellte Antigen tierischer oder pflanzlicher Abkunft bei der Erwerbsarbeit von einem objektiv feststellbar bestimmenden Einfluss gewesen ist“.
In der Schweiz ist die exogen-allergische Alveolitis nach Arti-kel 9, Absatz 1, des Unfallversicherungsgesetzes (UVG) eine arbeits-bedingte Erkrankung, die von der SUVA anerkannt wird.
Die berufsbedingte exogen-allergische Alveolitis ist in Deutschland meldepflichtig. Die gesetzliche Meldepflicht hat Vorrang vor der ärztlichen Schweigepflicht (Nowak u. Kroidl 2009).
Im Gegensatz zu den beruflich bedingten obstruktiven Atemwegserkrankungen wird bei der exogen-allergischen Alveolitis die Aufgabe der schädigenden Tätigkeit als Voraussetzung zur Anerkennung als Berufskrankheit vom Gesetzgeber nicht gefordert (Nowak u. Kroidl 2009; Sennekamp u. Müller-Wening 2006).
Besteht für Versicherte die konkrete Gefahr, dass eine Berufskrankheit wiederauflebt, sich verschlimmert oder entsteht, so haben die Unfallversicherungsträger dieser Gefahr mit allen Mitteln entgegen zu wirken (§ 3 der BK-Verordnung). Ist diese konkrete Gefahr nicht zu beseitigen, muss auf die Aufgabe der schädigenden Tätigkeit hingewirkt werden. Der § 3 greift besonders dann, wenn die Entstehung einer BK droht und noch kein Leistungsfall vorliegt (Versicherungsfall mit MdE
Gefahr bedeutet die Wahrscheinlichkeit des künftigen Eintritts eines schädigenden Ereignisses. Konkret bedeutet dies Antigenkontakt bei einer EAA. Die bloße Möglichkeit des Entstehens einer BK ist für die Anwendung des § 3 nicht ausreichend. Kontakt mit Heu oder Vögeln für Personen ohne klinische Symptome, auch wenn sie IgG-Antikörper im Serum haben, stellt noch keine konkrete Gefahr dar.
Bei der Begutachtung ist zu berücksichtigen, dass nur Befunde, die zu den Zeiten beruflicher Allergenexposition erhoben wurden, für die Diagnose der EAA verwertbar sind! Auch ist zu beachten, dass manche EAA-Krankheitsbilder wie die Farmerlunge nur saisonal, z. B. bei der Heufütterung im Winter auftreten. Die IgG-Anti-körper und die BAL-Lymphozyten normalisieren sich langsam bei fehlender Allergenexposition und sind dann als Diagnosekriterium nicht mehr voll aussagefähig.
Anders ist es mit den Folgeschäden, vor allem der Lungenfibrose und dem Lungenemphysem. Diese können bei fehlender Antigenexposition funktionell besser beurteilt werden.
Zu beachten ist aber auch, dass zahlreiche EAA-Patienten keine Folgeschäden an Lunge und Bronchien zu befürchten haben. Dennoch ist eine berufsbedingte EAA dieser Patienten als Berufskrank-heit zu werten.
Die Minderung der Erwerbsfähigkeit (MdE) kann nach dem Schema von Konietzko ermittelt werden (Sennekamp 2007; Tabelle 8 ). Fakultativ kann zusätzlich die Spiroergometrie eingesetzt werden (Kroidl 2006; Preisser u. Ochmann 2011).
Die MdE soll immer die bleibenden Schäden widerspiegeln (No-wak u. Kroidl 2009). Erfolgt die Begutachtung zur Zeit des Allergenkontakts des Patienten bei florider Alveolitis, so ist bei einer vorgesehenen Allergenkarenz eine erneute Untersuchung zur erneuten Beurteilung der MdE ein Jahr nach Beginn der Allergenkarenz vorzunehmen, da sich unter Allergenkarenz die Befunde ggf. gebessert haben könnten und damit auch eine andere MdE zu veranschlagen wäre.
Therapie
Die wichtigste Therapie ist die Allergenkarenz, die möglichst eine medikamentöse Behandlung mit einem systemischen Steroid überflüssig machen soll. Sofern ein berufsbedingtes Allergen bei der Arbeit nicht gemieden werden kann, veranlasst bei einer anerkannten Berufskrankheit in Deutschland die Berufsgenossenschaft eine Umschulung in einen nicht gefährdenden Beruf.
An Farmerlunge erkrankten Landwirten mit eigenen Bauernhof werden von der Berufsgenossenschaft Atemschutzgeräte, insbesondere Filtergeräte mit Gebläse, zur Verfügung gestellt. Wichtig ist, dass die Effektivität des Atemschutzes überprüft wird (Lungenfunktions- und Blutgasmessungen, Antikörpertiterverlauf, Kontrollen der Entzündungsparameter wie Leukozyten, BKS, CRP und LDH) und bei fehlender Effektivität des Atemschutzes die gefährdende Arbeit eingestellt wird (Müller-Wening 2004).
Medikamentös bewirken systemische Steroide eine Abschwächung der klinischen Symptome. Bei fehlendem Ansprechen ist die Diagnose zu hinterfragen oder es liegen bereits eine Fibrose oder ein Emphysem vor.
Eine langzeitige Steroidbehandlung sollte bei den potenziellen erheblichen Nebenwirkungen möglichst vermieden werden, insbesondere dann, wenn noch nicht alle Allergenkarenzmaßnahmen ausgeschöpft sind. Die initiale Dosis liegt zwischen 20 und 50 mg Prednison-Äquivalent oral täglich. Spätestens nach einem Monat sollte die Dosis langsam reduziert werden und über mehrere Monate hin möglichst 7,5–15 mg/Tag nicht überschreiten. Bei chronischer Verlaufsform der EAA können Immunsuppressiva hinzugegeben werden, wenn dadurch Steroide eingespart werden können.
Inhalative Steroide reichen zur Behandlung nicht aus. Sie können jedoch bei bestehender bronchialer Hyperreagibilität und zur Behandlung einer bronchialen Obstruktion eingesetzt werden.
Bei gleichzeitig bestehender pulmonaler Hypertonie werden die üblichen Medikamente eingesetzt.
Antihistaminika, Theophylline, DNCG, Leukotrien-Rezeptor-Antagonisten, Zytostatika und spezifische Hyposensibilisierung sind zur Behandlung der EAA nicht geeignet.
Prävention und Nachsorge
Optimal sind präventive Maßnahmen in Form von Allergenkarenz, damit sich eine EAA gar nicht erst entwickeln kann (Koschel 2008). So konnte durch Verkapselung des allergenen Enzyms Subtilisin die von enzymatischen Waschmitteln hervorgerufene EAA (Detergenzienlunge) vollständig beseitigt werden. Das Ernten von Speisepilzen wie Austernseitling vor der Phase der Sporenbildung dieser Pilze ist eine weitere erfolgreiche präventive Maßnahme.
Das Tragen von Atemschutz bei Spritzlackierern zur Verhinderung der Isozyanat-EAA und bei Renovierungsarbeiten zur Verhinderung von Schimmelpilz induzierten Alveolitiden ist bei korrekter Anwendung effektiv (Müller-Wening 2004).
EAA-Patienten sollten auch nach erfolgreicher Therapie weiter überwacht werden. Denn erfahrungsgemäß werden die empfohlenen Allergenkarenzmaßnahmen mit der Zeit häufig vernachlässigt. Hinzu kommt, dass EAA-Patienten nicht selten im weiteren Verlauf auf zusätzliche EAA-Antigene allergisch werden (Verbreiterung des Allergenspektrums; Sennekamp 1998), was ohne Kontrolluntersuchungen meist nicht rechtzeitig erkannt wird.
Literatur
Amthor MJ: Histologische Differentialdiagnose der EAA unter besonderer Berück-sichtigung der Bronchiolitis obliterans mit organisierender Pneumonie (BOOP). Allergologie 2003; 26: 310–312.
Arbeitsgemeinschaft exogen-allergische Alveolitis: Empfehlungen zur Diagnostik der exogen-allergischen Alveolitis. Allergologie 2006; 29: 431–438 und Pneumologie 2007; 61: 52–56.
Bañales JL, Vazquez L, Mendoza F et al.: On the correct determination of reference values for serum antibodies against pigeon serum antigen using a group of healthy blood donors. Arch Med Res 1997; 28: 289–291.
Bergmann KC, Kroidl R, Liebetrau G et al.: Empfehlungen zur inhalativen Provo-kationstestung bei exogen-allergischer Alveolitis. Pneumologie 1998; 52: 444–446.
Costabel U, Bonella F, Guzman J: Chronic hypersensitivity pneumonitis. Clin Chest Med 2012; 33: 151–163.
Hirschmann JV, Pipavath SNJ, Godwin JD: Hypersensitivity pneumonitis: A historical, clinical, and radiologic review. Radiographics 2009; 29: 1921–1938.
Joest M, Schulte W, Engelhart S, Sennekamp J: Gibt es in Deutschland bisher noch unbekannte Farmerlungenantigene? Allergologie 2010; 33: 565–569.
Joest M, Schulte W, Sennekamp J: Bedeutung eines breiten Spektrums spezifischer IgG-Antikörper für die Diagnose einer exogen-allergischen Alveolitis. Allergologie 2014; 37: 220–224.
Kirsten D: Der Wert der Video-assistierten Thorakotomie (VATS) bei der Diagnostik der interstitiellen Lungenerkrankungen (ILD). Allergologie 2003; 26: 329.
Koschel D: Atypische Mykobakterien als Ursache der Maschinenarbeiterlunge, der hot tub lung und der Schwimmbadalveolitis. Allergologie 2006; 29: 449–451.
Koschel D: Prävention der exogen-allergischen Alveolitis. Atemwegs Lungenkrankh 2008; 34: 182–186.
Koschel D, Lützkendorf L, Höffken G: Spezifische IgG-Antikörper mittels Immuno-CAP gegen Gänse- und Entenfedern bei Bettfedern-Alveolitis. Allergologie 2008; 31: 482–484.
Koschel DS, Cardoso C, Wiedemann B, Höffken G, Halank M: Pulmonary hyper-tension in chronic hypersensitivity pneumonitis. Lung 2012; 190: 295–303.
Kroidl R: Zur Pathophysiologie und Funktionsdiagnostik der EAA. Allergologie 2006; 29: 478–480.
Lorenzen B: Untersuchungen zur Rolle von organischen Stäuben in der Pathogenese der exogen-allergischen Alveolitis. Dissertation LMU München, 2003.
Morell F, Villar A, Montero MA et al.: Chronic hypersensitivity pneumonitis in patients diagnosed with idiopathic pulmonary fibrosis. Lancet Respir Med 2013; 1: 685–694.
Müller-Wening D: Erfahrungen zur inhalativen Allergenprovokation bei exogen-allergischer Alveolitis. Allergologie 1992; 15: 2–14.
Müller-Wening D: Effekte von Atemschutzgeräten bei Atemwegserkrankungen in der Landwirtschaft. AllergoJournal 2004; 13: 460–466.
Müsch FH: Berufskrankheiten. Stuttgart: Wissenschaftliche Verlagsgesellschaft, 2006.
Nowak D, Kroidl RF: Bewertung und Begutachtung in der Pneumologie. 3. Aufl. Stuttgart: Thieme, 2009.
Ochmann U, Schulte W, Sennekamp J, Nowak D: Bedeutung des Lungenemphysems bei der chronischen exogen-allergischen Alveolitis. Allergologie 2014; 37: 229–234.
Preisser AM, Ochmann U: Die Spiroergometrie in der arbeitsmedizinischen Eignungsuntersuchung und Begutachtung. Pneumologie 2011; 65: 662–670.
Raulf-Heimsoth M, Sander I, Mayer S, Fleischer C, Brüning T: IgG-Antikörper als Expositionsmarker bei Getreidearbeitern. Allergologie 2008; 31: 484–486.
Schreiber J, Goring HD, Rosahl W et al.: Interstitial lung disease induced by endo-genous Candida albicans. Eur J Med Res 2001; 6: 71–74.
Sennekamp J: Exogen-allergische Alveolitis. München: Dustri, 1998.
Sennekamp J: Extrinsic allergic alveolitis – hypersensitivity pneumonitis. München: Dustri, 2004.
Sennekamp J, Müller-Wening D: Exogen-allergische Alveolitis. Pneumologe 2006; 3: 461–470.
Sennekamp J: Exogen-allergische Alveolitis. In: Letzel S, Nowak D (Hrsg.): Hand-buch der Arbeitsmedizin. Landsberg: Ecomed, 2007, Kap. D.I.- 3.2.1.2.1.: 1–62.
Sennekamp J: ODTS-Toxische Alveolitis organischer Stäube. In: Letzel S, Nowak D (Hrsg.): Handbuch der Arbeitsmedizin. Landsberg: Ecomed, 2008, Kap. D.I.- 3.3.2.: 1–18.
Sennekamp J, Merget R: Toxische Alveolitiden durch anorganische Substanzen. In: Letzel S, Nowak D (Hrsg.): Handbuch der Arbeitsmedizin. Landsberg: Ecomed, 2009, Kap. D.I.- 3.3.1.: 1–15.
Sennekamp J: Der aktuelle Katalog der Antigene, Krankheitsbilder und Risikoberufe der exogen-allergischen Alveolitis. Allergologie 2010; 33: 583–594.
Sennekamp J, Forster F: Berufsbedingte exogen-allergische Bronchiolo-Bronchitis. Allergologie 2012; 35: 298–309.
Sennekamp J: Exogen-allergische Alveolitis. AllergoJournal 2013; 22: 177–188.
Weber RW: Allergen of the month-Stachbotrys chartarum. Ann Allergy Asthma Immunol 2012; 108: A9.
Zacharisen MC, Fink JN: Hypersensitivity pneumonitis and related conditions in the work environment. Immunol Allergy Clin North Am 2011; 31: 769–786.
Für die Verfasser
Prof. Dr. med. Joachim Sennekamp
Malteser Lungen- und Allergiezentrum Bonn
Weberstraße 118
53113 Bonn
Fußnoten
Malteser Lungen- und Allergiezentrum Bonn (Leiter: Dr. med. Marcus Joest)