Occupational contact urticaria with suspected allergic rhinitis due to sensitization to Cannabis sativa
Case Presentation: A customs employee presented with complaints of allergic rhinitis related to the workplace.
Results: Allergy diagnostics (rub test, prick test, specific IgE) revealed evidence of allergies to cannabis sativa and environmental allergens.
Measures: The suspected presence of occupational disease no. 4301 was reported to the insurer. The avoidance of exposure to allergens was advised.
Conclusions: In the future, due to changes in the legal situation, more persons in cultivation, production, distribution, the health sector, forensic laboratories and law enforcement agencies will come into contact with cannabis sativa in the workplace. Allergies may develop, but to date there are no commercially available type I allergy diagnostics related to cannabis products. Further health effects of occupational exposure and necessary preventive measures are unclear.
Keywords: occupational allergy – Cannabis sativa – occupational disease no. 4301
ASU Arbeitsmed Sozialmed Umweltmed 2023; 58: 108–111
Berufsbedingte Kontakturtikaria und Verdacht auf allergische Rhinitis durch Sensibilisierung gegen Cannabis sativa
Falldarstellung: Ein Zollmitarbeiter stellte sich mit Beschwerden einer
allergischen Rhinitis mit Arbeitsplatzbezug vor.
Ergebnisse: Die Allergiediagnostik (Reibtest, Pricktest, spezifische IgE) erbrachte den Nachweis von Allergien gegen Cannabis sativa und Umweltallergenen.
Maßnahmen: Der Verdacht auf das Vorliegen einer Berufskrankheit Nr. 4301 wurde dem Unfallversicherungsträger gemeldet. Die Vermeidung der Allergenexposition wurde angeraten.
Schlussfolgerungen: Aufgrund der sich ändernder Gesetzeslage werden zukünftig mehr Personen in Anbau, Herstellung, Vertrieb, im Gesundheitssektor, in forensischen Laboratorien und Strafverfolgungsbehörden Kontakt zu Cannabis sativa am Arbeitsplatz haben. Allergien können entstehen, jedoch gibt es bisher keine kommerziell erhältliche Typ-I-Allergiediagnostik in Bezug auf Cannabisprodukte. Weitere gesundheitliche Effekte der beruflichen Exposition sowie notwendige Präventionsmaßnahmen sind unklar.
Schlüsselwörter: berufliche Allergie – Cannabis sativa – Berufskrankheit Nr. 4301
Falldarstellung
Ein 22-jähriger chemisch-technischer Assistent stellte sich mit der Frage nach einer berufsbedingten Atemwegserkrankung in unserer arbeitsmedizinischen Ambulanz vor. Seit fast zwei Jahren arbeitete er in einem Labor des Zolls. Eine seiner täglichen Aufgaben sei die Analyse von beschlagnahmtem Cannabis auf den Gehalt an Tetrahydrocannabiol (THC). Dafür werde die Probe in einer Mühle, die unter einem Abzug stehe, sehr fein gemahlen. Viele Arbeitsschritte fänden unter Abzügen statt und er trage Nitril-Handschuhe, FFP2-Maske (aufgrund der SARS-CoV-2-Pandemie) sowie einen Laborkittel.
An Symptomen gab er an, ständig eine verstopfte Nase zu haben und bei Cannabiskontakt häufig niesen zu müssen. Weiterhin berichtete er von Urtikaria-ähnlichen Hauterscheinungen. Vor dem Tätigkeitsbeginn habe er die genannten Symptome nie gehabt; sie träten auch nicht bei Kontakt zu anderen Arbeitsmaterialien auf. Es bestände keine saisonale Verschlechterung, aber eine Besserung im Urlaub. Anfallsartige Luftnot, Belastungsluftnot, Druck auf der Brust oder Husten seien nicht aufgetreten. Privater Kontakt zu Cannabis oder Cannabis-Konsum wurden verneint.
Diagnostik
Der körperliche Untersuchungsbefund des Patienten war altersentsprechend unauffällig. Zur Diagnostik einer möglichen Typ-I-Allergie wurde ein Reibtest durchgeführt, der positiv ausfiel. Als Teststoff wurde eine vermahlene Mischung aus Nutzhanf und Blütenmaterial verwendet, die er vom Arbeitsplatz mitbrachte und dort als Referenzprobe dient.
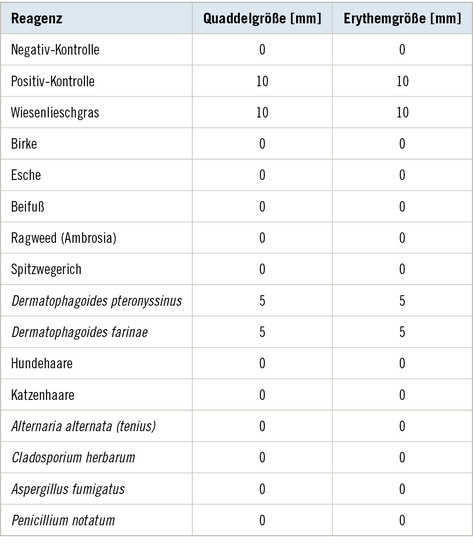
Ein Pricktest zeigte eine positive Hautreaktion gegen Wiesenlieschgras und Hausstaubmilben (siehe ➥ Tabelle 1). Das Gesamt-IgE wurde mit 348,54 kU/l erhöht gemessen. Spezifische IgE gegen Pollen frühblühender Gräser und Hausstaubmilben waren nachweisbar (CAP-Klasse 1). Zusätzlich konnten spezifische IgE gegen Cannabis sativa (Hanf) festgestellt werden (CAP-Klasse 2); weitere rekombinante und Kreuzallergene von Cannabis blieben ohne Nachweis spezifischer IgE (vgl. ➥ Tabelle 2).
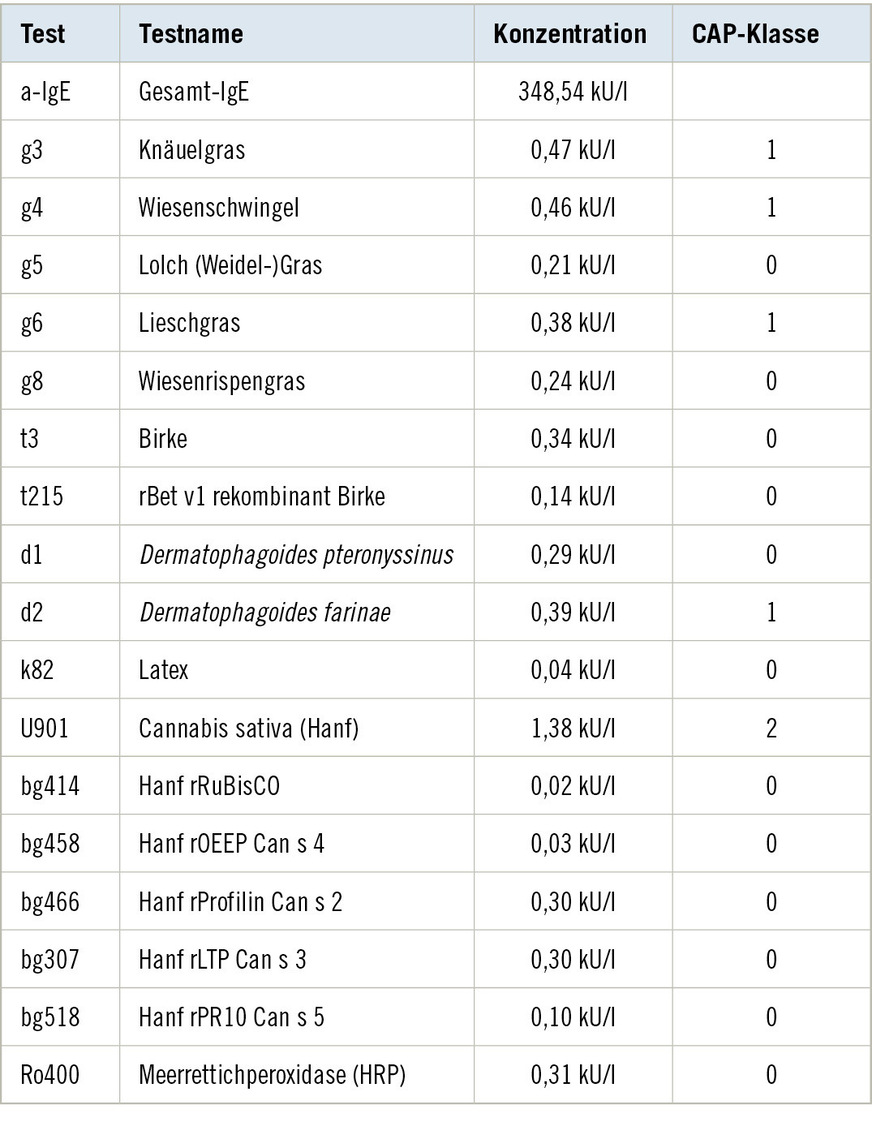
Table 2: ImmunoCAP total and specific IgE results
Ergebnisse
Zusammenfassend bestehen bei dem Patienten Symptome einer allergischen Rhinitis mit Arbeitsplatzbezug. Die Allergiediagnostik ergab allergische Sensibilisierungen gegen Hausstaubmilben und Frühblüher, die ihm bisher nicht bekannt waren. Zudem liegt eine arbeitsplatzbezogene allergische Sensibilisierung gegen Cannabis
sativa vor. Es besteht der begründete Verdacht auf eine Berufskrankheit (BK) Nr. 4301 (allergische Rhinitis).
Maßnahmen
Aufgrund der Sensibilisierungen gegen Hausstaubmilben und Pollen frühblühender Gräser wurde der Patient zu Maßnahmen der Reduktion dieser Expositionen ausführlich beraten. Zusätzlich wurde ihm empfohlen, den Kontakt zu Cannabis sativa im beruflichen Umfeld zu vermeiden, zumindest aber Präventionsmaßnahmen gemäß
STOP-Prinzip1 durchzuführen. Er plant nun eine berufliche Umorientierung und den Beginn eines Studiums im Bereich Informatik.
Diskussion
Verschiedene Cannabis-Proteine können als hochmolekulare Allergene wirken und eine allergische Typ-1-Reaktion verursachen. Die Bedeutung der bisher detektierten Allergene für berufliche Cannabis-Sensibilisierungen ist bislang unklar (Skypala et al. 2022). Bisher sind weder Cannabis-Extrakte für Pricktests noch spezifische IgE gegen Cannabis sativa kommerziell erhältlich.
Weitere gesundheitliche Auswirkungen können beim beruflichen Umgang mit Cannabis sativa durch den Kontakt mit organischen Stäuben, Schimmelpilzen, Bakterien und Endotoxinen entstehen, die den Pflanzen anhaften (Sussman et al. 2020). Auch können Ozon, Desinfektionsmittel, Putzmaterialien und Pestizide beim Anbau zum Einsatz kommen, die als respiratorische Irritanzien wirken können (Reeb-Whitaker et al. 2022).
Im Fall des Zollmitarbeiters entschieden wir uns zur Erhärtung der Verdachtsdiagnose zur Durchführung eines Reibtests (Rueff et al. 2010) mit dem von ihm mitgebrachten Material; alternativ kann ein Prick-zu-Prick-Test mit frischem Material, wenn verfügbar, erfolgen. Bei beiden Vorgehen ist eine Standardisierung erschwert; die Sensitivität und die Aussagekraft sind abhängig von der Qualität des verwendeten Materials (Rueff et al. 2010; Decuyper et al. 2020).
Die Bestimmung der spezifischen IgE für Cannabis sativa sowie Kreuzallergene und rekombinante Allergene erfolgte im Kompetenz-Zentrum Allergologie/Immunologie am Institut für Prävention und Arbeitsmedizin der Deutschen Gesetzlichen Unfallversicherung in Bochum (IPA). Die Untersuchungen auf Umweltallergene erfolgten über ein kommerzielles Labor. Aufgrund der möglichen Kontamination von Cannabis-Proben mit Schimmelpilzen war eine allergische Sensibilisierung gegen diese ein weiterer Fokus unserer Untersuchungen. Auf Lungenfunktionsuntersuchungen wurde zunächst verzichtet, da die Anamnese nicht auf ein Asthma bronchiale hindeutete. Im Rahmen des Anerkennungsverfahrens einer BK Nr. 4301 sollte dies ergänzt werden, um frühzeitig Hinweise auf einen „Etagenwechsel“ der obstruktiven Atemwegserkrankung zu erhalten.
Ein arbeitsplatzbezogener Inhalationstest gilt als Goldstandard für die Feststellung einer berufsbedingten allergischen obstruktiven Atemwegserkrankung (Preisser et al. 2021). In Bezug auf Cannabis sativa wird dies in der Literatur bisher nicht empfohlen, begründet mit möglichen rechtlichen Schwierigkeiten und potenziellen gesundheitlichen Effekten durch Inhalation von Cannabis (Skypala et al. 2022; Decuyper et al. 2020). Gleiches ist für eine nasale Applikation mit dem sensibilisierenden und potenziell auch toxischen Stoff anzunehmen.
In der Literatur finden sich Hinweise, dass die Form des Kontakts (Rauchen, Hautkontakt, orale Aufnahme, Inhalation von Staub oder Pollen) und die Sorte der Cannabis-Pflanze die Art der Sensibilisierung beeinflussen und Auswirkungen auf Erscheinungsbild und Ausprägung der Allergie haben können. Daher kann privates Nutzen zusätzlich zur beruflichen Exposition einen Einfluss auf die gezeigte Symptomatik haben (Decuyper et al. 2020; Stepuniak u. Kanani 2021).
Rechtliche Hindernisse wurden unter anderem als Gründe genannt, warum die bisherige internationale Forschung in Bezug auf Allergiediagnostik und berufsbezogene gesundheitliche Beschwerden durch Cannabis erschwert war (Toscano et al. 2022). So ist weder in Bezug auf die Gesamtbevölkerung noch im beruflichen Kontext die Krankheitslast von Cannabis-Allergien bekannt (Decuyper et al. 2020). Für den Staat Washington zeigt allerdings eine Beobachtung einen Anstieg an Fällen von berufsbedingtem Asthma nach Legalisierung des privaten Cannabis-Konsums (Reeb-Whitaker et al. 2022). Weitere Erkenntnisse zu der Häufigkeit von Cannabis-Allergien und gesundheitlichen Effekten von Cannabis, insbesondere im beruflichen Umfeld, sind notwendig. Zudem besteht Forschungsbedarf in Bezug auf die Relevanz der identifizierten Allergene und die Validierung der Allergietests, um eine Etablierung der Cannabis-Allergiediagnostik in der klinischen Praxis zu ermöglichen.
In Deutschland ist Landwirten der Anbau von Nutzhanf bis zu einem Tetrahydrocannabinol-(THC-)Gehalt von 0,2 % erlaubt; die Kontrolle obliegt der Bundesanstalt für Landwirtschaft und Ernährung, bei der der Anbau angezeigt werden muss. Die verschiedenen Bestandteile des Nutzhanfs werden unter anderem in der Textil-, Lebensmittel- und Kosmetikindustrie verwendet – mit steigender Nachfrage nach „Lifestyle-Hanfprodukten“ (Mühlhausen 2022).
Im Jahr 2017 trat eine Gesetzesänderung in Kraft, die Ärztinnen und Ärzten in Deutschland das Verschreiben von Cannabis-Arzneimitteln erlaubt. Produktion und Vertrieb von Cannabis mit höherem THC-Gehalt zu medizinischen Zwecken in Deutschland wird über die am Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) errichtete Cannabisagentur in Auftrag gegeben und kontrolliert. Erstmals wurde 2021 medizinisches Cannabis in Deutschland geerntet, zuvor stammte es vollständig aus Importen. Gemäß des aktuellen Koalitionsvertrags der Bundesregierung von 2021 soll außerdem die kontrollierte Abgabe von THC-haltigem Cannabis zu Genusszwecken in Deutschland eingeführt werden. Es ist somit zu erwarten, dass es auch in Deutschland zukünftig mehr Arbeitsplätze geben wird – in Herstellung, Verarbeitung und Vertrieb von Cannabis-Produkten, im Gesundheitssektor und in forensischen Laboratorien und Strafverfolgungsbehörden – an denen Beschäftigte Cannabis-Allergien entwickeln können.
Schlussfolgerungen
Die Unfallversicherungsträger, die Betriebsmedizinerinnen und -mediziner sowie die Beschäftigten sollten mögliche gesundheitliche Effekte des beruflichen Umgangs mit Cannabis sativa kennen sowie Maßnahmen der primären und sekundären Prävention ergreifen.
Danksagung: Das Autorenteam dankt Prof. Dr. rer. nat. Monika Raulf und ihrem Team am Kompetenz-Zentrum Allergologie/Immunologie, IPA Bochum, für den fachlichen Austausch und die Bestimmung der IgE gegen Cannabis.
Interessenkonflikt: Das Autorenteam gibt an, dass keine Interessenkonflikte vorliegen.
Literatur
Bundesanstalt für Landwirtschaft und Ernährung: Anbau von Nutzhanf. https://www.ble.de/DE/Themen/Landwirtschaft/Nutzhanf/nutzhanf_node.html (zuletzt abgerufen am 07.12.2022).
Bundesinstitut für Arzneimittel und Medizinprodukte: Cannabis als Medizin>Cannabisagentur. https://www.bfarm.de/DE/Bundesopiumstelle/Cannabis-als-Medizin/Cannabis… (zuletzt abgerufen am 07.12.2022).
Decuyper II, Green BJ, Sussman GL, Ebo DG, Silvers WS, Pacheco K, King BS, Cohn JR, Zeiger RS, Zeiger JS, Naimi DR, Beezhold DH, Nayak AP: Occupational allergies to Cannabis. J Allergy Clin Immunol Practice 2020; 8): 3331–3338.
Mühlhausen C: Hanf-Hype: Trend mit großem Marktpotential. https://www.zukunftsinstitut.de/artikel/health-trend-hanf-cannabis/ (zuletzt abgerufen am: 22.11.2022).
Preisser AM, Koschel D, Merget R, Nowak D, Raulf M, Heidrich J: AWMF-002/026 – S2k-Leitlinie: Arbeitsplatzbezogener Inhalationstest (AIT) – specific inhalaltion challenge (SIC) Stand 01/2021. https://register.awmf.org/de/leitlinien/detail/002-026 (zuletzt abgerufen am: 22.11.2022).
Reeb-Whitaker C, LaSee CR, Bonauto DK: Surveillance of work-related asthma including the emergence of a cannabis-associated case series in Washington State. J Asthma 2022; 59: 1537–1547.
Ruëff F, Bergmann K-C, Brockow K, Fuchs T, Grübl A, Jung K, Klimek L, Müsken H, Pfaar O, Przybilla B: Hauttests zur Diagnostik von allergischen Soforttypreaktionen. Allergo Journal 2010; 19: 402–415.
Toscano A, Ebo DG, Abbas K, Brucker H, Decuyper II, Naimi D, Nanda A, Nayak, AP, Skypala IJ, Sussman G, Zeiger JS, Silvers WS: International Cannabis Allergy, Collaboration. A review of cannabis allergy in the early days of legalization. Ann Allergy Asthma Immunol 2022; S1081–1206.
Toscano A, Elst J, van der Poorten ML, Beyens M, Heremans K, Decuyper II, Van Gasse AL, Mertens C, Van Houdt M, Hagendorens MM, Sabato V, Ebo DG: Establishing diagnostic strategies for cannabis allergy. Exp Rev Clin Immunol 2022; 18: 1015–1022.
Skypala IJ, Jeimy S, Brucker H, Nayak AP, Decuyper II, Bernstein JA, Connors L, Kanani A, Klimek L, Lo SCR, Murphy KR, Nanda A, Poole JA, Walusiak-Skorupa J, Sussman G, Zeiger JS, Goodman RE, Ellis AK, Silvers WS, Ebo DG: Cannabis-related allergies: An international overview and consensus recommendations. Allergy 2022; 77: 2038–2052.
Stepaniuk P, Kanani A: Selective cannabis strain allergy in a patient presenting with a local allergic reaction. Allergy Asthma Clin Immunol 2021; 17, 49.
Sussman GL, Beezhold DH, Cohn JR, Silvers WS, Zeiger JS, Nayak AP: Cannabis: an emerging occupational allergen? Ann Work Exp Health 2020; 64: 679–682.
Kontakt
Dr. med. Julia Pieter
Universitätsklinikum Hamburg-Eppendorf (UKE)
Zentralinstitut für Arbeitsmedizin und Maritime Medizin (ZfAM)
Seewartenstraße 10, Haus 1
20459 Hamburg
j.pieter.ext@uke.de
Das PDF dient ausschließlich dem persönlichen Gebrauch! - Weitergehende Rechte bitte anfragen unter: nutzungsrechte@asu-arbeitsmedizin.com.