Prävalenz des nichtmedizinischen Cannabiskonsums
Cannabis ist auch in Deutschland bei Jugendlichen und bei Erwachsenen die bei weitem am häufigsten konsumierte illegale Substanz. Laut dem letzten epidemiologische Suchtsurvey hatten 2018 geschätzt etwa 3,4 Millionen deutsche Erwachsene (7,1 %, Frauen: 5,3 %, Männer: 8,9 %) in den letzten 12 Monaten mindestens einmal Cannabis konsumiert, was im Bereich des europäischen Mittelwertes liegt (Atzendorf et al. 2019). Die 12-Monats-Prävalenz des Cannabiskonsums von 12-bis 17-Jährigen liegt bei 7,3 % (Piontek et al. 2018). Die Differenzierung der Erwachsendaten zeigt den stärksten Konsum in der Altersklasse von 18 bis 24 Jahren (12-Monats-Prävalenz ca. 20 %). Vor allem ab dem vierten Lebensjahrzehnt stoppen viele ihren sporadischen Cannabiskonsum (beispielsweise liegt die 12-Monats-Prävalenz der 60- bis 64-Jährigen bei 0,4%; Piontek et al. 2018). Der chronische, beinahe tägliche Cannabiskonsum ist seltener, und schätzungsweise sind gegenwärtig etwa 1,1 % der Erwachsenen süchtig nach Cannabis (Missbrauch: 0,5 %, Abhängigkeit: 0,6 % – analog DSM-IV-R; Atzendorf et al. 2019), in der Altersgruppe 18–25 Jahre sind es etwa 3 %.
Risiken für die psychische Gesundheit
Besondere Gefahren ergeben sich für Heranwachsende, da sich regelmäßiger Alkohol- oder Drogenkonsum einschließlich Cannabiskonsum negativ auf die Entwicklung frontaler Hirnleistungen (sog. Exekutivleistungen) auswirken kann, die unter anderem verantwortlich sind für prosoziale Kompetenzen und Selbstorganisation (Impulskontrolle, Affektregulation, Aufmerksamkeitsregulation, Arbeitsgedächtnis, strategische Zielsetzung und Handlungsplanung, Antizipation, Prioritätensetzung; Bonnet 2016). In der Altersgruppe der Jugendlichen (12- bis 17-Jährige) konsumierten nach der letzten deutschen Querschnittserhebung aus dem Jahre 2018 1,6 % regelmäßig (>10-mal pro Jahr) Cannabisprodukte; bei den jungen Erwachsenen (18- bis 25-Jährige) sind es 6,9 % (BZgA 2019). Es gibt sowohl tierexperimentelle als auch epidemiologische Hinweise darauf, dass der regelmäßige Cannabiskonsum besonders entwicklungsverzögernd wirkt, je jünger die Konsumierenden sind (Schneider 2008; Silins et al. 2014). Häufiger Cannabiskonsum scheint das Risiko für die Ausbildung einer Schizophrenie mindestens zu verdoppeln (Ortiz-Medina et al. 2018). Auch das Risiko für eine komorbide weitere Suchterkrankung, bipolare affektive Störung (OR 1,4–2,5), Depression (OR 1,3–1,6), Angsterkrankung (OR 1,3–1,7), eine psychotische Störung (OR 1,4–3,4) und Suizidalität scheint erhöht zu sein (Hoch et al. 2015). Die meisten psychischen Störungen, die direkt mit der toxischen Wirkung von nichtmedizinischen Cannabisprodukten verbunden sind, bessern sich parallel zur Länge der Abstinenz: Psychosen, Motivationsdefizite („amotivationales Syndrom“ meistens durch Dauerintoxikation), Gedächtnisstörungen, Aufmerksamkeits-, Affekt- und Impulsregulationsstörungen, Depersonalisationserleben sowie Panikattacken (Karila et al. 2014; Hall u. Degenhardt 2014; Bonnet et al. 2015). Je früher der Konsumbeginn und je stärker der Konsum oder die psychotrope Potenz von Cannabis, desto stärker das Risiko für die Ausbildung einer späteren Abhängigkeitserkrankung, psychischen Komorbidität oder Exekutivleistungsstörung (Fontes et al. 2011; Silins et al. 2014; DiForti et al. 2015; Freeman et al. 2015). Eine vergleichsweise bessere Prognose haben diesbezüglich Personen, die ihren regelmäßigen Cannabiskonsum erst nach dem 15. Lebensjahr begonnen haben (Fontes et al. 2011). Es gibt Hinweise darauf, dass kognitive Defizite von Cannabiskonsumierenden, die ihren Konsum früher begonnen haben, sich später nicht mehr vollständig erholen (Fontes et al. 2011; Meier et al. 2012; Hurd et al. 2014). Schwerer Cannabiskonsum in der Adoleszenz ist verbunden mit vermehrter Arbeitslosigkeit und dem Risiko einer späteren Erwerbsminderungsrente sowie dem Bezug von Sozialhilfe (Danielsson 2015). Eine mit dem regelmäßigen Cannabiskonsum verbundene Verschlechterung der Lebensqualität scheint im Wesentlichen auf die Beeinflussung psychischer Funktionen und weniger auf körperliche Beeinträchtigungen zu beruhen (Cougle et al. 2015).
Risiken für die körperliche Gesundheit
Im Rausch (s. auch Infokasten) finden sich häufig eine Tachykardie sowie Blutdruckschwankungen, die jedoch bei kardial Gesunden kaum zu spürbaren Beeinträchtigungen führen (Thomas et al. 2014). Allerdings birgt der Cannabiskonsum bei kardialer Vorerkrankung Risiken, da in seltenen Fällen bei dieser Klientel Myokard- und Hirninfarkte im Zusammenhang mit meist exzessivem Cannabiskonsum beschrieben wurden (Thomas et al. 2014). Vereinzelt wurden eine Thrombangitis-obliterans-ähnliche Arteriitis, Pankreatitis und membranöse Glomeronephritis auf den Cannabiskonsum bezogen (Bonnet et al. 2016). Häufiger sind negative aber reversible Effekte auf Fertilität und Spermatogenese (Karila 2014). Mütterlicher Cannabiskonsum in der Schwangerschaft kann zu fetalen Wachstumsverzögerungen führen, ebenso zu Früh- und Totgeburten sowie kindlichen Verhaltens- und Exekutivleistungsstörungen (Huizink et al. 2014; Conner 2015). Es kann noch nicht sicher ausgeschlossen werden, dass kontextuelle Faktoren wie zum Beispiel der Konsum von Tabak oder von anderen Substanzen beziehungsweise mangelnde Fürsorge für diese mit dem pränatalen mütterlichen Cannabiskonsum in Verbindung stehenden negativen Konsequenzen für die fetale beziehungsweise spätere kindliche Entwicklung (mit)verantwortlich sind.
Immer häufiger werden Fälle beschrieben, in denen chronische Cannabiskonsumierende eine zyklische Hyperemesis entwickelt haben, die in der Akutphase (häufig) resistent gegen übliche Antiemetika ist, durch heißes Duschen oder Baden gelindert werden kann und in der Abstinenz wieder komplett verschwindet. Typischerweise tritt die zyklische Hyperemesis erst im Verlauf eines längeren Cannabiskonsums auf, ist oft heftig ausgeprägt und mit intensiver, allerdings häufig nicht richtungsweisender Diagnostik verbunden, da diese am ehesten paradoxe Wirkung von Cannabis noch wenig geläufig ist. Hervorgehoben werden soll, dass diese Erkrankung neben einem erheblichen Leidensdruck auch lebensbedrohliche Ausmaße annehmen kann, beispielsweise durch prärenales Nierenversagen oder schwere Elektrolytverschiebungen, und nur durch kompletten Cannabisverzicht vollständig heilbar ist (Bonnet 2016).
Am häufigsten treten negative Auswirkungen auf das respiratorische System in Form von chronischer Bronchitis und gegebenenfalls einem Lungenemphysem auf, wobei mitinhalierte Tabakprodukte und Kontaminationen hier eine dominierende Rolle zu spielen scheinen (Rooke et al. 2013). Allerdings scheint auch die Inhalation von reinem Cannabis, das immerhin mehr als 420 verschiedene chemische Substanzen beinhaltet (Karila et al. 2014), COPD („chronic obstructive pulmonary disease“) fördernde Eigenschaften zu haben (Winhusen 2019). Nach anhaltender Konsumreduktion kommt es in der Regel zur Remission der Bronchitis (Hancox et al. 2015). Im Vergleich zu Nichtkonsumierenden sollen Cannabiskonsumierende ein vermehrtes Risiko für ein metabolisches Syndrom (vermehrtes viszerales Fett, Insulinresistenz, niedrigeres HDL-Cholesterin) aufweisen (Muniyappa et al. 2013), wobei aber auch genau das Gegenteil gefunden wurde (Penner et al. 2013) und sogar Hinweise existieren, dass durch Cannabiskonsum weniger häufig eine nichtalkoholische Fettleber auftritt (Adejumo et al. 2017). Andererseits ist regelmäßiger Cannabiskonsum bei Patientinnen und Patienten mit chronischer Hepatitis C wiederum als unabhängiger Risikofaktor für die Fibrose- und Steatose-Progression identifiziert worden (Tarantino et al. 2014). Zunehmend sind Kontaminationen von Cannabispräparaten zum Beispiel mit Blei, Mikroglasperlen, Lösungsmitteln, Pestiziden entdeckt worden, die unter anderem für Geschwüre in der Mundschleimhaut, Halsschmerzen, persistierenden Husten und in einem Fall für eine wiederholt auftretende Myoperikarditis verantwortlich gemacht wurden (McLaren et al. 2008; Rodríguez-Castro et al. 2014). Sogar Forschungschemikalien (z. B. synthetische Cannabinoide) sind in Cannabisprodukten identifiziert worden, die absichtlich beigemischt wurden, um deren berauschende Potenz zu steigern – mit unter Umständen fatalen Auswirkungen auf die Gesundheit (Bonnet et al. 2016). Todesfälle durch reine Cannabisintoxikationen sind äußerst selten, sind aber beschrieben, am ehesten auf der Grundlage von Arteriitiden oder kardiovaskulären beziehungsweise zerebrovaskulären Vorschädigungen (Hartung et al. 2014; Thomas et al. 2014). In Verbindung mit dem Konsum von nichtmedizinischen synthetischen Cannabinoid-Produkten sind inzwischen sehr viel mehr Todesfälle in der wissenschaftlichen Literatur beschrieben worden (Bonnet et al. 2016). Das toxische Risiko von nichtmedizinischen synthetischen Cannabinoiden ist deutlich stärker als das von nichtmedizinischen Cannabisprodukten (Bonnet et al. 2016), deren Toxizität indes deutlich geringer eingeschätzt wird als die von Alkohol oder Tabak (van Amsterdam et al. 2015).
Das Cannabisentzugssyndrom
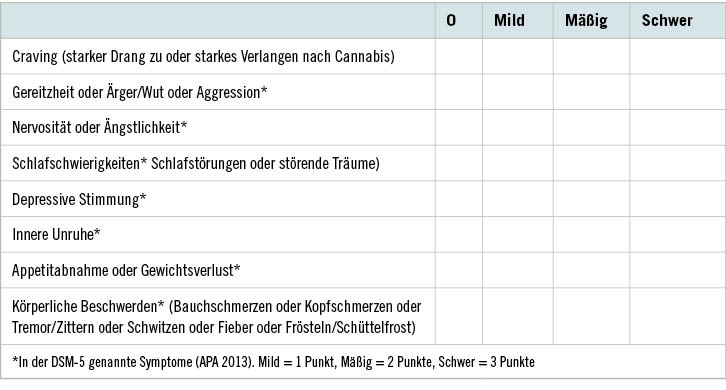
Typische Entzugssymptome (➥ Tabelle 1) treten umso wahrscheinlicher auf, je häufiger zuvor Cannabis konsumiert wurde. Insbesondere bei Frauen kann auch Übelkeit dazukommen (Bonnet u. Preuss 2017). Bei abruptem Stopp eines annährend täglichen Cannabiskonsums ist der Leidensdruck des anschließenden Entzugssyndroms vergleichbar mit dem eines mittelschweren depressiven Syndroms oder eines mittelschweren Alkoholentzugssyndroms (Bonnet u. Preuss 2017). Seit einigen Jahren zeigt sich in den Industrieländern eine Veränderung des Cannabinoid-Gehalts in sichergestellten illegalen Marijuana-Züchtungen (Anstieg von „psychotropem“ Delta-9-Tetracannabinol [THC] und Abfall von „protektivem“ Cannabidiol; Swift et al. 2013; Bonnet 2016). Diese Entwicklung könnte einen Einfluss auf die Ausprägung des Cannabisentzugssyndroms haben. Das Cannabisentzugssyndrom erlangte besonders seit Ende der 1990er Jahre die Aufmerksamkeit von Klinikern (Budney et al. 1999), nachdem sich in Zivilisationsländern die Zahl der Konsumierenden häufte, die ohne professionelle Hilfe nicht mehr in der Lage waren, ihren regelmäßigen Cannabiskonsum nachhaltig zu beenden und die damit verbundenen, vor allem sozialen Probleme zu bewältigen (Hall u. Degenhardt 2014; Karila 2014). Während die Symptomatik des Cannabisentzugssyndroms in der ICD-10 noch sehr unscharf definiert wurde (Dilling et al. 2004), ist das Syndrom inzwischen in das DSM-51 aufgenommen worden (APA 2013). Die Cannabisentzugs-Skala in Tabelle 1 beschreibt die durch viele klinische Studien mittlerweile gut validierte Symptomatik (Bonnet u. Preuss 2017).
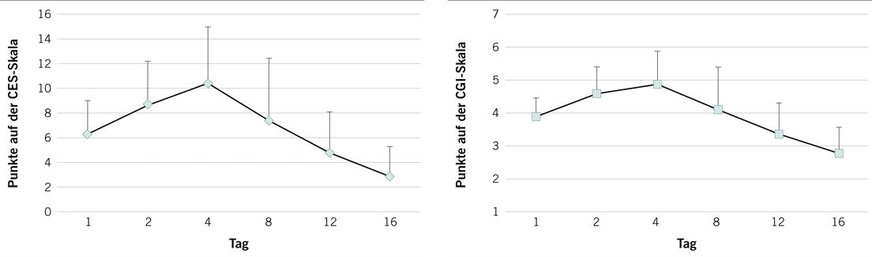
Der charakteristische Verlauf eines Cannabisentzugssyndroms nach chronischem Cannabiskonsum ist in ➥ Abb. 1 gezeigt. Nach abrupter Beendigung eines längeren, annährend täglichen Cannabiskonsums tritt das Entzugssyndrom innerhalb von 10 Stunden nach dem Konsumende für etwa 7 bis 21 Tage auf und kann so stark sein, dass eine stationäre Behandlung notwendig wird (Bonnet u. Preuss 2017). Betroffene profitieren in der Regel allein von allgemeinen physikalischen und pflegerischen Maßnahmen einer qualifizierten Entzugssyndrombehandlung (Q.E.)2 im abstinenzkontrollierenden Setting (Holzbach et al. 2006; Bonnet et al. 2016). Auch Akupunktur kann beruhigen und die Entzugssymptome unspezifisch lindern. Bei stärkeren Symptomen können kurzfristig bei Schlafstörungen Hypnotika inklusive niedrig-dosiertes Mirtazapin, bei Hyperhidrosis Baldrian- und Salbeipräparate und bei innerer Unruhe und Reizbarkeit niederpotente Neuroleptika (z.B. 4-mal 15 bis 50 mg Chlorprothixen) oder sedierende Antikonvulsiva (4-mal 100 bis 400 mg Gabapentin pro Tag) helfen (Bonnet et al. 2016). Bei quälenden vegetativen Entzugszeichen kann Clonidin eingesetzt werden. Sollten schwere Symptome dadurch nicht gelindert werden, können Benzodiazepine nützen (z.B. 0,25 bis 1 mg Clonazepam), die jedoch wegen des eigenen erheblichen Abhängigkeitspotenzials innerhalb der nächsten 1 bis 3 Wochen wieder ausschleichend abgesetzt werden müssen (Bonnet et al. 2016). Sollten die Beschwerden dann noch anhalten, liegt sehr wahrscheinlich eine komorbide Störung vor – nach Erfahrung des Autors meistens eine Angsterkrankung oder affektive Störung.
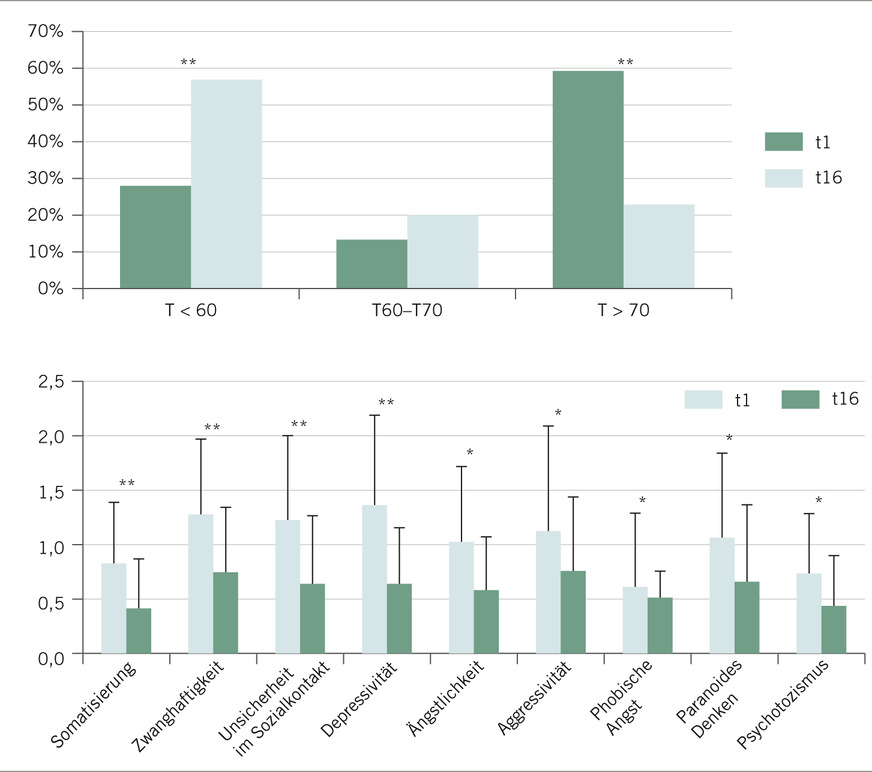
Bezüglich der Bedeutung der Behandlung des Entzugssyndroms für die Verbesserung der Gesundheit und Abstinenzfähigkeit überwiegen bisher positive Befunde (Bonnet et al. 2017). Hier besteht jedoch noch deutlicher Forschungsbedarf: Den positiven Effekt einer stationären qualifizierten Entgiftung auf die psychische Befindlichkeit von behandlungssuchenden erwachsenen Cannabisabhängigen zeigt ➥ Abb. 2.
Interessenkonflikt: Der Autor gibt an, dass kein Interessenkonflikt vorliegt.
Literatur
Atzendorf J, Rauschert C, Seitz N-N, Lochbühler K, Kraus L: Gebrauch von Alkohol, Tabak, illegalen Drogen und Medikamenten. Schätzungen zu Konsum und substanzbezogenen Störungen in Deutschland. Dtsch Ärztebl Int 2019; 116: 577–584.
Bonnet U, Specka M, Scherbaum N: Häufiger Konsum von nicht-medizinischem Cannabis. Gesundheitliche Folgen und Wirkung der Entzugsbehandlung. Dtsch Med Wochenschr 2016; 141: 126–131.
Bonnet U, Preuss UW: The cannabis withdrawal syndrome: current insights. Subst Abuse Rehabil 2017; 8: 9–37.
Budney AJ, Novy PL, Hughes JR: Marijuana withdrawal among adults seeking treatment for marijuana dependence. Addiction 1999; 94: 1311–1322.
Danielsson AK, Falkstedt D, Hemmingsson T, Allebeck P, Agardh E: Cannabis use among Swedish men in adolescence and the risk of adverse life course outcomes: results from a 20 year-follow-up study. Addiction 2015; 110: 1794–1802.
Fontes MA, Bolla KI, Cunha PJ, Almeida PP, Jungerman F, Laranjeira RR, Bressan RA, Lacerda AL: Cannabis use before age 15 and subsequent executive functioning. Br J Psychiatry 2011; 198: 442–447.
Eine ausführliche Literaturliste mit weiterführenden Quellen kann auf der ASU-Homepage beim Beitrag eingesehen werden (www.asu-arbeitsmedizin.com).
Weitere Infos
BZgA (Bundeszentrale für gesundheitliche Aufklärung). Forschungsbericht Juni 2019. Der Cannabiskonsum Jugendlicher und junger Erwachsener in Deutschland: Ergebnisse des Alkoholsurveys 2018 und Trends Köln: BZgA, 2019
https://www.bzga.de/fileadmin/user_upload/PDF/studien/Alkoholsurvey_201…
Oberlandesgericht Brandenburg, 2007. Fahrverbot und THC—Mindestgrenzwert. Az: 1 Ss (OWi) 291 B/06. Beschluss vom 30.03.2007
http://verkehrsrechtsforum.de/urteilsdatenbank/fahrverbot/teil-1/fahrve…—mindestgrenzwert.htm
Info
In Abgrenzung zum einfachen Rausch (primär entspannte Euphorie mit konsekutiver Müdigkeit, kognitiven und formalen Denkstörungen, Appetitzunahme, Depersonalisationserleben und situationsinadäquatem Witzeln) ist der komplizierte Rausch
mit Panikattacken, Verwirrtheit, absoluter Selbstüberschätzung, Agitation, Paranoia, schweren Halluzinationen oder anderen Formen der Realitätsverkennung, Suizidalität, Stürzen/Unfällen oder kardiovaskulären beziehungsweise gastrointestinalen Notfällen verbunden. Der Cannabisrausch ist in der Regel nach etwa 3–5 Stunden abgeklungen. Kognitive Beeinträchtigungen (Konzentrations- und Kurzzeitgedächtnisstörungen) können jedoch noch 48 Stunden nach der Intoxikation vorkommen. Bei der Intoxikation mit hohen Cannabisdosen oder stark psychotropen Präparationen kann es zu akut psychotischen Reaktionen und deliranten Zuständen kommen, die unter Umständen auch mehrere Tage anhalten (Bonnet 2016).
Fazit
wie chronische Bronchitis (noch ohne Lungenemphysem) Fertilitätsstörungen und zyklische Hyperemesis remittieren nach Beendigung des Cannabiskonsums.