1 Vorbemerkung
Die vorliegende Leitlinie ist eine Zusammenführung und grundlegende Überarbeitung der letztmalig im Jahr 2005 aktualisierten Leitlinie „Nutzung der Herzschlagfrequenz bei arbeitswissenschaftlichen Untersuchungen“ (AWMF 002-012, Autoren: Frauendorf H, Pfister EA, Wirth D) [81] und der im Jahr 2006 letztmalig aktualisierten Leitlinie „Herzrhythmusanalyse in der Arbeitsmedizin“ (AWMF 002-021, Autoren: Pfister EA, Böckelmann I, Rüdiger H, Seibt R, Stoll R, Vilbrandt R) [197]. Seit der Entstehung dieser Leitlinien sind für die Erfassung und Analyse der Herzschlagfrequenz und Herzfrequenzvariabilität 1 Weiterentwicklungen zu verzeichnen, weshalb dem „Forum Arbeitsphysiologie“ der Deutschen Gesellschaft für Arbeitsmedizin und Umweltmedizin e. V. (DGAUM) und der Gesell-schaft für Arbeitswissenschaft e. V. (GfA) eine Überarbeitung dieser beiden Leitlinien notwendig erschien. Aufgrund ähnlicher Erfassungs-methoden für diese beiden physiologischen Parameter wurden beide Leitlinien unter Wegfall der Herzrhythmusanalyse zusammengelegt.
Diese Leitlinie wurde für den arbeitsmedizinischen bzw. ‑wissenschaftlichen Einsatz in Praxis und Forschung entwickelt, um die Einschätzung von Belastungen und die Beurteilung von Gefährdungen am Arbeitsplatz durch objektive physiologische Beanspruchungsparameter zu vervollständigen. Die Leitlinie gibt einen Überblick über die Einflussfaktoren auf die Regulation von Herzschlagfrequenz und Herzfrequenzvariabilität in Ruhe und unter den Bedingungen von Arbeitsbelastungen. Sie zeigt methodische Möglichkeiten der Messung im Labor und unter realen Arbeitsplatzbedingungen auf. Dabei werden ausgewählte Messmethoden und Anwendungsgebiete sowie Maßnahmen zur Qualitätssicherung bei der Erfassung und Auswertung der Herzschlagfrequenz und der Herzfrequenzvariabilität beschrieben.
2 Einleitung
Die Herzschlagfrequenz gibt Informationen über die Beanspruchung des Herzkreislaufsystems als Reaktion auf Belastungen. Die Herz-frequenzvariabilität liefert zusätzliche Informationen über die Mechanismen der Herzkreislaufregulation [113]. Diese beiden physiologischen Parameter sind seit Jahren aufgrund der nichtinvasiven, komfortablen Mess- und Analysetechnik, der Auswertung und der Anwendung in der stationären und ambulanten Versorgung (u. a. Kardiologie, Intensivmedizin, Endokrinologie, Neurologie, Arbeits-, Sport- und Geburtsmedizin) sowie in den verschiedenen Forschungs-bereichen der Medizin und Naturwissenschaften (u. a. Arbeitsphysio-logie, Sportphysiologie, Arbeitswissenschaft, Psychologie und Pharmakologie) etabliert.
Die bis Ende des 20. Jahrhunderts eingesetzte Aufzeichnung über Holter-Bandsysteme wurde im Zuge des technologischen Fortschritts durch Festspeichersysteme ersetzt. Aufgrund der damit einhergehenden Qualitätsverbesserung für die Aufzeichnung der Herzaktionen und die Auswertung der HRV [146] wird im weiteren Verlauf nicht mehr auf diese Bandsysteme eingegangen.
3 Definitionen
Als Herzschlagfrequenz (Hf) wird die Anzahl der Herzaktionen während einer Minute bezeichnet. Sie lässt sich auch aus dem Quotienten aus 60 000 und dem mittleren NN-Intervall 2 in Millisekunden berechnen. Die Hf spiegelt die individuelle Herzkreislaufbelastung wider und wird durch unterschiedliche Faktoren (s. Abschnitt 7) beeinflusst. Sie ist zu unterscheiden von der Pulsfrequenz , die als Anzahl der Pulswellen pro Minute definiert ist und peripher erfasst wird (z. B. am Handgelenk, am Hals). Ein Unterschied zwischen beiden ist möglich, weil es bei bestimmten Formen von Herzrhythmusstörungen zu ineffekti-ven Herzkontraktionen kommt, die zu einem nicht messbaren Pulsschlag führen. Eine Differenz zwischen Hf und Pulsfrequenz wird als Pulsdefizit bezeichnet.
Die normale Ruheherzschlagfrequenz (HfRuhe) des Erwachsenen liegt zwischen 60 und 80 Schlägen/min (S/min), bei Kindern ist sie i. d. R. höher (bis 120 S/min). Bei ausdauertrainierten Personen können in Ruhe Werte deutlich unterhalb von 50 S/min gemessen werden.
Durch Belastungen kann die Hf bis zu einem Maximum ansteigen. Dieses Maximum wird überwiegend vom Lebensalter bestimmt und nimmt mit zunehmendem Alter ab. Die häufig verwendete Faust-formel zu Abschätzung der maximal erreichbaren Hf (Hfmax) lautet [79]:
Hfmax = 220 – Lebensalter.
Sie unterschätzt jedoch die Hfmax bei Personen oberhalb des 40. Lebens-jahres [249]. Basierend auf einer Metaanalyse sowie eigenen Untersuchungen ermittelten Tanaka et al. [249] eine Regressionsformel zur Abschätzung der altersbezogenen maximalen Hf :
Hfmax = 207 0,7 × Alter,
wobei auch hier geschlechtsspezifische Unterschiede nicht berücksichtigt werden [96, 249]. Zur Bestimmung der individuellen Hfmax ist eine Ausbelastung bei allgemeiner dynamischer Muskelarbeit notwendig, z. B. im Rahmen einer Laufband- oder Fahrradergometrie [244]. Ob Laufband oder Fahrrad richtet sich auch nach den spezifischen Belastungen des Probanden. Deshalb kommen evtl. auch andere Geräte wie das Handkurbelergometer in Betracht.
Als Indikator für den Trainingszustand der Person wird in der Sport-physiologie häufig der Hf-Wert verwendet, der nach einer Minute Erholung nach Ende der maximalen Belastung im Rahmen einer (Arbeits‑)Belastung festgestellt wird. Er zeigt die schnelle regulative Phase der Erholungsfähigkeit an und wird als Erholungsherzschlagfrequenz (HfErholung) bezeichnet.
Insbesondere im Bereich der Arbeitsmedizin und Arbeitswissen-schaft wird bei der Analyse der Beanspruchung, z. B. zur Beurteilung von körperlicher Arbeit, die Arbeitsherzschlagfrequenz 3 (HfArbeit) betrachtet. Die HfArbeit ist definiert als Differenz zwischen der HfRuhe und dem während einer Belastung gemessenem Wert [93, 106, 108]. Gelegentlich wird diese auch als Nettoherzschlagfrequenz bezeichnet [253]. Der so ermittelte Wert korreliert dann besser als die Hf mit der Arbeitsbelastung, wenn es möglich ist, vor Aufnahme der Arbeit eine Ruhephase von mindestens fünf, idealerweise 15 min, ohne körperliche und emotionale Belastung einzuhalten. Während das im Labor eine unbedingte Voraussetzung sein sollte, kann es möglich sein, dass bei Messungen am Arbeitsplatz vor Beginn einer Arbeitsschicht diese Bedingungen nicht einzuhalten sind. Dann bildet die Hf insbesondere bei körperlichen Belastungen sicherer die reale Beanspruchung ab als die auf einer erhöhten Ruhefrequenz basierende HfArbeit. Alternativ kann auch die Bezugs-herzschlagfrequenz bei leichter dynamischer Arbeit bestimmt werden (s. Abschnitt 5.2).
Als Maß für die Ermüdung und die Erholung wird in der Arbeits-medizin und Arbeitswissenschaft zudem häufig die Erholungsherzschlagsumme ermittelt, um die individuellen körperlichen Belastungen zu beschreiben [185]. Hierbei werden die Herzschläge zusammengezählt, die in der Erholungsphase (nach Beendigung der Belastung bis zum Erreichen des Ausgangswertes, z. B. der HfRuhe) oberhalb des Ausgangswerts liegen.
Der Begriff Herzfrequenzvariabilität (HRV) vereint eine Vielzahl von mathematisch berechneten Parametern, welche die Varianz, Rhythmik oder Komplexität einer Zeitreihe von aufeinander folgenden Herzaktionen – den sog. NN-Intervallen – kennzeichnet. Aufgrund der besseren Erfassung im Rahmen der automatischen Detektierung wird in der Regel die R-Zacke anstelle der P-Welle als Zeichen der Aktivität des Sinusknoten genutzt ( Abb. 1 ). Eine aus-führliche Auflistung der häufig verwendeten Parameter findet sich in Abschnitt 6.
4 Physiologische Mechanismen
4.1 Physiologische Mechanismen der Hf
In Ruhe wird das Herz vom primären Taktgeber bzw. Erregungs-bildungszentrum, dem Sinusknoten, angetrieben. Die Eigenfrequenz des nichtinnervierten Sinusknotens wird unterschiedlich angegeben und beträgt je nach Literaturquelle 60 bis 80 Schläge pro Minute (S/min) [198, 266], bei Kindern üblicherweise mehr [101, 128]. Alle nachgeordneten, ebenfalls zur Spontandepolarisation fähigen Schritt-machergewebe (AV-Knoten, His-Bündel, Purkinje-Fasern) weisen geringere Eigenfrequenzen auf. Die autonome Modulation der Hf durch den Sympathikus und den Parasympathikus (Vagus) wird primär über den Sinusknoten vermittelt. Diese zweizügige Führung des autonomen Nervensystems wurde in verschiedenen Blockade-versuchen gezeigt: Sympathikusblockade mittels Propranolol und Vagusblockade mittels Atropin [66, 129, 130].
4.2 Physiologische Mechanismen der HRV
Die Hf ist auch bei konstanter Belastung einer physiologischen Variabilität unterworfen, die unter anderem das Zusammenspiel von Sympathikus und Parasympathikus (Vagus) widerspiegelt. Das vegetative Nervensystem führt mit seinem sympathischen Anteil über die Noradrenalinfreisetzung zu einer reduzierten Herzfrequenz-variabilität und mit seinem parasympathischen (vagalen) Anteil über die Acetylcholinfreisetzung zu einer Erhöhung der HRV [62].
Unter Ruhebedingungen und bei geringer Belastung überwiegt die parasympathische (vagale) gegenüber der sympathischen Steuerung. Das führt zu einer höheren Variabilität des Herzrhythmus: Die Unter-schiede in den Abständen zwischen zwei aufeinander folgenden Herz-aktionen nehmen zu.
Die HRV-Analyse dient insbesondere dazu, dieses Zusammenspiel von Sympathikus und Parasympathikus bei unterschiedlichen Anforderungen differenzierter abschätzen zu können. Dabei lässt sich die autonome Aktivität vor allem durch die Analyse rhythmischer Schwankungen der Herzschlagfolge quantifizieren. Schnelle Änderungen der Hf mit einer Zyklusdauer von etwa 2–7 Sekunden sind eng mit der Atmung assoziiert (Respiratorische Sinusarrhythmie [RSA]). Diese hochfrequenten Schwankungen werden fast aus-schließlich über den parasympathischen Zweig des autonomen Nervensystems (N. vagus) moduliert; langsame Schwankungen (Zyklus-dauer etwa 10 Sekunden) dagegen sowohl durch sympathische als auch parasympathische Efferenzen [16]. Letztlich muss bei der Inter-pretation von Hf und HRV immer berücksichtigt werden, dass beide Parameter zwar primär das Endergebnis der Wirkung autonomer kardialer Efferenzen darstellen, aber darüber hinaus auch andere modulierende Faktoren wie körperliche Belastung, Hitze und weitere Umweltbedingungen Einfluss besitzen.
Der vagale Ruhetonus ist umso höher, je besser das Herz an die Bewältigung hoher physischer Belastungen angepasst ist, weshalb Trainierte (z. B. Ausdauersportler) neben einer geringeren HfRuhe i. d. R. eine höhere HRV haben.
5 Erfassung der NN-Intervalle für die Berechnung der Hf und der HRV
5.1 Technische Möglichkeiten und Voraussetzungen
Zur Erfassung der Abstände zwischen zwei normalen Herzaktionen stehen verschiedene Messsysteme zur Verfügung: Stationäre EKG-Geräte – besser geeignet für Laboruntersuchungen bzw. im intensiv-medizinischen Bereich – und mobile Messsysteme, die in Felduntersuchungen einsetzbar sind. Zu den mobilen Messsystemen gehören 24-h-EKG-Geräte und Brustgurtsysteme mit direkter Speicherung bzw. Speicherung auf einem ex-ternen Datenmodul (z. B. separate Pulsuhr).
Für die HRV-Analyse ist eine sog. „Beat-to-beat-Aufzeichnung“ mit Erfassung aller Herzaktionen und hoher Abtastrate (idealer-weise 1000 Hz) sinnvoll, um die Abstände zwischen den einzelnen Herzaktionen mit hoher zeitlicher Genauigkeit zu erfassen.
Darüber hinaus sollten eingesetzte Ge-räte folgende Voraussetzungen erfüllen:
- Nichtinvasivität,
- mechanische Robustheit (vor allem bei Felduntersuchungen an Arbeitsplätzen mit körperlicher Schwerarbeit bzw. Umgebungsbedingungen wie Hitze, Nässe, Kälte usw.) und
- Rückwirkungsfreiheit (das Verfahren darf das Messergebnis selbst nicht beeinflussen).
Die Vor- und Nachteile einzelner Messsysteme sind in Tabelle 1 zusammengestellt.
5.2 Elektroden
Um Fehler bei der Messung zu vermeiden, sollten
- Klebeelektroden verwendet werden, die auch über einen langen Erfassungszeitraum von 24 Stunden und bei entsprechender Schweißproduktion der untersuchten Person ohne Hautkontakt-verlust einsetzbar sind,
- die Elektroden am Brustgurt (Abnahmestellen) befeuchtet sein,
- ein guter Sitz des Brustgurtes garantiert sein und
- ein textiles Gurtband bevorzugt werden, da es sich optimal an die individuelle Oberkörperform anpasst.
5.3 Vorbereitung der Haut
Um ein optimales Messergebnis auch über einen längeren Zeitraum (24 h) zu erzielen, muss die Haut sorgfältig vorbereitet werden. Bei einem hochohmigen Haut-Elektroden-Kontakt ist die Qualität der Aufzeichnung geringer und die Wahrscheinlichkeit für das Auftreten von Artefakten erhöht.
Die Hautvorbereitung hat das Ziel, den Fettfilm der Haut zu ent-fernen, um den Elektroden-Haut-Übergangswiderstand zu vermindern und eine bessere Haftung der Elektroden zu ermöglichen. Die Haut wird am vorgesehenen Elektrodensitz mit hautverträglicher, fettlösender Flüssigkeit (z. B. Alkohollösung) abgerieben. Oberstes Prinzip ist jedoch, die Haut nicht zu beschädigen oder zu verletzen. Bei Brusthaarwuchs ist ggf. eine sorgfältige Entfernung der Behaa-rung an den entsprechenden Klebestellen vor Anbringen der Klebeelektroden notwendig. Eine zusätzliche Fixierung der Elektroden und der Elektrodenkabel (Pflaster) erhöht die Haftdauer und verhindert das schnelle Abreißen der Elektroden bzw. der Kabelendstücke.
5.4 Auswahl der Ableitung und Positionierung der Elektroden
Es sollte die EKG-Ableitung mit der größten Amplitude der R-Zacke des QRS-Komplexes ausgewählt werden (vgl. Abb. 1). Prinzipiell ist die Aufzeichnung einer Ableitung ausreichend, allerdings sollten zur besseren Artefaktkorrektur mehrere Ableitungen gewählt werden.
Bei einer automatischen NN-Intervall-Bestimmung ist darauf zu achten, dass bei der R-Zacken-Detektion nicht zwischen unterschiedlichen Ableitungen „gesprungen“ wird. Dies kann zu einer fälschlich gemessenen Erhöhung der HRV führen, da der Zeitpunkt der ermittelten R-Zacke zwischen unterschiedlichen Kanälen relevant variieren kann. So ist der Zeitpunkt des Beginns des QRS-Komplexes in den meisten Ableitungen von Mehrkanalsystemen nahezu identisch, nicht jedoch der Zeitpunkt des Auftretens der R-Zacke, der als Grundlage für die NN-Intervallbestimmung dient [88, 267].
Die Positionierung der Elektroden beeinflusst die Qualität der Aufnahme. Bei ungeeigneter Positionierung der Elektroden kann es zur Häufung von Artefakten kommen, was sich negativ auf die Qualität der Aufnahme auswirkt. Geeignete Stellen für die Positio-nierung der Elektroden sind die Interkostalräume. Hierbei sollten möglichst glatte Hautstellen ausgewählt werden (z. B. keine er-habenen Muttermale).
5.5 Qualitätssicherung bei der Erfassung der Hf
Zur Qualitätssicherung sollten folgende Aspekte unter dem Gesichts-punkt der Praktikabilität berücksichtigt werden:
- die Bestimmung der HfRuhe 4 vor Beginn einer Belastung als Basis der Auswertungen (s. Abschnitt 8.2),
- eine Artefaktkontrolle und ggf. -bereinigung (z. B. durch visuelle Kontrolle der Daten im Rahmen der Analysen, automatische Artefaktkorrekturverfahren),
- eine möglichst hohe Abtastrate (bei der Wahl des Messgerätes sollte ein Gerät mit einer Abtastfrequenz von idealerweise 1000 Hz, d. h. Millisekunden genaues Abtasten des EKG-Signals, ver-wendet werden),
- die möglichen Einflussfaktoren je nach Fragestellung (s. Tabelle 3) und
- die Beachtung der zirkadianen Rhythmik bei vergleichenden Unter-suchungen.
5.6 Qualitätssicherung bei der Erfassung der HRV
Zur Qualitätssicherung sollten folgende Aspekte unter dem Gesichts-punkt der Praktikabilität berücksichtigt werden:
- die Ableitung eines Ruhe-EKGs vor der Analyse der HRV, um Herzrhythmusstörungen (z. B. Vorhofflimmern) auszuschließen,
- Aufzeichnungen mit mehr als 1 % von ventrikulären bzw. supra-ventrikulären Extrasystolen sollten aufgrund der scheinbaren Erhöhung der HRV kritisch begutachtet werden [214],
- eine Artefaktkontrolle und ggf. -bereinigung (z. B. durch visuelle Kontrolle der Daten im Rahmen der Analysen, automatische Artefaktkorrekturverfahren),
- die Wahl der Analysemethode (z. B. Fast-Fourier-Transformation, Autoregressives Modell, trigonometrisch regressive Spektralanalyse), um vergleichende Interpretationen zu ermöglichen (s. Abschnitt 6),
- die gewählte Messdauer (später Länge der Analysesequenz) bzw. die zu Grunde gelegte Datenmenge je nach gewählter Analysemethode bzw. Fragestellung ( Tabelle 2),
- eine möglichst hohe Abtastrate (bei der Wahl des Messgerätes sollte ein Gerät mit einer Abtastfrequenz von idealerweise 1000 Hz, d. h. Millisekunden genaues Abtasten des EKG-Signal, verwendet werden),
- die möglichen Einflussfaktoren je nach gewählter Analysemethode bzw. Fragestellung (s. Tabelle 3) und
- die Beachtung der zirkadianen Rhythmik bei vergleichenden Untersuchungen.
Im Rahmen von Kurzzeitmessungen (Aufzeichnungen kleiner als 1 Stunde) ist die Auswahl eines geeigneten, repräsentativen Bereichs der NN-Intervalle zur HRV-Analyse ein wichtiges Kriterium zur Qualitätssicherung. Hierbei sollten nichtstationäre Einschwingphasen zu Beginn der Untersuchung und Aufzeichnungen mit Artefakten möglichst nicht zur Analyse genutzt werden ( Abb. 2 ).
5.7 Weitere Störquellen
Insbesondere bei Verwendung von Brustgurtsystemen mit Funkübertragung zu einer separaten speichernden Uhr in der Nähe elek-tromagnetischer Felder von Strommasten und -leitungen [113] sowie beim Einsatz in Fahrzeugen und deren Umgebung [215, 216] sind diese hoch störanfällig. Bei körperlicher Aktivität der untersuchten Person kann es zu Artefakten durch Bewegung und durch elektrische Aktivität anderer Muskeln kommen. Bei einer EKG-Aufzeichnung kann dies im Anschluss an die Aufzeichnung entdeckt und manuell entfernt werden, während bei einer Datenerfassung ohne EKG-Aufzeichnung (wie bei den meisten Brustgurtsystemen) keine Zuordnung der Bewegungsartefakte möglich ist.
6 Analyseverfahren und Parameter der HRV
Die Quantifizierung der HRV kann mittels Methoden des Zeit- und Frequenzbereichs sowie mit Methoden der nichtlinearen Analyse erfolgen ( Abb. 3 ).
Analysen des Zeitbereichs sind in statistische und geometrische Methoden unterteilt. Während bei den statistischen Methoden die NN-Intervalle mathematisch hinsichtlich ihrer Varianz ausgewertet werden und die Rhythmusmaße mit einer Zeitdimension oder Prozentangabe versehen sind, wird die HRV bei den geometrischen Methoden anhand von geometrischen Formen bewertet. Hierzu werden z. B. Balkendiagramme, HRV-Dreiecksindizes und seine Modifikationen, dreieckige/dreischenklige Interpolationen des NN-Intervall-Balkendiagramms verwendet [20].
Zu den Analysen des Frequenzbereichs zählen die Verfahren der Fast-Fourier-Transformation, der Autoregression [35], das Zero-Crossing-Verfahren [9], die Wavelet-Analyse [9] und die trigonometrisch regressive Spektralanalyse (TRS) [212, 213]. Insbesondere die Fast-Fourier-Transformation und die Autoregression zählen zu den am weitesten verbreiteten Methoden. Hierbei werden die rhythmischen und nichtrhythmischen Schwankungen der NN-Intervallreihen im Rahmen einer Spektralanalyse in frequenzabhängige Oszillationen umgewandelt. Dadurch ist es möglich, die NN-Intervallreihen und die periodischen Oszillationen des Herzschlages in verschiedene Frequen-zen und Amplituden aufzuspalten, die wiederum verschiedene physio-logische Prozesse bzw. verschiedene Regelsysteme abbilden [213].
In einigen Fällen wird zur Analyse bei unterschiedlichen Aufzeichnungslängen auch der Lomb-Algorithmus benutzt. Dieser stellt ein Spektralanalyseverfahren von nichtäquidistant abgetasteten Mess-werten dar [168]. Der Lomb-Algorithmus ist eine sehr langsame Technik, jedoch sind Näherungsverfahren etabliert, die die Durchführung des Lomb-Algorithmus deutlich beschleunigen [202].
Die TRS Technik von Rüdiger et al. [213] beruht auf dem gleichen mathematischen Grundprinzip, allerdings arbeitet dieser Algorithmus wesentlich effektiver (und ohne Näherungslösungen), da nicht jede Frequenz im Periodogramm berechnet werden muss, sondern nur die Frequenzen, die einen wesentlichen Beitrag zur Varianzreduzierung darstellen.
Die Methoden der nichtlinearen Dynamik (z. B. Approximierte Entropie [ApEn], Sample Entropy [SampEn], Detrended Fluctuation Analysis [DFA]) [175, 241, 264] unterscheiden sich von den traditionellen Zeit- und Frequenzparametern darin, dass sie nicht die Stärke der HRV widerspiegeln, sondern eher qualitative Aspekte der NN-Zeitreihe erfassen [175]. Oftmals sind diese Methoden sowohl für Langzeit- als auch für Kurzzeitaufzeichnungen geeignet und robust gegen Artefakte.
Eine Form der Visualisierung von NN-Intervall Zeitreihen bietet der so genannte Poincaré-Plot 5 (vgl. Abb. 3). Aus der so dargestellten Punktwolke lassen sich verschiedene Indizes (z. B. Länge und Breite der Punktwolke) ermitteln und interpretieren, aber auch die Form kann Aufschluss über bestimmte Krankheitsbilder liefern [221].
Eine detaillierte Auflistung der HRV-Parameter ist in Tabelle 2 zusammengefasst.
7 Einflussfaktoren der individuellen Hf und HRV
Hf und HRV werden unabhängig von der akuten Belastung durch zahlreiche veränderbare und nicht veränderbare Faktoren beeinflusst. Wesentliche Einflussfaktoren für arbeitsmedizinische und arbeitswissenschaftliche Fragestellungen werden in Tabelle 3 beschrieben. Der Kenntnis dieser Faktoren kommt eine besondere Bedeutung bei der Bewertung und Beurteilung der Hf und HRV zu. Darüber hinaus sind in der Literatur weitere Faktoren und Erkrankungen bekannt, die jedoch für die Arbeitsmedizin und Arbeitswissenschaft weniger bedeutsam sind (z. B. HRV beim Vorliegen einer intensivmedizinisch zu behandelnden Sepsis), so dass auf die weitere Erwähnung dieser Faktoren verzichtet wird.
Auch Medikamente mit Einfluss auf das autonome Nervensystem bzw. auf das Herzreizleitungssystem sind als externe beeinflussende Faktoren bei der Bewertung und Beurteilung der Hf und der HRV zu beachten. Aufgrund der Vielzahl möglicher pharmakologischer Interaktionen seien hier nur beispielhaft die Gruppen der Betablocker (Reduzierung der Hf, langfristig keinen Einfluss auf die HRV), ACE-Hemmer (je nach Medikament Reduzierung der HRV), Antiarrhythmika (kann zu einer Erhöhung der HRV führen) und Psychopharmaka (je nach Medikament Reduzierung der HRV) genannt [69].
8 Auswertung und Interpretation von Hf und der HRV
Um die Ergebnisse von Hf- und HRV-Analysen bewerten und inter-pretieren zu können, ist es unerlässlich, im Vorfeld der Untersuchun-gen die konkrete Fragestellung, die eingesetzte Methode der Daten-erfassung und die Auswertungsstrategie aufeinander abzustimmen. Des Weiteren sind die Hf- und HRV-Parameter als Beanspruchungs-daten konkreter belasteter Personen im individuellen, psychophysio-logischen und arbeitsplatzbezogenen Gesamtkontext zu betrachten (vgl. Tabelle 3) und ggf. mit ergänzenden Methoden (u. a. Frage-bögen zur subjektiven Beanspruchung, zum Stresserleben und dem Gesundheitszustand) zu kombinieren. Zeitgleich sollte möglichst die Erfassung von physikalischen Arbeitsplatzbedingungen wie Lärm, Temperatureinflüssen etc. erfolgen.
8.1 Herzschlagfrequenz (Hf)
Wesentliche Einflussgrößen für die Hf sind vor allem dynamische Belastungen großer Muskelgruppen, aber auch statische Muskelbelastungen, die thermische sowie die psychische Belastung [56, 57]. Diese Einflussgrößen wirken gemeinsam auf das Herzkreislaufsystem und führen bei erhöhten Belastungen zu entsprechend er-höhten Werten für die Hf. So untersuchten z. B. Hettinger et al. [107] die Einflüsse bei unterschiedlicher Muskel-, Temperatur- und Wärme-strahlungsbelastung. Eine Separierung der Einzelanteile ist so nur unter kontrollierten Bedingungen möglich. So darf z. B. die Hf bei einer dynamischen Arbeit, bei der größere Muskelgruppen eingesetzt werden, nur dann für die Abschätzung des Energieumsatzes herangezogen werden, wenn die Anteile an statischen Muskelbelastungen ebenso wie die psychischen Belastungen vernachlässigbar sind und neutrale thermische Bedingungen bestehen [56].
8.2 Ruheherzschlagfrequenz (HfRuhe)
Für die Interpretation von gemessener Hf unter Arbeitsbelastungen stellt die HfRuhe einen bevorzugten Ausgangswert dar (s. Abschnitt 5.5). Hierbei gilt es, Aufnahmebedingungen (u. a. Position der Person, Dauer der Aufnahme) bei Vergleichen mit Referenzwerten zu beachten. Erhöhte und reduzierte HfRuhe können mit kardiologischen Erkrankungen assoziiert sein [50, 272]. Personen mit einer tachykarden oder einer bradykarden HfRuhe unter Berücksichtigung der Einflussfaktoren (s. Abschnitt 7) sollten ggf. ärztlich, vorzugsweise internistisch-kardiologisch untersucht werden.
Da die Ermittlung der HfRuhe in Feldstudien häufig Schwierigkeiten bereitet (Einfluss psychischer Faktoren, Umgebungsbedingungen wie Lärm etc., die nur schwierig zu kontrollieren sind), empfehlen Hettinger und Wobbe [107] die Ermittlung einer Bezugsherzschlagfrequenz (HfBezug) bei leichter dynamischer Arbeit (z. B. 20 Watt auf einem Fahrradergometer für 10 min). Infolge der auch von den Probanden als sehr leicht empfundenen Arbeit wird der „psychische Herzschlag“ weitgehend ausgeschaltet und der Einfluss der individuellen Leistungsfähigkeit ist wegen der geringen Belastung wenig ausgeprägt. Bei Männern erwartet man durch diese Belastung eine Steigerung der Hf um ca. 18,5 S/min, bei Frauen um etwa 24,5 S/min gegenüber dem Ruhewert im Liegen bei relativ geringer individueller Schwankungsbreite [107].
8.3 Maximale Herzschlagfrequenz (Hfmax)
Die Hfmax dient als Ausbelastungskriterium und sollte mittels eines standardisierten Belastungsprotokolls erhoben werden [252]. Die am weitesten verbreiteten Methoden stellen hierbei die Laufbahn- und die Fahrradergometrie dar. Die optimale Motivation zum Erbringen der maximalen Leistung und die Beachtung von Abbruchkriterien sind wesentliche Voraussetzungen zur Bestimmung der Hfmax. Es muss jedoch berücksichtigt werden, dass neben Einflussfaktoren wie Alter, Geschlecht und aktuellem Trainingszustand [96] sowie einiger bradykardisierender Medikamente [244] die ermittelte Hfmax wesentlich von der eingesetzten Muskelmasse abhängt.
Eine Interpretation der Hf zur Abschätzung der kardialen Beanspruchung der zu untersuchenden (Arbeits-)Belastung erfolgt sinnvollerweise in Bezug zur gemessenen HfRuhe und der individuell mittels standardisiertem Belastungsprotokoll gemessen Hfmax bzw. errechneten Hfmax (s. Abschnitt 3). Hier deutet eine während der (Arbeits-)Belastung gemessene Hf in der Nähe der Hfmax auf eine hohe kardiale Beanspruchung hin. Je nach eingesetzter Muskelmasse kann die (Herzschlagfrequenz-)Dauerleistungsgrenze zur Interpretation noch hinzugezogen werden (s. Abschnitt 8.5).
8.4 Erholungsherzschlagfrequenz (HfErholung)
Zur Abschätzung der Erholungsfähigkeit des kardiovaskulären und metabolischen Systems kann die HfErholung genutzt werden. Sie korre-liert hoch mit der Funktion des parasympathischen autonomen Nerven-systems [122] und nimmt nach Belastungsende exponentiell ab. Als wesentliche Einflussfaktoren bestimmen Belastungsintensität, -dauer, -methode, initialer Leistungszustand und Art der Erholung den zeit-lichen Verlauf der Wiederherstellung der Vagusaktivität [245–247].
8.5 (Herzschlagfrequenz-)Dauerleistungsgrenze
Die Dauerleistungsgrenze (DLG) bei körperlicher Arbeit ist die maximale körperliche Arbeit, die über eine Arbeitsschicht (ca. 8 Stunden) ohne fortschreitende Ermüdungserscheinung geleistet werden kann und bei der die messbaren physiologischen Parameter nach Beendigung der Belastung etwa nach 15 Minuten den Ausgangswert wieder erreicht oder unterschritten haben [253]. Insbesondere in der Arbeitswelt kann die DLG zur Identifikation von muskulär ermüdungsfreier physischer Belastung (unterhalb der DLG) und muskulär ermüdender physischer Belastung (oberhalb der DLG), jeweils bezogen auf eine 8-stündige Arbeitsschicht, genutzt werden [93, 209, 220]. Zur Bestimmung der DLG können sowohl kardiale (z. B. Hf) als auch metabolische Kennwerte (z. B. Energieumsatz, Laktat) genutzt werden. Alternativ kommt die spiroergometrische Bestimmung (z. B. 40 % der maximalen Sauerstoffaufnahme) in Betracht. Vor allem die Hf eignet sich als leicht zu erhebender kardialer Parameter zur Erfassung der kardiopulmonalen Beanspruchung. Bei allgemeiner dynamischer Belastung liegt die Dauerleistungsgrenze etwa im Bereich von 105–110 S/min, bzw. alternativ bestimmt bei HfRuhe + 30–35 S/min [253]. Zu beachten ist, dass, wie bei der individuellen HfRuhe und Hfmax, auch die zur Abschätzung der DLG genutzte Hf individuellen Unterschieden unterliegt, die sich unter anderem durch das Alter und den Grad der körperlichen Fitness erklären lassen.
Unterhalb der DLG zeigt die Hf mit zunehmender Arbeitsschwere eine lineare Zunahme. Bei einer leichten Arbeit mit zeitlich konstanter Leistung erreicht die Hf innerhalb kurzer Zeit (wenige Minuten) eine annähernd gleichbleibende Auslenkung („steady state“). Dieses „steady state“ kann prinzipiell über die gesamte 8-stündige Arbeitsschicht beibehalten werden ( Abb. 4 ).
Kurzfristige geringe Überschreitungen der DLG (z. B. Hf um 130–140 S/min) sind im Arbeitsleben nicht außergewöhnlich und in der Regel ohne Gesundheitsrisiko. Bei dauernder physischer Belastung mit einer Hf > 130 S/min wird die muskuläre Ermüdung nach Belastungsende durch vorgesehene Pausen wieder abgebaut. Ermüdende Tätigkeiten sind zeitlich umso mehr zu begrenzen, je intensiver die körperliche Belastung ist und je mehr der Zustand der Erschöpfung erreicht wird, d. h. je weiter die DLG überschritten ist.
Wird die DLG ständig deutlich überschritten, wird von schwerer körperlicher Arbeit oder Schwerstarbeit im energetischen Sinne gesprochen [28]. Dies führt zu zunehmender Muskelermüdung (Hinzuziehung des anaeroben Stoffwechsels), was i. A. ohne gesundheitliche Konsequenzen reversibel ist. Die Hf steigt hierbei fortlaufend weiter an und es kommt zum sog. Ermüdungsanstieg (s. Abb. 4). Gesundheitlich bedeutsam ist darüber hinaus Schwer- und Schwerstarbeit aus motorisch-biomechanischer Sicht, da am knöchernen System (Gelenke, Bandscheiben) unter bestimmten Voraussetzungen relevante Schäden entstehen können [220]. Solche Aspekte werden in dieser Leitlinie jedoch nicht weiter vertieft.
Neben der DLG wird auch die Erholungsherzschlagsumme (s. Abb. 4) als Kenngröße der individuellen körperlichen Belastungen betrachtet [185].
Es ist zu beachten, dass die Betrachtung der oben beschriebenen DLG nur sinnvoll ist, wenn die eingesetzte Muskelmasse > 1/6 der Gesamtmuskelmasse ist. Wird dagegen kleinere Muskelmassen im Rahmen dynamischen Tätigkeiten eingesetzt, ist die DLG umso niedriger, je geringer die arbeitende Muskelmasse ist, d. h. Hf, HfArbeit und Sauerstoffaufnahme weisen in diesem DLG-Bereich niedrigere Werte als bei Ganzkörperarbeit auf, so dass sie bei reiner Arm- oder Handarbeit wegen der geringen Erhöhung nicht mehr verwertbar ist [80]. Bei statischer Arbeit bzw. bei zunehmendem Anteil statischer Muskelbeanspruchung ist eine Beurteilung der Belastungsintensität mit Hilfe der DLG ebenfalls nicht möglich.
Unter dem Gesichtspunkt der Arbeitsgestaltung sollten die Tätig-keiten einer speziellen Betrachtung unterzogen werden, die für ein Überschreiten des DLG-Bereichs als verantwortlich erkannt werden.
8.6 Herzfrequenzvariabilität (HRV)
Für die Berechnung der unterschiedlichen HRV-Parameter stehen mehrere Möglich-keiten zur Auswahl. Die HRV-Zeitbereichsparameter können prinzipiell über mathe-matische Funktionen in gängigen Tabellen-kalkulationsprogrammen berechnet werden. Weiterhin bieten viele Hersteller ambulanter EKG-Messgeräte Softwareprogramme an, die eine Berechnung von HRV-Parametern im Zeit- und Frequenzbereich, aber auch eine nichtlineare Analyse von NN-Intervallreihen ermöglichen. Auch stehen frei verfügbare Softwarepakete mit guter Dokumentation zur Verfügung.
Für Aussagen zum autonomen Nervensystem (s. Abschnitte 9.1 und 9.2) sollten geeignete HRV-Parameter herangezogen und mit einem für die Tätigkeit bzw. Ruhemessung geeigneten Zeitbereich erfasst bzw. analysiert werden (s. Tabelle 2). Hierbei ist zu berücksichtigen, ob primär ein Einfluss des sympathischen oder des parasympathischen autonomen Nervensystems gemessen werden soll bzw. wie lange die Erfassungszeit sinnvoll erfolgen kann.
Während für einige HRV-Parameter Langzeitmessungen obligat sind (s. Tabelle 2), bzw. die 24-h-Messung der HRV zur Gewinnung eines Gesamteindrucks des autonomen Nervensystems von Vorteil sein kann, sollten zur Beurteilung von Belastungen am Arbeitsplatz mit kurzfristigen Änderungen der Anforderungen primär HRV-Parameter mit einer Eignung für die Kurzzeitmessungen genutzt werden. Nach Belastungswechsel sollte die erste Minute nicht in die Datenanalyse einbezogen werden, da in dieser Phase Einschwingvorgänge der autonomen Regelkreise dominieren.
Aufgrund der hohen interindividuellen Variabilität und den zahlreichen exogenen und endogenen Einflussfaktoren, die im Rahmen einer Messung der NN-Intervalle zumeist nicht verändert werden können, sollte die HRV-Analyse nur in Kombination mit einer Ruhe-HRV-Analyse bzw. im Rahmen von länger andauernden Veränderungen durch Wiederholungsmessungen unter gleichen Bedingungen genutzt werden.
Derzeit lassen sich Einzelmessungen nach wie vor nur bedingt in erhöhte bzw. reduzierte HRV aufgrund des Fehlens von geeigneten alters- und geschlechtsabhängigen Normwerten unterscheiden. Die 1995 publizierten Referenzwerte in der Leitlinie der European Society of Cardiology and the North American Society of Pacing and Electrophysiology [69] sind aufgrund deutlich fortgeschrittener Erfassungs- und Auswertealgorithmen sowie aufgrund fehlender alters- und geschlechtsabhängiger Referenzwerte nur sehr begrenzt verwertbar. Nunan et al. [190] haben in einer systematischen Übersichtsarbeit, in die 44 bisher veröffentlichten Studien einbezogen wurden, altersunabhängige Mittelwerte für die 5-min-Kurzzeitmessung der gängigen HRV-Parameter angegeben ( Tabelle 4 ). Hierbei stellten sie geringere Mittelwerte fest, als sie 1995 in der o. g. Leitlinie publiziert wurden [69]. Jedoch sind auch die Werte von Nunan et al. [190] aufgrund des fehlenden Bezugs zum Lebensalter nur begrenzt verwertbar.
Zusammenfassend liegen derzeit keine allgemeingültigen Grenz-werte für HRV-Parameter vor. Auch sind im Moment keine generellen gesundheitsbezogenen Aussagen möglich bzw. belastbare HRV-Trennwerte für psychosoziale Belastungen bei Gesunden fehlen. Daher kann eine Interpretation von HRV-Parametern auf Grundlage einer Einzelmessung nicht erfolgen. Standardisierte Verlaufsmessun-gen (individuelle Längsschnittuntersuchungen) der HRV in Kombination mit Anamnese, klinischer Untersuchung und weiteren Instru-menten (z. B. Fragebögen) können jedoch bei der Aufklärung des individuellen Gesundheitsrisikos bzw. bei der Wirkung von präventiv-medizinischen Maßnahmen sinn- und wertvoll sein.
9 Möglichkeiten der Anwendung in der Arbeits-medizin und der Arbeitswissenschaft
Messmethoden zur Erfassung und Analyse der Hf und HRV können zur Objektivierung der Aktivität des autonomen Nervensystems ein-gesetzt werden. Im Bereich der Arbeitsmedizin und Arbeitswissenschaft ergeben sich u. a. folgende Anwendungsbereiche:
- ergänzende Untersuchung zur Gefährdungsanalyse und -beurteilung zur Identifizierung von betrieblichen Belastungsschwerpunkten,
- individuelle physische und psychische Beanspruchungsanalyse sowie prozessbegleitende Messungen zur Objektivierung der Beanspruchungen im Verlauf eines Arbeitstages,
- Erfassung eines Indikators zum Gesundheitsstatus,
- Ableitung von individuellen Handlungsempfehlungen z. B. zur Arbeitsplatzgestaltung,
- Erfassung des Ermüdungs- und Erholungsverhaltens und
- Evaluation arbeitsmedizinischer bzw. gesundheitsbezogener Interventionen.
9.1 Einsatz bei physischen Belastungen
Die Beurteilung der physischen Belastung mittels Hf, insbesondere bei allgemeiner dynamischer Muskelarbeit, ist lange etabliert. Der Informationsgewinn der HRV bei solchen Fragestellungen liegt in dem zumindest unter standardisierten Bedingungen nachweisbaren Zusammenhang zwischen HRV-Parametern und metabolischen und respiratorischen Beanspruchungsindikatoren, dem mehrphasigen Verlauf bei progressiver Belastungssteigerung unter standardisierten Bedingungen und dem Erholungsverhalten nach unterschiedlichen Belastungsintensitäten [51, 132]. Dies kann eine genauere Einschätzung der physischen Beanspruchungen bei gleichzeitigem Verzicht auf eine zeitaufwändige, kostenintensive, teilweise nicht ambulant verfügbare und reaktive Messtechnik ermöglichen. Von den HRV-Parametern eignen sich für die Erfassung der akuten physischen Belastung neben den Parametern der Gesamtvariabilität wie SDNN oder Total Power insbesondere die Parameter RMSSD, LF-Power und HF-Power sowie nichtlineare Indizes. Diese zeigen unter ansteigender Belastung oftmals ein zwei- oder mehrphasiges Verhalten und besitzen somit einen Mehrwert im Vergleich zum linearen Verhalten der Hf.
9.2 Einsatz bei psychischen Belastungen
Bei psychischen Belastungen finden sich ebenso Auslenkungen der Hf und der HRV, die somit als psychische Beanspruchungsindikatoren genutzt werden können. Vor allem bei den schwer messbaren psychischen Belastungen gelten Hf und HRV als Parameter der allgemeinen Aktivierung und bieten eine Möglichkeit, die vegetative Balance des Organismus zu beschreiben. Somit können über diesen Beanspruchungsparameter Rückschlüsse auf die stattgefundene psychische Belastung gezogen werden [1, 10, 67, 68, 123, 127, 133, 171, 177, 184, 192, 193, 258, 262]. Darüber hinaus lässt sich die HRV als Indikator für psychophysische Zustände des Organismus und als Indikator für Einschränkungen einer Adaptations- und Anpassungsfähigkeit für biopsychosoziale Fragestellungen einsetzen. Als HRV-Parameter für die psychischen Belastungen eignen sich RMSSD, LF, HF bzw. LFnu und HFnu, LF/HF sowie DQ und SD1. Nicht geeignet sind ULF und VLF. Für den Einsatz als Prädiktor für kognitive Leistungen ist nach den zurzeit vorliegenden Kenntnissen aus der Literatur die Ruhe-HRV-Messung jedoch in Querschnittsanalysen nicht geeignet [268].
9.3 Einsatz zur Risikostratifizierung für Herzkreislauf-erkrankungen
Die Hf und HRV eignen sich gut zur Risikostratifizierung für Herzkreislauferkrankungen [37, 38, 92, 200, 254, 259]. Erniedrigte HRV-Parameter (z. B. reduzierte SDNN) korrelieren in großen Kohortenstudien signifikant mit der Mortalität bei Patienten mit stattgefundenen Myokardinfarkten [34, 46, 120], Bypass-Operationen [155] oder einer vorliegenden Herzinsuffizienz [217]. Aus erniedrigten HRV-Parametern jedoch das Mortalitätsrisiko bei Gesunden abzuleiten, wird aufgrund der derzeit noch fehlenden Normwerte als kritisch betrachtet. Vielmehr können die so ermittelten HRV-Parameter als Ergänzung zu etablierten diagnostischen Untersuchungen und zur Verlaufsbeobachtung genutzt werden.
9.4 Einsatz bei Präventionsmaßnahmen
Vor allem hat sich die HRV als nützlicher Parameter zur Evaluierung von Präventionsmaßnahmen etabliert, wie z. B. bei Stressbewältigungskursen, Ernährungs-, Genussmittel-, Konsumumstellungen, sportlichen Betätigungen einschließlich der präventiven Überwachung vor Übertrainingssyndromen [111] und Maßnahmen zur Gewichtsreduktion, um im Längsschnittvergleich den Präventions- bzw. Interventionserfolg bei entsprechenden Maßnahmen einzuschätzen [250]. Eine Veränderung der sympathisch-parasympathischen Balance des autonomen Nervensystems hin zu einer höheren parasympathischen Grundaktivität (z. B. erhöhte SDNN oder RMSSD, erniedrigte LF/HF-Ratio) weist hierbei auf positive Auswirkungen der Präventionsmaßnahmen hin.
9.5 Einsatz beim Biofeedback
Bei der Stressbewältigung und in jüngster Zeit auch zur Behandlung von posttraumatischen Belastungsstörungen werden die Hf- und HRV-Parameter im Rahmen von Biofeedbackmethoden eingesetzt, z. B. für die Objektivierung von Entspannungseffekten [55, 90, 160–162, 196]. Jedoch konnten bislang lediglich kurzfristige Effekte nachgewiesen werden. Eine Langzeitwirkung ist bisher nicht belegt worden [90, 196]. Darüber hinaus müssen für die Nutzung der kurzfristigen positiven Wirkungen der HRV-Biofeedbackmethoden geeignete und validierte Methoden zum Einsatz kommen. Mit Verweis auf die Erfassung und Auswertung der HRV ergibt sich zwangsläufig, dass Biofeedbackmethoden, die die HRV mittels Puls-oximeter oder anhand der Atemtätigkeit ermitteln, nicht als valide Messinstrumente angesehen werden können und daher nicht als HRV-Biofeedbackmethode eingesetzt werden sollten.
10 Schlussbemerkungen
Die Praxistauglichkeit der Hf- und HRV-Analysen im Rahmen von Felduntersuchungen an Arbeitsplätzen ist erwiesen. Die Analysen können für verschiedene Fragestellungen zielführend eingesetzt werden, wenn die methodischen Anforderungen erfüllt sind. Unter diesen Voraussetzungen können sie nicht nur Forschungseinrichtungen, sondern auch praktizierenden Arbeitsmedizinern und Betriebsärzten empfohlen werden, zumal kardioassoziierte Aspekte in der modernen Arbeitsmedizin im Rahmen des Wandels der Arbeitswelt und der demografischen Situation der Erwerbstätigen in Deutschland eine zunehmend größere Bedeutung erlangen.
Literatur
[1] Aasman J, Mulder G, Mulder LJM: Operator effort and the measurement of heart-rate variability. Human Factors 1987; 29: 161–170.
[2] Abhishekh HA, Nisarga P, Kisan R, Meghana A, Chandran S, Trichur Raju, Sathyaprabha TN: Influence of age and gender on autonomic regulation of heart. J Clin Monit Comput 2013; 27: 259–264.
[3] Agelink MW, Malessa R, Baumann B, Majewski T, Akila F, Zeit T, Ziegler D: Standardized tests of heart rate variability: normal ranges obtained from 309 healthy humans, and effects of age, gender, and heart rate. Clin Auton Res 2001; 11: 99–108.
[4] Ahn JH, Kong M: The relationship among pulse wave velocity, ankle-brachial pressure index and heart rate variability in adult males. Korean J Fam Med 2011; 32: 406–411.
[5] Alyan O, Kacmaz F, Ozdemir O, Maden O, Topaloglu S, Ozbakir C, Metin F, Karadede A, Ilkay E: Effects of cigarette smoking on heart rate variability and plasma N-terminal pro-B-type natriuretic peptide in healthy subjects: is there the relationship between both markers? Ann Noninvasive Electrocardiol 2008; 13: 137–144.
[6] Antelmi I, de Paula RS, Shinzato AR, Peres CA, Mansur AJ, Grupi CJ: Influence of age, gender, body mass index, and functional capacity on heart rate variability in a cohort of subjects without heart disease. Am J Cardiol 2004; 93: 381–385.
[7] Araki S, Murata K, Yokohama K: Application of neurophysiological methods in occcupational medicine in relation to psychological performance. Ann Acad Med Singapore 1994; 23: 710–718.
[8] Assoumou HG, Pichot V, Barthelemy JC, Dauphinot V, Celle S, Gosse P, Kossovsky M, Gaspoz JM, Roche F: Metabolic syndrome and short-term and long-term heart rate variability in elderly free of clinical cardiovascular dis-ease: the PROOF study. Rejuvenation Res 2010; 13: 653–663.
[9] Aubert AE, Seps B, Beckers F: Heart rate variability in athletes. Sports Med 2003; 33: 889–919.
[10] Backs RW, Ryan MR: Psychological measures of workload during continuous performance. Human Factors 1994; 36: 514–531.
[11] Badra LJ, Cooke WH, Hoag JB, Crossmann AA, Kuusela TA, Tahvanainen KU, Eckberg DL: Respiratory modulation of human autonomic rhythmus. Am J Physiol 2001; 280: H2674–88.
[12] Barantke M, Krauss T, Ortak J, Lieb W, Reppel M, Burgdorf C, Pramstaller PP, Schunkert H, Bonnemeier H: Effects of gender and aging on differential autonomic responses to orthostatic maneuvers. J Cardiovasc Electrophysiol 2008; 19: 1296–1303.
[13] Benschop RJ, Geenen R, Mills PJ, Naliboff BD, Kiecolt-Glaser JK, Herbert TB, Van Der Pompe G, Miller GE, Matthews KA, Godaert GLR, Gilmore SL, Glaser R, Heijnen CJ, Dopp JM, Bijlsma JWJ, Solomon GF, Cacioppo JT: Cardiovascular and immune responses to acute psychological stress in young and old women: A meta-analysis. Psychosom Med 1998; 60: 290–296.
[14] Berger S, Kliem A, Yeragani V, Bär KJ: Cardio-respiratory coupling in un-treated patients with major depression. J Affect Disord 2012; 139: 166–171.
[15] Bernardi L, Piepoli ME: Autonomic nervous system adaption during physical exercise. Ital Heart J 2001; 2: 831–839.
[16] Berntson GG, Thomas B, Eckberg DL, Grossman P, Kaufmann PG, Malik M, Nagaraja HN, Porges SW, Saul JP, Stone PH, van der Molen MW: Heart rate variability: Origins methods, and interpretive caveats. Psychophysiology 1997; 34: 623–648.
[17] Bigger JT Jr, Fleiss JL, Steinman RC, Rolnitzky LM, Schneider WJ, Stein PK: RR variability in healthy, middle-aged persons compared with patients with chronic coronary heart disease or recent acute myocardial infarction. Circulation 1995; 91: 1936–1943.
[18] Bigger JT, Kleiger BR, Fleiss JL, Rolnitzky LM, Steinman RC, Millar JP: Components of heart rate variability measured during healing of acute myo-cardial infarction. Am J Cardiol 1988; 61: 208–215.
[19] Bilan A, Witczak A, Palusiski R, Myliski W, Hanzlik J: Circadian rhythm of spectral indices of heart rate variability in healthy subjects. J Electrocardiol 2005; 38: 239–243.
[20] Billman GE: Heart rate variability – a historical perspective. Front Physiol 2011; 2: 86.
[21] Birch SL, Duncan MJ, Franklin C: Overweight and reduced heart rate variability in British children: an exploratory study. Prev Med 2012; 55: 430–432.
[22] Birkhofer A, Schmidt G, Förstl H: Heart and brain – the influence of psy-chiatric disorders and their therapy on the heart rate variability. Fortschr Neurol Psychiatr 2005; 73: 192–205.
[23] Biswas PK, Basu S, Mitra KK, Chowdhury SP, Chatterjee BP, Das Biswas A, Chatterjee SS, Maity AK: Heart rate variability in dilated cardiomyopathy. Indian Heart J 2000; 52: 187–191.
[24] Böckelmann I, Pfister EA, McGauran N, Robra B-P: Assessing the suit-ability of cross-sectional and longitudinal cardiac rhythm tests with regard to identifying effects of occupational chronic lead exposure. J Occup Environ Med 2002; 44: 59–65.
[25] Bortkiewicz A, Gadzicka E, Szymczak W, Szyjkowska A, Koszada-Wodar-czyk W, Makowiec-Dabrowska T: Physiological reaction to work in cold microclimate. Int J Occup Med Environ Health 2006; 19: 123–131.
[26] Bortkiewicz A, Gadzicka E, Szymczak W: Heart rate variability in workers exposed to carbon disulfide. J Auton Nerv Syst 1997; 66: 62–68.
[27] Boudreau P, Yeh WH, Dumont GA, Boivin DB: Circadian variation of heart rate variability across sleep stages. Sleep 2013; 36: 1919–1928.
[28] Boutellier U: Sport- und Arbeitsphysiologie. In: Schmidt RF, Lang F, Heck-mann M (Hrsg.): Physiologie des Menschen mit Pathophysiologie. 31. Aufl. Heidelberg: Springer, 2011, S. 854–876.
[29] Bouvy ML, Heerdink ER, Leufkens HG, Hoes AW: Predicting mortality in patients with heart failure: a pragmatic approach. Heart 2003; 89: 605–609.
[30] Braith RW, Edwards DG: Neurohormonal abnormalities in heart failure: impact of exercise training. Congest Heart Fail 2003; 9: 70–76.
[31] Brito JM, Belotti L, Toledo AC, Antonangelo L, Silva FS, Alvim DS, Andre PA, Saldiva PH, Rivero DH: Acute cardiovascular and inflammatory toxicity induced by inhalation of diesel and biodiesel exhaust particles. Toxicol Sci 2010; 116: 67–78.
[32] Britton A, Malik M, Marmot M: The cardioprotective effects of alcohol con-sumption: does cardiac autonomic function play a role? Eur J Epidemiol 2008; 23: 105–108.
[33] Britton A, Shipley M, Malik M, Hnatkova K, Hemingway H, Marmot M: Changes in heart rate and heart rate variability over time in middle-aged men and women in the general population (from the Whitehall II Cohort Study). Am J Cardiol 2007; 100: 524–527.
[34] Buccelletti E, Gilardi E, Scaini E, Galiuto L, Persiani R, Biondi A, Basile F, Sil-veri NG: Heart rate variability and myocardial infarction: systematic literature review and metaanalysis. Eur Rev Med Pharmacol Sci 2009; 13: 299–307.
[35] Burr RL, Cowan MJ: Autoregressive spectral models of heart rate variability. Practical issues. J Electrocardiol 1995; 25 (Suppl): 224–233.
[36] Cagirci G, Cay S, Karakurt O, Eryasar N, Kaya V, Canga A, Yesilay AB, Kilic H, Topaloglu S, Aras D, Demir AD, Akdemir R: Influence of heavy cigarette smoking on heart rate variability and heart rate turbulence para-meters. Ann Noninvasive Electrocardiol 2009; 14: 327–332.
[37] Carnethon MR, Liao D, Evans GW et al.: Does the cardiac autonomic re-sponse to postural change predict incident coronary heart disease and mor-tality? The Atherosclerosis Risk in Communities Study. Am J Epidemiol 2002; 155: 48–56.
[38] Carnethon MR, Liao D, Evans GW, Cascio WE, Chambless LE, Heiss G: Correlates of the shift in heart rate variability with an active postural change in a healthy population sample: The Atherosclerosis Risk In Communities study. Am Heart J 2002; 143: 808–813.
[39] Carney RM, Freedland KE, Miller GE, Jaffe AS: Depression as a risk fac-tor for cardiac mortality and morbidity: a review of potential mechanisms. J Psychosom Res 2002; 53: 897–902.
[40] Carpeggiani C, L‘Abbate A, Landi P, Michelassi C, Raciti M, Macerata A, Emdin M: Early assessment of heart rate variability is predictive of in-hospital death and major complications after acute myocardial infarction. Int J Cardiol 2004; 96: 361–368.
[41] Chandola T, Britton A, Brunner E, Hemingway H, Malik M, Kumari M, Badrick E, Kivimaki M, Marmot M: Work stress and coronary heart disease: what are the mechanisms? Eur Heart 2008; 29: 640–648.
[42] Chandola T, Heraclides A, Kumari M: Psychophysiological biomarkers of workplace stressors. Neurosci Biobehav Rev 2010; 35: 51–57.
[43] Chang HA, Chang CC, Tzeng NS, Kuo TB, Lu RB, Huang SY: Decreased cardiac vagal control in drug-naive patients with panic disorder: a case-control study in Taiwan. Asia Pac Psychiatry 2013; 5: 80–89.
[44] Chang JS, Yoo CS, Yi SH, Her JY, Choi HM, Ha TH, Park T, Ha K: An integrative assessment of the psychophysiologic alterations in young women with recurrent major depressive disorder. Psychosom Med 2012; 74: 495–500.
[45] Chang YW, Lin JD, Chen WL, Yen CF, Loh CH, Fang WH, Wu LW: Meta-bolic syndrome and short-term heart rate variability in adults with intellec-tual disabilities. Res Dev Disabil 2012; 33: 1701–1707.
[46] Chattipakorn N, Incharoen T, Kanlop N, Chattipakorn S: Heart rate vari-ability in myocardial infarction and heart failure. Int J Cardiol 2007; 120: 289–296.
[47] Christensen JH, Skou HA, Fog L, Hansen V, Vesterund T, Dyerberg J, Toft E, Schmidt EB: Marine n-3 fatty acids, wine intake, and heart rate variability in patients referred for coronary angiography. Circulation 2001; 103: 651–657.
[48] Clays E, De Bacquer D, Crasset V, Kittel F, de Smet P, Kornitzer M, Karasek R, De Backer G: The perception of work stressors is related to reduced para-sympathetic activity. Int Arch Occup Environ Health 2011; 84: 185–191.
[49] Cohen H, Benjamin J, Geva AB, Matar MA, Kaplan Z, Kotler M: Autonomic dysregulation in panic disorder and in post-traumatic stress disorder: appli-cation of power spectrum analysis of heart rate variability at rest and in re-sponse to recollection of trauma or panic attacks. Psychiatry Res 2000; 96: 1–13.
[50] Cooney MT, Vartiainen E, Laatikainen T, Joulevi A, Dudina A, Graham IM: Elevated resting heart rate is an independent risk factor for cardiovascular disease in healthy men and women. Am Heart J 2010; 159: 612–619.
[51] Cottin F, Médigue C, Lopes P, Leprêtre PM, Heubert R, Billat V: Ventilatory thresholds assessment from heart rate variability during an incremental exhaustive running test. Int J Sport Med 2007; 28: 287–294.
[52] Dauphinot V, Rouch I, Kossovsky MP, Pichot V, Dorey JM, Krolak-Salmon P, Laurent B, Roche F, Barthélémy JC: Depressive symptoms and autonomic nervous system dysfunction in an elderly population-based study: the PROOF study. J Affect Disord 2012; 143: 153–159.
[53] Davies LC, Colhoun H, Coats AJ, Piepoli M, Francis DP: A noninvasive measure of baroreflex sensitivity without blood pressure measurement. Am Heart J 2002; 143: 441–447.
[54] Dehghan H, Mortazavi SB, Jafari MJ, Maracy MR: Cardiac strain between normal weight and overweight workers in hot/humid weather in the Persian Gulf. Int J Prev Med 2013; 4: 1147–1153.
[55] Del Pozo JM, Gevirtz RN, Scher B, Guarneri E: Clinical investigations – Biofeedback treatment increases heart rate variability in patients with known coronary artery disease. Amer Heart J 2004; 147: E11.
[56] DIN 8996:2004: Ergonomie der thermischen Umgebung. Bestimmung des körpereigenen Energieumsatzes (ISO 8996:2004); Deutsche Fassung EN ISO 8996:2004. Januar 2005.
[57] DIN 9886:2004: Ergonomie. Ermittlung der thermischen Beanspruchung durch physiologische Messungen (ISO 9886:2004); Deutsche Fassung EN ISO 9886:2004. Mai 2004.
[58] Dinas PC, Koutedakis Y, Flouris AD: Effects of active and passive tobacco cigarette smoking on heart rate variability. Int J Cardiol 2013; 163: 109–115.
[59] Dishman RK, Nakamura Y, Garcia ME, Thompson RW, Dunn AL, Blair SN: Heart rate variability, trait anxiety, and perceived stress among physically fit men and women. Int J Psychophysiol 2000; 37: 121–133.
[60] Diz DI, Varagic J, Groban L: Aging and the brain renin-angiotensin system: relevance to age-related decline in cardiac function. Future Cardiol 2008; 4: 237–245.
[61] Doru MT, Simek V, Sahin O, Ozer N: Differences in autonomic activity in individuals with optimal, normal, and high-normal blood pressure levels. Turk Kardiyol Dern Ars 2010; 38: 182–188.
[62] Domniak P: Pharmakologische Beeinflussung des sympathischen und para-sympathischen Nervensystems bei Herzrhythmusstörungen. In: Griebenow R, Gülker H (Hrsg.): Autonomes Nervensystem und Herzrhythmusstörungen. Stuttgart: Thieme, 1990, S. 71.
[63] Earnest CP, Lavie CJ, Blair SN, Church TS: Heart rate variability characte-ristics in sedentary postmenopausal women following six months of exercise training: the DREW study. PLoS One 2008; 3: e2288.
[64] Ebelt H, Werdan K: Septic shock and septic cardiomyopathy. Med Klin Intensivmed Notfmed 2012; 107: 24–28.
[65] Eckberg DL: The human respiratory gate. J Physiol 2003; 548: 339–352.
[66] Eckoldt K: Untersuchungen über die Wirkungen der vegetativen Herznerven mit Hilfe von unblutigen Meßverfahren. Humboldt-Universität Berlin, 1975. Habilitationsschrift.
[67] Egelund N: Heart-rate and heart-rate-variability as indicators of driver work-load in traffic situations. In: Orlebeke J, Mulder G, van Doornen L (editors). Psychophysiology of cardiovascular control: Models, methods, and data. New York: Plenum Press, 1985, S. 855–863.
[68] Egelund N: Spectral analysis of heart rate variability as an indicator of driver fatigue. Ergonomics 1982; 25: 663–672.
[69] European Society of Cardiology und North American Society of Pacing and Electrophysiology: Heart rate variability: standards of measurement, physio-logical interpretation and clinical use. Task Force of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology. Circulation 1996; 93: 1043–1065.
[70] Fagard RH, Pardaens K, Staessen JA: Influence of demographic, anthropo-metric and lifestyle characteristics on heart rate and its variability in the population. J Hypertens 1999; 17: 1589–1599.
[71] Fagard RH, Pardaens K, Staessen JA: Relationships of heart rate and heart rate variability with conventional and ambulatory blood pressure in the population. J Hypertens 2001; 19: 389–397.
[72] Fagard RH: A population-based study on the determinants of heart rate and heart rate variability in the frequency domain. Verh K Acad Geneeskd Belg 2001; 63: 57–89.
[73] Fakhrzadeh H, Yamini-Sharif A, Sharifi F, Tajalizadekhoob Y, Mirarefin M, Mohammadzadeh M, Sadeghian S, Badamchizadeh Z, Larijani B: Cardiac autonomic neuropathy measured by heart rate variability and markers of subclinical atherosclerosis in early type 2 diabetes. ISRN Endocrinol 2012; 2012: 168264.
[74] Felber Dietrich D, Ackermann-Liebrich U, Schindler C, Barthélémy JC, Brändli O, Gold DR, Knöpfli B, Probst-Hensch NM, Roche F, Tschopp JM, von Eckardstein A, Gaspoz JM, SAPALDIA Team: Effect of physical activity on heart rate variability in normal weight, overweight and obese subjects: results from the SAPALDIA study. Eur J Appl Physiol 2008; 104: 557–565.
[75] Felber Dietrich D, Schindler C, Schwartz J, Barthélémy JC, Tschopp JM, Roche F,von Eckardstein A, Brändli O, Leuenberger P, Gold DR, Gaspoz JM, Ackermann-Liebrich U, SAPALDIA Team: Heart rate variability in an age-ing population and its association with lifestyle and cardiovascular risk fac-tors: results of the SAPALDIA study. Europace 2006; 8: 521–529.
[76] Felber Dietrich D, Schwartz J, Schindler C, Gaspoz JM, Barthélémy JC, Tschopp JM, Roche F, von Eckardstein A, Brändli O, Leuenberger P, Gold DR, Ackermann-Liebrich U, SAPALDIA-team: Effects of passive smoking on heart rate variability, heart rate and blood pressure: an observational study. Int J Epidemiol 2007; 36: 834–840.
[77] Ferrari AU: Modifications of the cardiovascular system with aging. Am J Geriatr Cardiol 2002; 11: 30–33.
[78] Fox K, Borer JS, Camm AJ, Danchin N, Ferrari R, Lopez Sendon JL, Steg PG, Tardif JC, Tavazzi L, Tendera M, Heart Rate Working Group: Resting heart rate in cardiovascular disease. J Am Coll Cardiol 2007; 50: 823–830.
[79] Fox SM, Naughton JP, Haskell WL: Physical activity and the prevention of coronary heart disease. Ann Clin Res 1971; 3: 404–432.
[80] Frauendorf H, Kobryn U, Gelbrich W: Blutdruck- und Herzschlagfrequenzverhalten bei fünf verschiedenen Formen dynamischer Muskelarbeit. Z Arb-wiss 1990; 44: 214–216.
[81] Frauendorf H, Pfister EA, Ulmer HV, Wirth D: Arbeitsmedizinische Leit-linie der Deutschen Gesellschaft für Arbeitsmedizin und Umweltmedizin e. V. Nutzung der Herzschlagfrequenz bei arbeitswissenschaftlichen Untersuchun-gen. AWMF-Nr. 002-012. Arbeitsmed Sozialmed Umweltmed 2005; 41: 352–355.
[82] Friedman BH, Thayer JF: Autonomic balance revisited: panic anxiety and heart rate variability. J Psychosom Res 1998; 44: 133–151.
[83] Friedman BH: An autonomic flexibility-neurovisceral integration model of anxiety and cardiac vagal tone. Biol Psychol 2007; 74: 185–199.
[84] Fujikawa T, Tochikubo O, Kura N, Umemura S: Factors related to elevated 24-h blood pressure in young adults. Clin Exp Hypertens 2009; 31: 705–712.
[85] Fukusaki C, Kawakubo K, Yamamoto Y: Assessment of the primary effect of aging on heart rate variability in humans. Clin Auton Res 2000; 10: 123–130.
[86] Fürholz M, Radtke T, Roten L, Tanner H, Wilhelm I, Schmid JP, Saner H, Wilhelm M: Training-related modulations of the autonomic nervous system in endurance athletes: is female gender cardioprotective? Eur J Appl Physiol 2013; 113: 631–640.
[87] Furlan R, Guzzetti S, Crivellaro W, Dassi S, Tinelli M, Baselli G, Cerutti S, Lombardi F, Pagani M, Malliani A: Continuous 24-hour assessment of the neural regulation of systemic arterial pressure and RR variabilities in am-bulant subjects. Circulation 1990; 81: 537–547.
[88] García-González MA, Ramos-Castro J, Fernández-Chimeno M: The effect of electrocardiographic lead choice on RR time series. Conf Proc IEEE Eng Med Biol Soc 2011: 1933–1936.
[89] Gehi AK, Lampert R, Veledar E, Lee F, Goldberg J, Jones L, Murrah N, Ash-raf A, Vaccarino V. A twin study of metabolic syndrome and autonomic tone. J Cardiovasc Electrophysiol 2009; 20: 422–428.
[90] Gevirtz R, Dalenberg C: Heart rate variability biofeedback in the treatment of trauma symptoms. Biofeedback 2008; 36: 22–23.
[91] Ginsberg JP, Ayers E, Burriss L, Powell DA: Disruption of bradycardia as-sociated with discriminative conditioning in combat veterans with PTSD. Neuropsychiatr Dis Treat 2008; 4: 635–646.
[92] Goldberger AL: Heartbeats, hormones, and health is variability the spice of life? Am J Respir Crit Care Med 2001; 163: 1289–1290.
[93] Grandjean E: Physiologische Arbeitsgestaltung. Landsberg: ecomed, 1991.
[94] Grandjean Ph, Murata K, Budtz-Jorgensen E, Weihe P: Cardiac autonomic activity in methylmercury neurotoxicity: 14-year follow-up of a Faroese birth cohort. J Pediatr 2004; 144: 169–176.
[95] Greiser KH, Kluttig A, Schumann B, Swenne CA, Kors JA, Kuss O, Haer-ting J, Schmidt H, Thiery J, Werdan K: Cardiovascular diseases, risk factors and short-term heart rate variability in an elderly general population: the CARLA study 2002–2006. Eur J Epidemiol 2009; 24: 123–142.
[96] Gulati M, Shaw LJ, Thisted RA, Black HR, Merz CN, Arnsdorf MF: Heart rate response to exercise stress testing in asymptomatic women. Circulation 2010; 122: 130–137.
[97] Guzzetti S, Magatelli R, Borroni E, Mezzetti S: Heart rate variability in chronic heart failure. Auton Neurosci 2001; 90: 102–105.
[98] Ha M, Kim J, Park J, Chung HK: Blood pressure and heart rate variability in workers of 8-hour shifts. J Hum Ergol (Tokyo) 2001; 30: 229–233.
[99] Haas J, Liebrich A, Himmrich E, Treese N: Kurzzeitmessung der Herzfrequenz-variabilität bei Postinfarktpatienten – Methodik, Reproduzierbarkeit und Stel-lenwert im Rahmen der Postinfarktdiagnostik. Herzschr Elektrophys 2000; 11: 102–109.
[100] Haerting J, Kluttig A, Greiser KH, Nuding S, Werdan K: A cohort study in-vestigating risk factors for cardiovascular disease in an urban elderly East-German population (CARLA study). Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz 2012; 55: 795–800.
[101] Hainsworth R: The Control and Physiological Importance of Heart Rate. In: Malina RM, Camm AJ. Armonk (eds.). Heart rate variability.New York: Futura Publishing, 1995, S. 2–20.
[102] Harinath K, Malhotra AS, Pal K, Prasad R, Kumar R, Sawhney RC: Auto-nomic nervous system and adrenal response to cold in man at Antarctica. Wilderness Environ Med 2005; 16: 81–91.
[103] Hauschildt M, Peters MJ, Moritz S, Jelinek L: Heart rate variability in re-sponse to affective scenes in posttraumatic stress disorder. Biol Psychol 2011; 88: 215–222.
[104] Hemingway H, Shipley M, Brunner E, Britton A, Malik M, Marmot M: Does autonomic function link social position to coronary risk? The White-hall II study. Circulation 2005; 111: 3071–3077.
[105] Henje Blom E, Olsson EM, Serlachius E, Ericson M, Ingvar M: Heart rate variability is related to self-reported physical activity in a healthy adolescent population. Eur J Appl Physiol 2009; 106: 877–883.
[106] Hettinger T, Müller BH: Ergonomie. In: Reichel G (Hrsg.): Grundlagen der Arbeitsmedizin. Stuttgart: Kohlhammer, 1985, S. 427–472.
[107] Hettinger T, Wobbe G (Hrsg.): Kompendium der Arbeitswissenschaft. Ludwigshafen: Kiehl-Verlag, 1993.
[108] Hettinger T: Klimawirkungen auf den Menschen. In: Konietzko J, Dupuis H (Hrsg.); Handbuch der Arbeitsmedizin. Landsberg: Ecomed, 1989, III-4.3, S. 1–16.
[109] Hill LK, Siebenbrock A: Are all measures created equal? Heart rate vari-ability and respiration – biomed 2009. Biomed Sci Instrum 2009; 45: 71–76.
[110] Hollmann W, Strüder HK: Sportmedizin: Grundlagen von körperlicher Ak-tivität, Training und Präventivmedizin. 5., völlig neu bearb. u. erw. Auflage. Stuttgart: Schattauer, 2009.
[111] Hoos O: Herzfrequenzvariabilität und Physiotherapie. Grundlagen, Methoden und Anwendungen. Zeitschrift für Physiotherapeuten 2009; 61: 277–282.
[112] Hottenrott K, Hoos O, Esperer HD: Heart rate variability and physical exer-cise. Current status. Herz 2006; 31: 544–552.
[113] Hottenrott K: Trainingskontrolle mit Herzfrequenz-Messgeräten. Aachen: Meyer & Meyer, 2007.
[114] Huang CJ, Webb HE, Zourdos MC, Acevedo EO: Cardiovascular reactivity, stress, and physical activity. Front Physiol 2013; 4: 314.
[115] Huang CM, Chang HC, Kao ST, Li TC, Wei CC, Chen C, Liao YT, Chen FJ: Radial pressure pulse and heart rate variability in heat- and cold-stressed humans. Evid Based Complement Alternat Med 2011; 2011: 751317
[116] Huang J, Sopher SM, Leatham E, Redwood S, Camm AJ, Kaski JC: Heart rate variability depression in patients with unstable angina. Am Heart J 1995; 130: 772–779.
[117] Huang W, Zhu T, Pan X, Hu M, Lu SE, Lin Y, Wang T, Zhang Y, Tang X: Air pollution and autonomic and vascular dysfunction in patients with cardiovascular disease: interactions of systemic inflammation, overweight, and gender. Am J Epidemiol 2012; 176: 117–126.
[118] Huikuri HV, Mäkikallio TH: Heart rate variability in ischemic heart disease. Auton Neurosci 2001; 90: 95–101.
[119] Huikuri HV, Niemela MJ, Ojala S, Rantala A, Ikaheimo MJ, Airaksinen KE: Circadian rhythms of frequency domain measures of heart rate variability in healthy subjects and patients with coronary artery disease. Effects of arousal and upright posture. Circulation 1994; 90: 121–126.
[120] Huikuri HV, Stein PK: Heart rate variability in risk stratification of cardiac patients. Prog Cardiovasc Dis 2013; 56: 153–159.
[121] Huikuri HV, Ylitalo A, Pikkujämsä SM, Ikäheimo MJ, Airaksinen KE, Ran-tala AO, Lilja M, Kesäniemi YA: Heart rate variability in systemic hyper-tension. Am J Cardiol 1996; 77: 1073–1077.
[122] Imai K, Sato H, Hori M, Kusuoka H, Ozaki H, Yokoyama H, Takeda H, Inoue M, Kamada T: Vagally mediated heart rate recovery after exercise is accelerated in athletes but blunted in patients with chronic heart failure. J Am Coll Cardiol 1994; 24: 1529–1535.
[123] Jenkins JG, Mitchell RH, McClure BG: Heart rate variability in the new-born infants. Automedica 1983; 4: 263–270.
[124] Jennings JR, Mack ME: Does aging differentially reduce heart rate vari-ability related to respiration? Exp Aging Res 1984; 10: 19–23.
[125] Jensen-Urstad K, Storck N, Bouvier F, Ericson M, Lindblad LE, Jensen-Urstad M: Heart rate variability in healthy subjects is related to age and gender. Acta Physiol Scand 1997; 160: 235–241.
[126] Jhun HJ, Yim SH, Kim R, Paek D: Heart-rate variability of carbon disulfide-poisoned subjects in Korea. Int Arch Occup Environ Health 2003; 76: 156–160.
[127] Jorna PGAM: Spectral analysis of heart rate and psychological state: A re-view of its validity as a workload index. Biol Psychol 1992; 34: 237–257.
[128] Jose AD, Collins D: The normal range and determinants of intrinsic heart rate in man. Cardiovasc Res 1970; 4: 160–167.
[129] Jose AD, Taylor RR: Autonomic blockade by propranolol and atropine to study intrinsic myocardial function in man. J Clin Invest 1969; 48: 2019–2031.
[130] Jose AD: Effect of combined sympathetic and parasympathetic blockade on heart rate and cardiac function in man. Am J Cardiol 1966; 18: 476–478.
[131] Juntunen J, Matikainen E, Antti-Poika M, Suoranta H, Valle M: Nervous system effects of long-term occupational exposure to toluene. Acta Neurol Scand 1985; 72: 512–517.
[132] Kaikkonen P, Hynynen E, Mann T, Rusko H, Nummela A: Can HRV be used to evaluate training load in constant load exercises? Eur J Appl Physio 2010; 108: 435–442.
[133] Kalsbeek J, Ettema J: Continuous recording of heart rate and the measurement of perceptual load. Ergonomics 1963; 6: 306–307.
[134] Kamkwalala A, Norrholm SD, Poole JM, Brown A, Donley S, Duncan E, Bradley B, Ressler KJ, Jovanovic T: Dark-enhanced startle responses and heart rate variability in a traumatized civilian sample: putative sex-specific correlates of posttraumatic stress disorder. Psychosom Med 2012; 74: 153–159.
[135] Kanters JK, Højgaard MV, Agner E, Holstein-Rathlou NH: Influence of forced respiration on nonlinear dynamics in heart rate variability. Am J Physiol 1997; 272: R1149–54.
[136] Kapfhammer HP: The relationship between depression, anxiety and heart disease – a psychosomatic challenge. Psychiatr Danub 2011; 23: 412–424.
[137] Karavanaki K, Baum JD: Coexistence of impaired indices of autonomic neuro-pathy and diabetic nephropathy in a cohort of children with type 1 diabetes mellitus. J Pediatr Endocrinol Metab 2003; 16: 79–90.
[138] Karayannis G, Giamouzis G, Cokkinos DV, Skoularigis J, Triposkiadis F: Diabetic cardiovascular autonomic neuropathy: clinical implications. Expert Rev Cardiovasc Ther 2012; 10: 747–765.
[139] Kasamaki Y, Izumi Y, Ozawa Y, Ohta M, Tano A, Watanabe I, Hirayama A, Nakayama T, Kawamura H, Himit D, Mahemuti M, Sezai A: Relationship between status of plasma atrial natriuretic peptide and heart rate variability in human subjects. Heart Vessels 2013; 28: 208–214.
[140] Kawachi I, Sparrow D, Vokonas PS, Weiss ST: Decreased heart rate varia-bility in men with phobic anxiety (data from the Normative Aging Study). Am J Cardiol 1995; 75: 882–885.
[141] Kemp AH, Quintana DS, Felmingham KL, Matthews S, Jelinek HF: Depres-sion, comorbid anxiety disorders, and heart rate variability in physically healthy, unmedicated patients: implications for cardiovascular risk. PLoS One 2012; 7: e30777.
[142] Kemp AH, Quintana DS, Gray MA, Felmingham KL, Brown K, Gatt JM: Impact of depression and antidepressant treatment on heart rate variability: a review and meta-analysis. Biol Psychiatry 2010; 67: 1067–1074.
[143] Kemp AH, Quintana DS: The relationship between mental and physical health: insights from the study of heart rate variability. Int J Psychophysiol 2013; 89: 288–296.
[144] Kim CK, McGorray SP, Bartholomew BA, Marsh M, Dicken T, Wassert-heil-Smoller S, Curb JD, Oberman A, Hsia J, Gardin J, Wong ND, Barton B, McMahon RP, Sheps DS: Depressive symptoms and heart rate variability in postmenopausal women. Arch Intern Med 2005; 165: 1239–1244.
[145] Klingenheben T, Zabel M, Hohnloser SH: Kurzzeitanalyse der Herzfrequenzvariabilität im Zeitbereich zur Prognosebeurteilung nach Myokardinfarkt: methodologisch sinnvolle Alternative zum Langzeit-EKG? Z Kardiol 1998; 87: 128–133.
[146] Korber T, Ismer B, von Knorre GH: Die klinische Bedeutung der Verwendung unterschiedlicher Rekordertechnologien für die Ergebnisse der Analyse der Herzfrequenzvariabilität aus dem Langzeit-EKG. Herzschr Elektrophys 2000; 11: 110–116.
[147] Koskinen P, Virolainen J, Kupari M: Acute alcohol intake decreases shortterm heart rate variability in healthy subjects. Clin Sci (Lond) 1994; 87: 225–230.
[148] Koskinen T, Kähönen M, Jula A, Mattsson N, Laitinen T, Keltikangas-Järvinen L, Viikari J, Välimäki I, Rönnemaa T, Raitakari OT: Metabolic syndrome and short-term heart rate variability in young adults. The cardiovascular risk in young Finns study. Diabet Med 2009; 26: 354–361.
[149] Kovar D, Cannon CP, Bentley JH, Charlesworth A, Rogers WJ: Does initial and delayed heart rate predict mortality in patients with acute coronary syndromes? Clin Cardiol 2004; 27: 80–86.
[150] Kraus U, Schneider A, Breitner S, Hampel R, Rückerl R, Pitz M, Geruschkat U, Belcredi P, Radon K, Peters A: Individual day-time noise exposure during routine activities and heart rate variability in adults: A repeated measures study. Environ Health Perspect 2013; 121: 607–612.
[151] Kuch B, Parvanov T, Hense HW, Axmann J, Bolte HD: Short-period heart rate variability in the general population as compared to patients with acute myocardial infarction from the same source population. Ann Noninvasive Electrocardiol 2004; 9: 113–120.
[152] Kuehl M, Stevens MJ: Cardiovascular autonomic neuropathies as complica-tions of diabetes mellitus. Nat Rev Endocrinol 2012; 8: 405–416.
[153] Kuo TB, Lin T, Yang CC, Li CL, Chen CF, Chou P: Effect of aging on gender differences in neural control of heart rate. Am J Physiol 1999; 277: H2233–9.
[154] Lakusic N, Fuckar K, Mahovic D, Cerovec D, Majsec M, Stancin N: Charac-teristics of heart rate variability in war veterans with post-traumatic stress disorder after myocardial infarction. Mil Med 2007; 172: 1190–1193.
[155] Lakusic N, Mahovic D, Sonicki Z, Slivnjak V, Baborski F: Outcome of pa-tients with normal and decreased heart rate variability after coronary artery bypass grafting surgery. Int J Cardiol 2013; 166: 516–518.
[156] Lasisi GT, Adebola AP, Ogah OS, Daniel FA: Prevalence of ventricular ar-rhythmias and heart rate variability pattern in chronic heart failure. Niger Postgrad Med J 2012; 19: 157–162.
[157] Lee EA, Theus SA: Lower heart rate variability associated with military sexual trauma rape and posttraumatic stress disorder. Biol Res Nurs 2012; 14: 412–418.
[158] Lee GS, Chen ML, Wang GY: Evoked response of heart rate variability using short-duration white noise. Auton Neurosci 2010; 155: 94–97.
[159] Lee K, Park J, Choi J, Park CG: Heart rate variability and metabolic syndrome in hospitalized patients with schizophrenia. J Korean Acad Nurs 2011; 41: 788–794.
[160] Lehrer PM, Vaschillo E, Lu SE, Eckberg D, Vaschillo B, Scardella A, Habib R: Heart rate variability biofeedback: effects of age on heart rate variability, baroreflex gain, and asthma. Chest 2006; 129: 278–284.
[161] Lehrer PM, Vaschillo E, Vaschillo B, Lu SE, Eckberg DL, Edelberg R, Shih WJ, Lin Y, Kuusela TA, Tahvanainen KU, Hamer RM: Heart rate variability biofeedback increases baroreflex gain and peak expiratory flow. Psychosom Med 2003; 65: 796–805.
[162] Lehrer PM: Applied psychophysiology: beyond the boundaries of biofeedback (mending a wall, a brief history of our field, and applications to control of the muscles and cardiorespiratory systems). Appl Psychophysiol Biofeedback 2003; 28: 291–304.
[163] Lewis MJ, Phillips JE: Older people‘s cardiac responses as indicators of stress in familiar and unfamiliar environments. Psychophysiology 2012; 49: 478–483.
[164] Liao D, Evans GW, Chambless LE, Barnes RW, Sorlie P, Simpson RJ Jr, Heiss G: Population-based study of heart rate variability and prevalent myocardial infarction. The Atherosclerosis Risk in Communities Study. J Electrocardiol 1996; 29: 189–198.
[165] Liao D, Sloan RP, Cascio WE, Folsom AR, Liese AD, Evans GW, Cai J, Sharrett AR: Multiple metabolic syndrome is associated with lower heart rate variability. The Atherosclerosis Risk in Communities Study. Diabetes Care 1998; 21: 2116–2122.
[166] Lindholm H, Sinisalo J, Ahlberg J, Hirvonen A, Hublin C, Partinen M, Savolainen A: Attenuation of vagal recovery during sleep and reduction of cortisol/melatonin ratio in late afternoon associate with prolonged daytime sleepiness among media workers with irregular shift work. Am J Ind Med 2012; 55: 643–649.
[167] Link MS, Homoud MK, Wang PJ, Estes M: Cardiac arrhythmias in the athlete. Cardiol Rev 2001; 9: 21–30.
[168] Lomb NR: Least squares frequency algorithmus of unequally sampled data. Astrophysics and Space science 1976; 39: 447–462.
[169] Lombardi F, Sandrome G, Mortara A et al.: Circadian variation of spectral indices of heart rate variability after myocardial infarction. Am Heart J 1992; 123: 1521–1529.
[170] Looser RR, Metzenthin P, Helfricht S, Kudielka BM, Loerbroks A, Thayer JF, Fischer JE: Cortisol is significantly correlated with cardiovascular responses during high levels of stress in critical care personnel. Psychosom Med 2010; 72: 281–289.
[171] Luczak H, Laurig W: An analysis of heart rate variability. Ergonomics 1973; 16: 85–97.
[172] Lutfi MF, Sukkar MY: The effect of gender on heart rate variability in asth-matic and normal healthy adults. Int J Health Sci (Qassim) 2011; 5: 146–154.
[173] Mäkikallio TH, Ristimäe T, Airaksinen KE, Peng CK, Goldberger AL, Hui-kuri HV: Heart rate dynamics in patients with stable angina pectoris and utility of fractal and complexity measures. Am J Cardiol 1998; 81: 27–31.
[174] Mäkikallio TH, Seppänen T, Niemelä M, Airaksinen KE, Tulppo M, Hui-kuri HV: Abnormalities in beat to beat complexity of heart rate dynamics in patients with a previous myocardial infarction. J Am Coll Cardiol 1996; 28: 1005–1011.
[175] Makikallio TH, Tapanainen JM, Tulppo MP, Huikuri HV: Clinical applic-ability of heart rate variability analysis by methods based on nonlinear dy-namics. Card Electrophysiol Rev 2002; 6: 250–255.
[176] Malpas SC, Purdie GL: Circadian variation of heart rate variability. Cardio-vasc Res 1990; 24: 210–213.
[177] Manzey D: Psychophysiologie mentaler Beanspruchung. In: Rösler F (Hrsg.): Ergebnisse und Anwendungen der Psychophysiologie. Enzyklopädie der Psychologie. Göttingen: Hogrefe, 1998, S. 799–864.
[178] Massin MM, Maeyns K, Withofs N, Ravet F, Gérard P: Circadian rhythm of heart rate and heart rate variability. Arch Dis Child 2000; 83: 179–182.
[179] Matikainen E, Juntunen J, Koskenvuo M, Antti-Poika M, Kaprio J: Cardio-vascular reflexes in monozygotic twins discordant for exposure to organic solvents. Acta Genet Med Gemelol (Roma) 1987; 36: 503–507.
[180] Melanson EL: Resting heart rate variability in men varying in habitual physical activity. Med Sci Sports Exerc 2000; 32: 1894–1901.
[181] Menezes Ada S Jr, Moreira HG, Daher MT: Analysis of heart rate variability in hypertensive patients before and after treatment with angiotensin II-converting enzyme inhibitors. Arq Bras Cardiol 2004; 83: 169–172.
[182] Min KB, Min JY, Paek D, Cho SI: The impact of the components of metabolic syndrome on heart rate variability: using the NCEP-ATP III and IDF definitions. Pacing Clin Electrophysiol 2008; 31: 584–591.
[183] Monforte R, Estruch R, Valls-Solé J, Nicolás J, Villalta J, Urbano-Marquez A: Autonomic and peripheral neuropathies in patients with chronic alco-holism. A dose-related toxic effect of alcohol. Arch Neurol 1995; 52: 45–51.
[184] Mulder G: The heart of mental effort. Thesis: University of Groningen, 1980.
[185] Müller EA: Handbuch der gesamten Arbeitsmedizin, Band 1. Berlin: Urban und Schwarzenberg, 1961.
[186] Murata K, Araki S, Yokoyama K, Maeda K: Autonomic and peripheral ner-vous system dysfunction in workers exposed to mixed solvents. Int Arch Occup Environ Health 1991; 63: 335–340.
[187] Murata K, Araki S, Yokoyama K, Nomiyama K, Nomiyama H, Tao YX, Liu SJ: Autonomic and central nervous system effects of lead in female glass workers in China. Am J Ind Med 1995; 28: 233–244.
[188] Murata K, Araki S, Yokoyama K: Assessment of the peripheral, central, and autonomic nervous system function in styrene workers. Am J Ind Med 1991; 20: 775–784.
[189] Nakayama N, Negi K, Watanabe K, Hirai M: Life activities improve heart rate variability in patients with mild hypertension and/or the initial stage of heart failure. J Clin Nurs 2014; 23: 367–373.
[190] Nunan D, Sandercock GRH, Brodie DA: A quantitative systematic review of normal values for short-term heart rate variability in healthy adults. Pace 2010; 33: 1407–1417.
[191] O‘Brien IA, O‘Hare JP, Lewin IG, Corrall RJ: The prevalence of autonomic neuropathy in insulin-dependent diabetes mellitus: a controlled study based on heart rate variability. Q J Med 1986; 61: 957–967.
[192] Opmeer C: The information content of successive R-R interval times in the ECG: preliminary results in factor analysis and frequency analysis. Ergo-nomics 1973; 16: 105–115.
[193] Paas FG, Van Merrienboer JJ, Adam JJ: Measurement of cognitive load in instructional research. Percept Mot Skills 1994; 79: 419–430.
[194] Pal GK, Pal P, Nanda N, Lalitha V, Dutta TK, Adithan C: Sympathovagal imbalance in young prehypertensives: importance of male-female difference. Am J Med Sci 2013; 345: 10–17.
[195] Palatini P, Benetos A, Grassi G, Julius S, Kjeldsen SE, Mancia G, Narkiewicz K, Parati G, Pessina AC, Ruilope LM, Zanchetti A, European Society of Hypertension: Identification and management of the hypertensive patient with elevated heart rate: statement of a European Society of Hypertension Consensus Meeting. J Hypertens 2006; 24: 603–610.
[196] Peira N, Pourtois G, Fredrikson M: Learned cardiac control with heart rate biofeedback transfers to emotional reactions. PLoS One 2013; 8: e70004.
[197] Pfister EA, Böckelmann I, Rüdiger H, Seibt R, Stoll R, Vilbrandt R: Leitlinie der Deutschen Gesellschaft für Arbeitsmedizin und Umweltmedizin e.V. – Herzrhythmusanalyse in der Arbeitsmedizin. AWMF-Nr. 002–021. Arbeits-med Sozialmed Umweltmed 2007; 42: 348–353.
[198] Piper HM. Herzerregung. In: Schmidt RF, Lang F, Heckmann M (Hrsg.). Physiologie des Menschen mit Pathophysiologie. 31. Auflage. Springer, Heidelberg, 2011: 517–38.
[199] Pittig A, Arch JJ, Lam CW, Craske MG: Heart rate and heart rate variability in panic, social anxiety, obsessive-compulsive, and generalized anxiety dis-orders at baseline and in response to relaxation and hyperventilation. Int J Psychophysiol 2013; 87: 19–27.
[200] Pober DM, Braun B, Freedson PS: Effects of a single bout of exercise on resting heart rate variability. Med Sci Sports Exerc 2004; 36: 1140–1148.
[201] Poliakova N, Després JP, Bergeron J, Alméras N, Tremblay A, Poirier P: Influence of obesity indices, metabolic parameters and age on cardiac auto-nomic function in abdominally obese men. Metabolism 2012; 61: 1270–1279.
[202] Press WH, Rybicki GB: Fast algorithm for spectral analysis of unevenly sampled data. Astrophysical J 1989; 338: 277–280.
[203] Radtke T, Kriemler S, Eser P, Saner H, Wilhelm M: Physical activity inten-sity and surrogate markers for cardiovascular health in adolescents. Eur J Appl Physiol 2013; 113: 1213–1222.
[204] Ramaekers D, Ector H, Demyttenaere K, Rubens A, Van de Werf F: Associa-tion between cardiac autonomic function and coping style in healthy subjects. Pacing Clin Electrophysiol 1998; 21: 1546–1552.
[205] Reinhardt F, Drexler H, Bickel A, Claus D, Ulm K, Angerer J, Lehnert G, Neundörfer B: Electrophysiological investigation of central, peripheral and autonomic nerve function in workers with long-term low-level exposure to carbon disulphide in theviscose industry. Int Arch Occup Environ Health 1997; 70: 249–256.
[206] Ren C, O‘Neill MS, Park SK, Sparrow D, Vokonas P, Schwartz J: Ambient temperature, air pollution, and heart rate variability in an aging population. Am J Epidemiol 2011; 173: 1013–1021.
[207] Rennie KL, Hemingway H, Kumari M, Brunner E, Malik M, Marmot M: Effects of moderate and vigorous physical activity on heart rate variability in a British study of civil servants. Am J Epidemiol 2003; 158: 135–143.
[208] Rodríguez-Colón SM, Bixler EO, Li X, Vgontzas AN, Liao D: Obesity is associated with impaired cardiac autonomic modulation in children. Int J Pediatr Obes 2011; 6: 128–134.
[209] Rohmert W, Rutenfranz J. Praktische Arbeitsphysiologie. Stuttgart: Thieme, 1983.
[210] Romanowicz B, Schmidt JE, Bostwick JM, Mrazek DA, Karpyak VM: Chan-ges in heart rate variability associated with acute alcohol consumption: cur-rent knowledge and implications for practice and research. Alcohol Clin Exp Res 2011; 35: 1092–1105.
[211] Routledge FS, Campbell TS, McFetridge-Durdle JA, Bacon SL: Improvements in heart rate variability with exercise therapy. Can J Cardiol 2010; 26: 303–312.
[212] Rüdiger H, Henke S, Paditz E, Ziemssen T, Süß M, Süß F: Untersuchung zur Genauigkeit der Abtastung von EKG-Signalen für eine nachfolgende Spektralanalyse kontinuierlich gemessener RR-Intervalle im Schlaflabor. Somnologie 2006; 10: 53–60.
[213] Rüdiger H, Klinghammer L, Scheuch K: Trigonometric regressive spectral analysis – a method for mapping of beat-to-beat recorded cardiovascular parameters on to frequency domain in comparison with fourier transfor-mation. Comput Meth Prog Biomed 1999; 58: 1–15.
[214] Sammito S, Böckelmann I: Einfluss von Extrasystolen auf die Herzfrequenzvariabilitätsmessungen im Rahmen von 24-h-Messungen. In: Hottenrott K, Gronwald T, Schmidt H (Hrsg.): Herzfrequenzvariabilität: Grundlagen – Methoden – Anwendungen. Schriften der Deutschen Vereinigung für Sport-wissenschaften, Band 233. Hamburg: Feldhaus Verlag Edition Czwalina, 2014, S. 82–86.
[215] Sammito S, Böckelmann I: Validierung von drei verschiedenen Systemen zur Erfassung der Herzschlagfrequenz in Sanitätsfahrzeugen. ErgoMed/Prakt Arbmed 2012; 36: 38–45.
[216] Sammito S, Darius S, Böckelmann I: Validierungsstudie zum Einsatz eines funklosen Brustgurtsystems zur Messung der Herzratenvariabilität unter Ruhebedingungen und in Fahrzeugen. Arbeitsmed Sozialmed Umweltmed 2011; 46: 60–65.
[217] Sandercock GR, Brodie DA: The role of heart rate variability in prognosis for different modes of death in chronic heart failure. Pacing Clin Electro-physiol 2006; 29: 892–904.
[218] Scalvini S, Volterrani M, Zanelli E, Pagani M, Mazzuero G, Coats AJ, Gior-dano A: Is heart rate variability a reliable method to assess autonomic modu-lation in left ventricular dysfunction and heart failure? Assessment of auto-nomic modulation with heart rate variability. Int J Cardiol 1998; 67: 9–17.
[219] Schaffer T, Hensel B, Weigand C, Schüttler J, Jeleazcov C: Evaluation of techniques for estimating the power spectral density of RR-intervals under paced respiration conditions. J Clin Monit Comput. 2013 Mar 19. [Epub ahead of print]
[220] Scheuch K. Arbeitsphysiologie. In: Triebig G, Kentner M, Schiele R (Hrsg.): Arbeitsmedizin – Handbuch für Theorie und Praxis. 3. vollständig über-arbeitete Auflage. Stuttgart: Gentner, 2011, S. 413–458.
[221] Schmidt G, Morfill GE: Nonlinear methods for heart rate variability assess-ment. In: Malik M, Camm AJ (eds.): Heart rate variability. FArmonk NY: utora, 1995, S. 87–98.
[222] Schnell I, Potchter O, Epstein Y, Yaakov Y, Hermesh H, Brenner S, Tirosh E: The effects of exposure to environmental factors on heart rate variability: An ecological perspective. Environ Pollut 2013; 183: 7–13.
[223] Schroeder EB, Liao D, Chambless LE, Prineas RJ, Evans GW, Heiss G: Hypertension, blood pressure, and heart rate variability: the Atherosclerosis Risk in Communities (ARIC) study. Hypertension 2003; 42: 1106–1111.
[224] Shah AJ, Lampert R, Goldberg J, Veledar E, Bremner JD, Vaccarino V: Post-traumatic stress disorder and impaired autonomic modulation in male twins. Biol Psychiatry 2013; 71: 1103–1110.
[225] Shaikh al arab A, Guédon-Moreau L, Ducrocq F, Molenda S, Duhem S, Sal-leron J, Chaudieu I, Bert D, Libersa C, Vaiva G: Temporal analysis of heart rate variability as a predictor of post traumatic stress disorder in road traffic accidents survivors. J Psychiatr Res 2012; 46: 790–796.
[226] Shin K, Minamitani H, Onishi S, Yamazaki H, Lee M: Autonomic differences between athletes and nonathletes: Spectral analysis approach. Med Sci Sports Exerc 1997; 29: 1482–1490.
[227] Shiogai Y, Stefanovska A, McClintock PV: Nonlinear dynamics of cardio-vascular ageing. Phys Rep 2010; 488: 51–110.
[228] Shiotani H, Umegaki Y, Tanaka M, Kimura M, Ando H: Effects of aerobic exercise on the circadian rhythm of heart rate and blood pressure. Chronobiol Int 2009; 26: 1636–1646.
[229] Singh JP, Larson MG, O‘Donnell CJ, Wilson PF, Tsuji H, Lloyd-Jones DM, Levy D: Association of hyperglycemia with reduced heart rate variability (The Framingham Heart Study). Am J Cardiol 2000; 86: 309–312.
[230] Singh JP, Larson MG, Tsuji H, Evans JC, O‘Donnell CJ, Levy D: Reduced heart rate variability and new-onset hypertension: insights into pathogenesis of hypertension: the Framingham Heart Study. Hypertension 1998; 32: 293–297.
[231] Slewa-Younan S, Chippendale K, Heriseanu A, Lujic S, Atto J, Raphael B: Measures of psychophysiological arousal among resettled traumatized Iraqi refugees seeking psychological treatment. J Trauma Stress 2012; 25: 348–352.
[232] Snieder H, van Doornen LJ, Boomsma DI, Thayer JF: Sex differences and heritability of two indices of heart rate dynamics: a twin study. Twin Res Hum Genet 2007; 10: 364–372.
[233] Soares-Miranda L, Sandercock G, Vale S, Santos R, Abreu S, Moreira C, Mota J: Metabolic syndrome, physical activity and cardiac autonomic function. Diabetes Metab Res Rev 2012; 28: 363–369.
[234] Soares-Miranda L, Sandercock G, Valente H, Vale S, Santos R, Mota J: Vigorous physical activity and vagal modulation in young adults. Eur J Cardiovasc Prev Rehabil 2009; 16: 705–711.
[235] Song BA, Yoo SY, Kang HY, Byeon SH, Shin SH, Hwang EJ, Lee SH: Posttraumatic stress disorder, depression, and heart-rate variability among North Korean defectors. Psychiatry Investig 2011; 8: 297–304.
[236] Sookan T, McKune AJ. Heart rate variability in physically active individuals: reliability and gender characteristics. Cardiovasc J Afr 2012; 23: 67–72.
[237] Sosnowski M, MacFarlane PW, Czyz Z, Skrzypek-Waha J, Boczkowska-Gaik E, Tendera M: Age-adjustment of HRV measures and its prognostic value for risk assessment in patients late after myocardial infarction. Int J Cardiol 2002; 86: 249–258.
[238] Stapelberg NJ, Hamilton-Craig I, Neumann DL, Shum DH, McConnell H: Mind and heart: heart rate variability in major depressive disorder and coro-nary heart disease – a review and recommendations. Aust NZJ Psychiatry 2012; 46: 946–957.
[239] Stein PK, Barzilay JI, Chaves PH, Domitrovich PP, Gottdiener JS: Heart rate variability and its changes over 5 years in older adults. Age Ageing 2009; 38: 212–218.
[240] Stein PK, Barzilay JI, Domitrovich PP, Chaves PM, Gottdiener JS, Heck-bert SR, Kronmal RA: The relationship of heart rate and heart rate vari-ability to non-diabetic fasting glucose levels and the metabolic syndrome: the Cardiovascular Health Study. Diabet Med 2007; 24: 855–863.
[241] Stein PK, Domitrovich PP, Huikuri HV, Kleiger RE: Traditional and non-linear heart rate variability are each independently associated with mortality after myocardial infarction. J Cardiovasc Electrophysiol 2005; 16: 13–20.
[242] Streeter CC, Gerbarg PL, Saper RB, Ciraulo DA, Brown RP: Effects of yoga on the autonomic nervous system, gamma-aminobutyric-acid, and allostasis in epilepsy, depression, and post-traumatic stress disorder. Med Hypotheses 2012; 78: 571–579.
[243] Su S, Lampert R, Lee F, Bremner JD, Snieder H, Jones L, Murrah NV, Gold-berg J, Vaccarino V: Common genes contribute to depressive symptoms and heart rate variability: the Twins Heart Study. Twin Res Hum Genet 2010; 13: 1–9.
[244] Such U, Meyer T. Die maximale Herzfrequenz. Dtsch Z Sportmed 2010; 61: 310–311.
[245] Sugawara J, Murakami H, Maeda S, Kuno S, Matsuda M: Change in post-exercise vagal reactivation with exercise training and detraining in young men. Eur J Appl Physiol 2001; 85: 259–263.
[246] Takahashi T, Hayano J, Miyamoto Y: Difference in human cardiovascular response between upright and supine recovery from upright cycle exercise. Eur J Appl Physiol 2000; 81: 233–239.
[247] Takahashi T, Miyamoto Y: Influence of light physical activity on cardiac responses during recovery from exercise in humans. Eur J Appl Physiol 1998; 77: 305–311.
[248] Tan G, Fink B, Dao TK, Hebert R, Farmer LS, Sanders A, Pastorek N, Ge-virtz R: Associations among pain, PTSD, mTBI, and heart rate variability in veterans of Operation Enduring and Iraqi Freedom: a pilot study. Pain Med 2009; 10: 1237–1245.
[249] Tanaka H, Monahan KD, Seals DR: Age-predicted maximal heart rate re-visited. J Am Coll Cardiol 2001; 37: 153–156.
[250] Tapanainen J, Thomsen P, Kober L, Torp-Pedersen C, Mäkikallio TH, Still AM, Lindgren KS, Huikuri HV: Fractal analysis of heart rate variability and mortality after an acute myocardial infarction. Am J Cardiol 2002; 90: 347–352.
[251] Taylor CB: Depression, heart rate related variables and cardiovascular dis-ease. Int J Psychophysiol 2010; 78: 80–88.
[252] Trappe JH, Löllgen H: Leitlinien zur Ergometrie. Z Kardiol 2000; 89: 821–837.
[253] Triebig G, Kentner M, Schiele R (Hrsg.): Arbeitsmedizin – Handbuch für Theorie und Praxis. 3. vollst. überarb. Aufl. Stuttgart: Gentner, 2011.
[254] Tsuji H, Venditti FJ Jr, Manders ES, Evans JC, Larson MG, Feldman CL, Levy D: Determinants of heart rate variability. J Am Coll Cardiol 1996; 28: 1539–1546.
[255] Tucker P, Pfefferbaum B, Jeon-Slaughter H, Khan Q, Garton T: Emotional stress and heart rate variability measures asociated with cardiovascular risk in relocated Katrina survivors. Psychosom Med 2012; 74: 160–168.
[256] Umetani K, Singer DH, McCraty R, Atkinson M: Twenty-four hour time domain heart rate variability and heart rate: relations to age and gender over nine decades. J Am Coll Cardiol 1998; 31: 593–601.
[257] Valenti VE, Vanderlei LC, Ferreira C, Fonseca FL, Oliveira FR, Sousa FH, Rodrigues LM, Monteiro CB, Adami F, Wajnsztejn R, de Abreu LC: Side-stream cigarette smoke and cardiac autonomic regulation. Int Arch Med 2013; 6: 11.
[258] Van Amelsvoort LGPM, Schouten EG, Maan AC, Swenne CA, Kok FJ: Oc-cupational determinants of heart rate variability. Int Arch Occup Environ Health 2000; 73: 255–262.
[259] van Dellen H, Aasman J, Mulder LJM, Mulder G: Time domain versus fre-quency domain measures of heart rate variability. In: Orlebeke J, Mulder G, van Doornen L (eds.): Psychophysiology of cardiovascular control: models, methods, and data. New York: Plenum Press; 1985 S. 353–374.
[260] Vandeput S, Verheyden B, Aubert AE, Van Huffel S: Nonlinear heart rate dynamics: circadian profile and influence of age and gender. Med Eng Phys 2012; 34: 108–117.
[261] Virtanen R, Jula A, Kuusela T, Helenius H, Voipio-Pulkki LM: Reduced heart rate variability in hypertension: associations with lifestyle factors and plasma renin activity. J Hum Hypertens 2003; 17: 171–179.
[262] Voss A, Esperer HD: Herzfrequenzvariabilität – Definition, Analyse und klinische Bedeutung, Teil I. HerzRhythmus 1994; 6: 1–8.
[263] Voss A, Heitmann A, Schroeder R, Peters A, Perz S: Short-term heart rate variability – age-dependence in healthy subjects. Physiol Meas 2012; 33: 1289–1311.
[264] Voss A, Schulz S, Schroeder R, Baumert M, Caminal P: Methods derived from nonlinear dynamics for analysing heart rate variability. Philos Trans-act A Math Phys Eng Sci 2009; 367: 277–296.
[265] Wehrens SM, Hampton SM, Skene DJ: Heart rate variability and endo-thelial function after sleep deprivation and recovery sleep among male shift and non-shift workers. Scand J Work Environ Health 2012; 38: 171–181.
[266] Weineck J: Sportbiologie. Balingen: Spitta, 2004.
[267] Weippert M, Rieger A, Stoll R: Individuell unterschiedliche Vergleichbar-keit von R-R-Detektionen mit verschiedenen Messgeräten. In: Hottenrott K, Hoos O, Esperer HD (Hrsg.): Herzfrequenzvariabilität: Gesundheitsförde-rung, Trainingsteuerung, Biofeedback. Schriften der Deutschen Vereinigung für Sportwissenschaften, Band 214. Hamburg: Czwalina, 2011, S. 212–220.
[268] Weippert M: Frequenanalyse der Herzratenvariabilität in der Präventiv-medizin. Inauguraldissertation an der Medizinischen Fakultät der Uni-versität Rostock, 2009.
[269] Weise F, Krell D, Brinkhoff N: Acute alcohol ingestion reduces heart rate variability. Drug Alcohol Depend 1986; 17: 89–91.
[270] Wennerblom B, Lurje L, Solem J, Tygesen H, Udén M, Vahisalo R, Hjal-marson A: Reduced heart rate variability in ischemic heart disease is only partially caused by ischemia. An HRV study before and after PTCA. Cardiology 2000; 94: 146–151.
[271] Wennerblom B, Lurje L, Tygesen H, Vahisalo R, Hjalmarson A: Patients with uncomplicated coronary artery disease have reduced heart rate vari-ability mainly affecting vagal tone. Heart 2000; 83: 290–294.
[272] Williams BA, Merhige ME: The prognostic association between resting heart rate and cardiac death – myocardial perfusion defects as a potential mechanism. Atherosclerosis 2012; 221: 445–450.
[273] Wilson MD, McGlothlin JD, Rosenthal FS, Black DR, Zimmerman NJ, Bridges CD: The effect of occupational exposure to environmental tobacco smoke on the heart rate variability of bar and restaurant workers. J Occup Environ Hyg 2010; 7: D44–49.
[274] Wu S, Deng F, Liu Y, Shima M, Niu J, Huang Q, Guo X: Temperature, traffic-related air pollution, and heart rate variability in a panel of healthy adults. Environ Res 2013; 120: 82–89.
[275] Yi SH, Lee K, Shin DG, Kim JS, Kim HC: Differential association of adi-posity measures with heart rate variability measures in Koreans. Yonsei Med J 2013; 54: 55–61.
[276] Zhang J: Effect of age and sex on heart rate variability in healthy subjects. J Manipulative Physiol Ther 2007; 30: 374–379.
[277] Zucker TL, Samuelson KW, Muench F, Greenberg MA, Gevirtz RN: The effects of respiratory sinus arrhythmia biofeedback on heart rate variability and posttraumatic stress disorder symptoms: a pilot study. Appl Psychophysiol Biofeedback 2009; 34: 135–43.
Die vorliegende Leitlinie ist eine Zusammenführung und grundlegende Überarbeitung der letztmalig im Jahr 2005 aktualisierten S1-Leitlinie „Nutzung der Herzschlagfrequenz bei arbeitswissenschaftlichen Untersuchungen“ (AWMF-Nr. 002-012, Autoren: Frauen-dorf H, Pfister EA, Wirth D) [81] und der im Jahr 2006 letztmalig aktualisierten S1-Leitlinie „Herzrhythmusanalyse in der Arbeitsmedizin“ (AWMF-Nr. 002-021, Autoren: Pfister EA, Böckelmann I, Rüdiger H, Seibt R, Stoll R, Vilbrandt R) [197].
Diskutiert in der Arbeitsgruppe „Forum Arbeitsphysiologie“ der Deutschen Gesellschaft für Arbeitsmedizin und Umweltmedizin e. V. (DGAUM) und der Gesellschaft für Arbeitswissenschaft e. V. (GfA) am 01.04.2014.
Letztmalig aktualisierte Fassung verabschiedet vom Vorstand der DGAUM im Juni 2014.
Hinweise bitte an:
Prof. Dr. med. Irina Böckelmann ( irina.boeckelmann@med.ovgu.de )
oder
Dr. med. Stefan Sammito ( stefan.sammito@med.ovgu.de )
oder
Geschäftsstelle der Deutschen Gesellschaft für Arbeitsmedizin und Umweltmedizin e. V. ( gsdgaum@dgaum.de ).

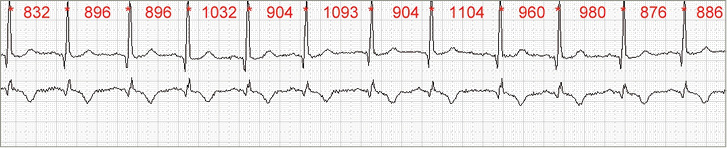
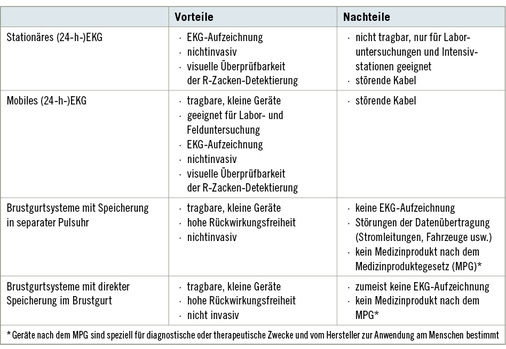
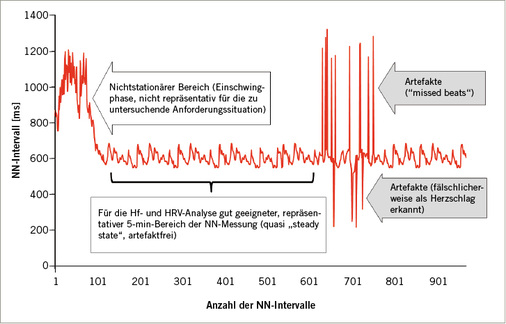

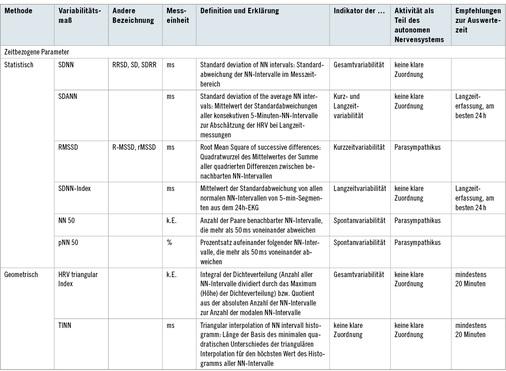
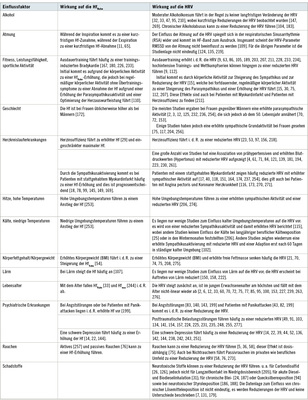
![<p>
<span class="GVSpitzmarke"> Abb. 4: </span>
Herzschlagfrequenzverläufe bei unterschiedlichen Belastungen (unterhalb bzw. oberhalb der DLG sowie im Bereich der DLG) mit jeweiliger Erholungsphase. Schematische Darstellung, modifiziert nach Müller [185]. DLG = Dauerleistungsgrenze
</p>
Abb. 4:
Herzschlagfrequenzverläufe bei unterschiedlichen Belastungen (unterhalb bzw. oberhalb der DLG sowie im Bereich der DLG) mit jeweiliger Erholungsphase. Schematische Darstellung, modifiziert nach Müller [185]. DLG = Dauerleistungsgrenze](/sites/default/files/styles/image_gallery__s/public/ulmer/de-asu/image/binarydata_original_694921.jpg?itok=Gd8Wk0Em)
![<p>
<span class="GVSpitzmarke"> Tabelle 4: </span>
Mittelwert und Standardabweichung (Mw ± SD) für gängige HRV-Parameter in der Kurzzeitmessung (5 min) nach Nunan et al. 2010 [190], Anmerkung: Die angegebenen Mittelwerte basieren auf einer unterschiedlichen Anzahl von Originalstudien (eine bzw. bis zu 36 verschiedene Quellen).
</p>
Tabelle 4:
Mittelwert und Standardabweichung (Mw ± SD) für gängige HRV-Parameter in der Kurzzeitmessung (5 min) nach Nunan et al. 2010 [190], Anmerkung: Die angegebenen Mittelwerte basieren auf einer unterschiedlichen Anzahl von Originalstudien (eine bzw. bis zu 36 verschiedene Quellen).](/sites/default/files/styles/image_gallery__s/public/ulmer/de-asu/image/binarydata_original_694922.jpg?itok=6nV_785U)