Berufserkrankungen im Zusammenhang mit Asbest – Entwicklungen aus Hamburg und Umgebung
Ziel: Diese Arbeit beschreibt anhand von Sektionsbefunden und deren Vergleich mit zwei vorangegangenen Zeiträumen die aktuelle Entwicklung von asbestverursachten Berufserkrankungen am Beispiel von Hamburg als langjährige Hochburg der asbestverarbeitenden Industrie.
Kollektiv und Methode: Am Institut für Rechtsmedizin der Universität Hamburg-Eppendorf (UKE) wurden 329 Fälle untersucht und ausführlich ausgewertet, die in den Jahren 2000 bis 2009 mit dem Verdacht auf eine asbestassoziierte Berufskrankheit (BK) obduziert wurden. Zudem wurden diese Ergebnisse mit den Beobachtungszeiträumen1969–1987 und 1988–1999 verglichen.
Ergebnisse: In 211 Fällen ließ sich eine asbestassoziierte Erkrankung nachweisen. Unter den 44 Berufsfeldern waren die Schlosser, Werft-/Hafenarbeiter und Klempner am häufigsten vertreten. Im Vergleich mit früheren Zeiträumen ließ sich ein Anstieg des Diagnosealters und der Latenzzeit beobachten. Trotz der langen Latenzzeit und des hohen Todesalters waren Asbestkörper noch gut im Lungengewebe nachweisbar. Früher war der Grad einer Asbestose schwerer ausgeprägt, in jüngerer Zeit häufen sich die Asbestosen Grad I.
Es konnte kein signifikanter Unterschied bei der Primärtumorlokalisation zwischen den asbest- und nichtasbestassoziierten Lungentumoren beobachtet werden. Beim Vergleich der Befunde aus der bildgebenden Diagnostik klinischer Routine und der Sektion ergab sich eine Sensitivität von 71 % für das Röntgenergebnis und von 67 % für das CT-Ergebnis und somit eine hohe Dunkelziffer für asbestassoziierte Veränderungen. Die Spezifität für beide Methoden lag bei 93 %.
Schlussfolgerung: Wegen der langen Latenzzeit und des zunehmenden Diagnosealters nimmt die Zahl der asbestassoziierten Berufserkrankungen weiter zu. Oft kann der Bezug einer Erkrankung zu der beruflichen Asbestexposition erst bei der Sektion und durch pathologisch-anatomische Untersuchungen hergestellt werden.
Schlüsselwörter: Asbest – Berufserkrankung – Asbestose – Mesotheliom – Bronchialkarzinom – Epidemiologie
Asbestos-related occupational diseases – developments in Hamburg and the surrounding area
Objectives: This work depicts current trends in asbestos-related occupational diseases on the basis of autopsy findings and their comparison with two previous time periods, using the example of Hamburg as a long-established centre of the asbestos-processing industry.
Collective/Methods: A detailed analysis was carried out at the Institute of Legal Medicine at the University Hamburg-Eppendorf (UKE) on 329 cases which were examined post-mortem between 2000 and 2009 because of suspected occupational disease (BK) caused by exposure to asbestos. These findings were also compared to the observation periods from 1969–1987 and 1988–1999.
Results: Evidence was found of asbestos-related disease in 211 cases. The most frequently represented of the 44 occupations were fitters, dockers and plumbers. A comparison with earlier time periods revealed an increase in the age at diagnosis and in the latency period. Despite the long latency period and the high age at death, it was still possible to detect asbestos bodies in the lung tissue. The severity of asbestosis was more pronounced in the past, but the prevalence of grade 1 asbestosis has increased in recent times.
It was not possible to observe any significant difference in primary tumour localisation between asbestos-related and non-asbestos-related lung tumours. When comparing the findings of routine diagnostic imaging and autopsy, sensitivity was 71 % for X-ray results and 67 % for CT results, thus indicating a high number of unreported cases of asbestos-associated changes. The specificity for both methods was 93 %.
Conclusions: The number of asbestos-related occupational diseases continues to rise owing to the long latency period and the increasing age at diagnosis. It is often impossible to establish a connection between an illness and occupational exposure to asbestos until the autopsy is held and by means of anatomical pathology examinations.
Keywords: asbestos – occupational disease – asbestosis – mesothelioma – bronchial carcinoma – epidemiology
Arbeitsmed Sozialmed Umweltmed 2016; 51: 646–659
Einleitung
Hamburg war lange Zeit eine Hochburg der asbestverarbeitenden Industrie (z. B. Schiffbau). Dem Hafen kam eine zentrale Rolle als Umschlagplatz des Rohstoffes Asbest zu. Bei Untersuchungen im Hamburger Stadtgebiet konnte eine entfernungsassoziierte Verteilung von Mesotheliom-Todesfällen in räumlicher Zuordnung zu einem asbestemittierenden Betrieb mit einer auffälligen Häufung im Stadtteil Bergedorf beschrieben werden (Hain u. Dalquen 1974; Bohlig et al. 1970). Darüber hinaus gab es auch eine erhöhte Asbestbelastung der Bevölkerung innerhalb der Großstadt Hamburg: Die durchschnittliche Asbestkörperzahl bei unselektierten Autopsiefällen betrug 35 Asbestkörper pro ccm Lungengewebe, während bei der übrigen Bevölkerung 22 Asbestkörper pro ccm Lungengewebe als normal angesehen werden. Auch bei 35 % der im Alter zwischen 7 und 16 Jahren verstorbenen Kinder konnten Asbestkörper in der Lunge nachgewiesen werden (Püschel et al. 1988).
Nach einem Konsumhoch in den siebziger Jahren wurde die Verwendung von Asbest kontinuierlich reduziert, 1993 in Deutschland und 2005 in Europa schließlich ganz verboten. Expositionsquellen bestehen weiterhin z. B. durch asbestverseuchte Gebäude oder erhöhte natürliche Mineralkonzentrationen in der Erdkruste.
Asbest zeigt sich für vier Berufskrankheiten (BK) der aktuellen Berufskrankheitenliste verantwortlich: Nr. 4103 (Asbestose der Lunge und/oder Pleura), Nr. 4104 (Lungen- oder Kehlkopfkrebs), Nr. 4105 (Mesotheliom) und Nr. 4114 (Lungenkrebs durch das Zusammenwirken von Asbestfaserstaub und polyzyklischen aromatischen Kohlenwasserstoffen). Als Hilfestellung für die einheitliche Beurteilung von Verdachtsanzeigen, gibt es seit 2011 die Leitlinie „Diagnostik und Begutachtung asbestbedingter Berufskrankheiten“ für Ärzte und Gutachter.
Für die Anerkennung einer Berufserkrankung muss zum einen die medizinische Diagnose eindeutig gesichert sein, zum anderen muss eine berufstypische besondere Belastung (Asbeststaubexposition) bei einer versicherten Tätigkeit bestanden haben. Bei einer BK 4104 muss neben der medizinischen Diagnose Lungen- oder Kehlkopfkrebs und der beruflichen Asbeststaubexposition außerdem entweder ein sog. Brückenbefund vorliegen: Asbestose der Lunge, Asbesterkrankung der Pleura (Plaques) oder eine berufliche Exposition mit dem Nachweis der Einwirkung einer kumulativen Asbestfaserstaubdosis am Arbeitsplatz von mindestens 25 Faserjahren (25 × 10 6 [(Fasern/m 3 ) × Jahre]).
Während die diffuse Pleurafibrose, eine Pleuraschwarte oder Pleuraverwachsungen unspezifisch sind, treten typische tafelbergartig erhabene Plaques fast nur im Zusammenhang mit einer Asbeststaubexposition auf und gelten daher als typischer Brückenbefund. Plaques lassen sich radiologisch im hochauflösenden CT von mindestens 1 mm Schichtdicke feststellen, sehr kleine Plaques können sich der radiologischen Diagnostik allerdings entziehen. Das Ausmaß der Plaques korreliert mit der Asbestbelastung im Lungengewebe (Yusa et al. 2015).
Die histologische Diagnose einer Asbestose erfordert nach den Helsinki-Kriterien von 1997, aktualisiert 2014 (Wolff et al. 2015), den Nachweis einer Fibrose sowie den mikroskopischen Nachweis darin eingelagerter Asbestkörper. Die Asbestose wird in vier Schweregrade eingeteilt, wobei die Asbestose Grad I im Bereich der Bronchioli respiratorii so gering ausgeprägt ist, dass sie sich radiologisch nicht nachweisen lässt, sondern ausschließlich histologisch festgestellt werden kann. Da Asbestkörper sehr klein sind und die pathologische Routinediagnostik primär nicht darauf ausgelegt ist, minimale asbestbedingte Veränderungen zu erkennen, sondern in erster Linie dazu dient, Veränderungen mit Krankheitswert, insbesondere Malignität, zu beurteilen, werden sie häufig auch in Spezialfärbungen übersehen. In diesem Fall hilft die Durchführung einer Lungenstaubanalyse in einem darauf spezialisierten Referenzzentrum. In Kenntnis des Ergebnisses der Lungenstaubanalyse kann das histologische Präparat noch einmal gezielt untersucht und die Diagnose im Zusammenhang gestellt werden.
Der Nachweis von Asbestkörpern in der Lungenstaubanalyse wird durchgeführt, wenn eine berufliche Exposition nicht ausreichend zu sichern ist, aber eine Berufskrankheit zur Diskussion steht, wenn radiologisch keine Brückenbefunde zu ermitteln sind und sich die Frage nach einer Asbestose stellt oder wenn fibrosierende Lungenveränderungen unterschiedlicher Genese differenzialdiagnostisch voneinander unterschieden werden müssen. Liegt eine Fibrose vor und das Gewebe ist durch sekundäre Lungenveränderungen (tumorös, entzündlich, fäulnisbedingt, autolytisch) nur eingeschränkt beurteilbar, so ist eine elektronenmikroskopische Analyse erforderlich, in der der Nachweis von Asbestfasern im Lungengewebe gelingen kann (Roggli u. Sporn 2016).
Der Nachweis von Asbestkörpern ist ein wichtiges differenzialdiagnostisches Kriterium zur Abgrenzung einer Asbestose von anderen unspezifischen Fibrosen mit dem Bild der „usual interstitial pneumonia“ (UIP) wie z. B. der idiopathischen pulmonalen Fibrose (IPF; Lynch et al. 2016). Die Durchführung einer Lungenstaubanalyse setzt allerdings voraus, dass ausreichend geeignetes Lungengewebe vorhanden ist, z. B. aus einer Operation oder Obduktion.
Lässt sich ein Verdacht auf eine Berufserkrankung zu Lebzeiten nicht klären oder ist der Zusammenhang zwischen einer Berufserkrankung und dem Tod unklar, so kann zur abschließenden medizinischen Beurteilung eine pathologische Untersuchung im Rahmen einer Obduktion durchgeführt werden. Hierbei kann ein vitaler Primärtumor eindeutig diagnostiziert werden, auch können typische asbestbedingte Veränderungen wie Plaques gefunden werden. Am Obduktionsgewebe kann durch lungenstaubanalytische und histologische Untersuchungen eine Asbestose gesichert werden, auch unter dem Bild einer Asbestose Grad I (Minimalasbestose), die sich ausschließlich histologisch feststellen lässt.
Material und Methoden
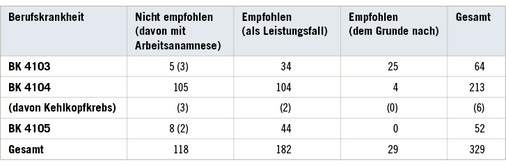
Zur Analyse gelangten 349 Sektionsfälle mit asbestbedingten Fragestellungen der Jahre 2000 bis 2009 aus dem Einzugsgebiet des Instituts für Rechtsmedizin des Universitätsklinikums Hamburg-Eppendorf. Ausgeschlossen wurden 21 Fälle, bei denen weder ein relevanter Primärtumor (Lungenkrebs, Kehlkopfkrebs, Mesotheliom) noch eine Pleura- oder Lungenfibrose diagnostiziert werden konnte (10 Patienten) oder das Rechtsmedizinische Gutachten fehlte (11 Patienten). Das verbliebene Kollektiv bestand aus 323 Männern und 5 Frauen, die sich wie folgt auf die relevanten Berufskrankheiten verteilten: BK 4103: 64, BK 4104: 213, BK 4105: 52, BK 4114: 0. Aufgrund dieser Kollektivzusammensetzung wurden Männer und Frauen gemeinsam ausgewertet. Zur Frage einer BK 4114 gibt es in diesem Kollektiv keine Daten, so dass auch keine Auswertung vorgenommen wurde.
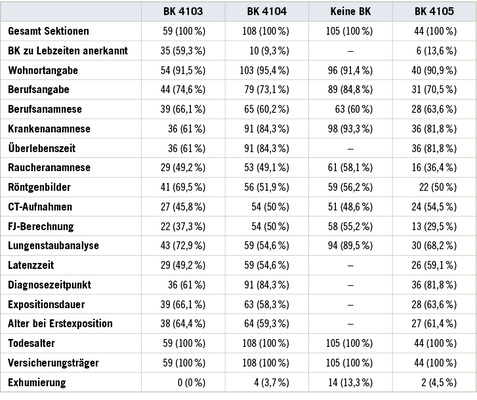
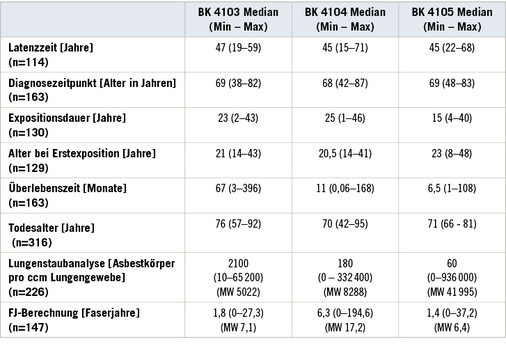
Die Daten zur ermittelten Asbestkörperzahl im Lungengewebe, der Beruf, das Alter bei Erstdiagnose, Expositionsdauer und die kumulative Expositionshöhe wurden aus den jeweiligen rechtsmedizinischen Gutachten, dem Sektionsprotokoll, den von der Berufsgenossenschaft zur Verfügung gestellten Unterlagen hinsichtlich Berufs- und Krankenanamnese sowie dem fachpathologischen, wissenschaftlich begründeten Zusatzgutachten erhoben. Aus den Unterlagen wurden weiterhin Daten zu allgemeinen Begleiterkrankungen, Symptomen, Diagnosesicherung, Röntgenbefunden, Therapiemaßnahmen und Rauchgewohnheiten extrahiert. Bei dem Vergleich der bildgebenden Diagnostik mit den Sektionsbefunden wurden nur Asbestosen Grad II und höher herangezogen, weil die Asbestose Grad I sich radiologisch nicht nachweisen lässt. Nur ein Brückenbefund oder eine Asbestose, die im Röntgenbefund ausdrücklich erwähnt wurde, wurde als in vivo erfasst gewertet. Analysiert wurden die Diagnose von Plaques, Asbestose Grad II – IV und der Tumorverdacht. Dabei wurden sowohl konventionell röntgenologisch erhobene Befunde ausgewertet als auch separat im Zuge der klinischen Diagnosesicherung angefertigte CT-Befunde. Es wurde nicht zwischen CT, PET-CT, HR-CT oder HR-CT in 1 mm Schichtdicke nach der Falkensteiner Empfehlung unterschieden. Eine Zusammenfassung der verfügbaren Daten ist in Tabelle 2 dargestellt.
Die Einstufung des Mesothelioms und des Lungenkrebses erfolgte nach der TNM-Klassifikation der 7. Edition von 2010. Die pathologische Diagnose des Mesothelioms und der Asbestose erfolgte nach national und international gültigen Kriterien (Wolff et al. 2015; Husain et al. 2013; AMWF-Leitlinie 2013; Falkensteiner Empfehlung 2011).
War eine Asbestexposition zum Zeitpunkt der Sektion noch nicht ermittelt, so wurde die BK zunächst ablehnend beurteilt. Als Anerkennung bzw. Ablehnung wurde der Tenor des rechtsmedizinischen Gutachtens gewertet. Bestand ein Versicherungsfall „dem Grunde nach“, also ohne Minderung der Erwerbsfähigkeit oder Rente, so wurde der Fall als anzuerkennen gezählt. Eine BK 4103, die im Zusammenhang mit einer BK 4104 (25 Fälle) oder BK 4105 (11 Fälle) bestand, wurde nicht extra erfasst. Umgekehrt wurden Fälle, die ursprünglich unter dem Verdacht einer BK 4104 oder BK 4105 seziert wurden, unter einer BK 4103 ausgewertet, wenn zwar kein Tumor, aber asbestassoziierte Veränderungen gefunden wurden.
Zum Vergleich der untersuchten drei asbestbedingten Berufskrankheiten wurden der Chi 2 -Test, die Korrelationsanalyse und die Varianzanalyse (ANOVA) angewendet. Vergleichskollektive aus Hamburg existieren für die Jahre 1969 – 1987 (Dirksen 1989) und 1988–1999 (Marten 2001; Marten et al. 2002) aus dem UKE und vom Zentralen Informationssystem der deutschen Gesetzlichen Unfallversicherung (ZIGUV) für das gesamte Bundesgebiet.
Ergebnisse
Von 349 Sektionsfällen aus den Jahren 2000 bis 2009 konnten 328 Patienten mit der Frage nach Berufskrankheiten ausgewertet werden, bei denen sich der Gutachter in 211 Fällen für die Anerkennung aussprach ( Tabelle 1 ). In einem Fall wurden sowohl ein Mesotheliom als auch ein Bronchialkarzinom nachgewiesen, so dass es zu einer Doppelzählung kam. In 6 Fällen handelte es sich um eine Exhumierung. Bei 8 Patienten waren die arbeitstechnischen Ermittlungen zum Asbestkontakt noch nicht abgeschlossen, so dass diese BK im Rahmen dieser Untersuchung zunächst als nicht zur Anerkennung zu empfehlen eingestuft wurde.
In 6 Fällen konnte zwar der klinische Verdacht auf eine BK 4104 oder 4105 nicht bestätigt werden, aber aufgrund der Sicherung von asbestassoziierten Lungen- und/oder Pleuraveränderungen wurde die Anerkennung einer BK 4103 empfohlen. Zusätzlich zu 59 reinen Asbestosen konnte in 25 Fällen eine Asbestose in Kombination mit einem Bronchialkarzinom gesichert werden und in 11 Fällen in Kombination mit einem Mesotheliom.
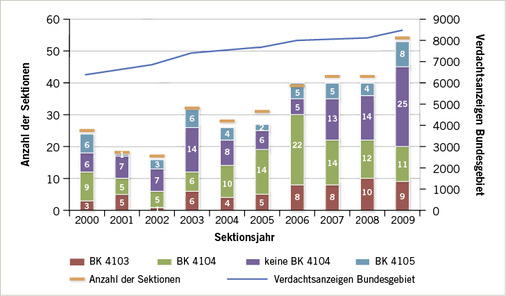
Die Zahl der Sektionen nahm im untersuchten Zeitraum von 25 Fällen im Jahr 2000 auf 54 Fälle im Jahr 2009 zu ( Abb. 1 ). Dabei nahmen vor allem die Fragen nach einer BK 4104 zu, während die Fragen nach einer BK 4103 oder BK 4105 ungefähr gleich geblieben sind (s. Abb. 1). Bei den BK 4103 und BK 4105 konnte in den meisten Fällen die Anerkennung empfohlen werden, während bei einer Frage nach einer BK 4104 die Anerkennung auch genauso häufig nicht empfohlen werden konnte. Ein Trend über die Jahre lässt sich dabei allerdings nicht feststellen.
Tabelle 2 gibt einen Überblick, in welchen Fällen die Auswertung der Kranken- und Berufsanamnese möglich war. Das Kollektiv der nicht zur Anerkennung empfohlenen BK 4103 und 4105 wurde dabei wegen der geringen Fallzahl und noch nicht abgeschlossenen arbeitstechnischen Ermittlungen nicht berücksichtigt.
Herkunft
71 % der untersuchten Patienten stammten aus Hamburg und dem Hamburger Umland, die übrigen Patienten kamen aus dem Norddeutschen Raum (Niedersachsen, Schleswig Holstein, Bremen, Brandenburg, Friesland). In 7 % der Fälle fehlte eine Angabe zum Wohnort.
Diagnosezeitpunkt
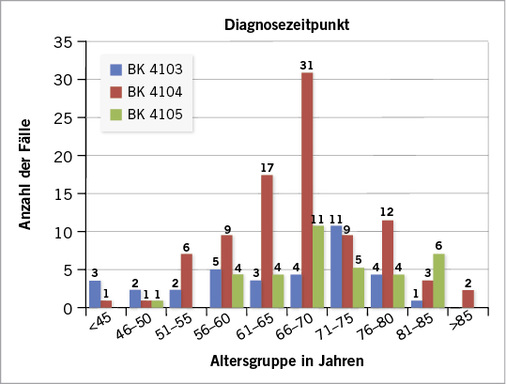
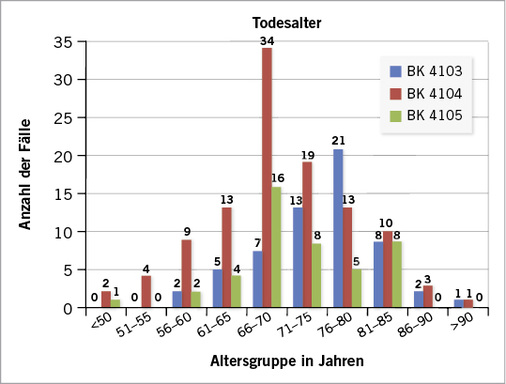
In 163 Fällen lagen umfangreiche Informationen zum Krankheitsverlauf vor. Die Asbestose wurde zwischen dem 38. und 82. Lebensjahr diagnostiziert, in der Hälfte der Fälle wurde die Asbestose erst nach dem 70. Lebensjahr festgestellt. Das Alter zum Zeitpunkt der Diagnose eines Lungentumors betrug durchschnittlich 67 Jahre, dabei reichte die Spanne von 42 bis 87 Jahren. In 3 Fällen wurde der Lungentumor erst bei der Sektion entdeckt. An einem Mesotheliom erkrankten die Versicherten im untersuchten Kollektiv in einem durchschnittlichen Alter von 70 Jahren (48 – 83 Jahre), wobei die Hälfte der Patienten über 69 Jahre alt war. In 3 Fällen wurde das Mesotheliom erst bei der Obduktion festgestellt ( Abb. 2 ).
Latenzzeit
Die Berechnung der Latenzzeit war in 114 Fällen möglich. Bis zur Manifestation einer Asbestose vergingen im Mittel 43 Jahre (19 bis 59 Jahre). Zwischen dem Zeitraum der ersten Exposition und dem Auftreten eines Lungentumors lagen im Durchschnitt 46 Jahre, wobei die Latenzzeit zwischen 15 und 71 Jahren variierte. Vom ersten Asbestkontakt bis zum Auftreten eines Mesothelioms vergingen im Durchschnitt 45 Jahre, die Latenzzeit betrug mindestens 22 Jahre und reichte bis zu 68 Jahren.
Überlebenszeit nach Diagnosesicherung
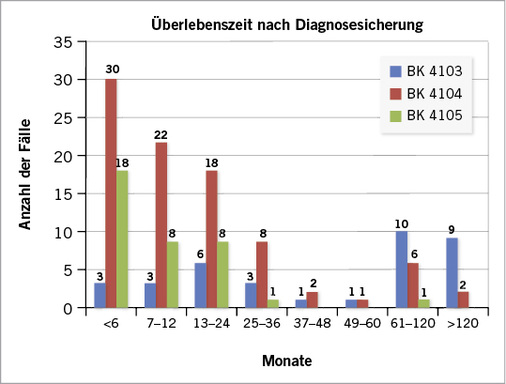
Die Zeit zwischen der Diagnose und dem Tod bei Asbestose reichte von nur wenigen Monaten bis zu 396 Monaten (33 Jahren) und lag durchschnittlich bei 108 Monaten. Die mediane Überlebenszeit lag bei 67 Monaten. Über die Hälfte der Patienten zeigte eine Überlebensdauer von 5 Jahren und mehr. Beim Lungentumor lag die durchschnittliche Überlebenszeit bei 21 Monaten zwischen 2 Tagen und 168 Monaten, der Median bei 11 Monaten. Nur 8 von 91 Patienten überlebten länger als 5 Jahre. Die Überlebenszeit nach der Mesotheliom-Diagnose betrug zwischen 1 und 108 Monaten, wobei eine durchschnittliche Überlebenszeit von 11 Monaten ermittelt werden konnte. Die Hälfte der Patienten verstarb allerdings bereits nach 6,5 Monaten ( Abb. 3 ).
Todeszeitpunkt
Das Sterbealter der sezierten Patienten mit Asbestose lag durchschnittlich bei 75 Jahren (57 bis 92 Jahre). Die Patienten mit Lungentumor wurden durchschnittlich 70 Jahre alt, die Spanne reichte von 42 bis 95 Jahre. Durchschnittlich wurden Mesotheliom-Patienten 72 Jahre alt, der jüngste Patient verstarb mit 48 Jahren, der älteste Patient wurde 84 Jahre alt ( Abb. 4 ).
Raucheranamnese
In 159 Fällen konnten Daten zum Rauchverhalten eruiert werden. 11 Patienten waren Nichtraucher, während 148 Patienten Raucher waren. Die Raucherquote bei den Patienten mit asbestassoziiertem Lungentumor betrug 98 %. In der Gruppe der nichtasbestassoziierten Lungentumoren waren alle Patienten Raucher.
Berufsfelder und Expositionen
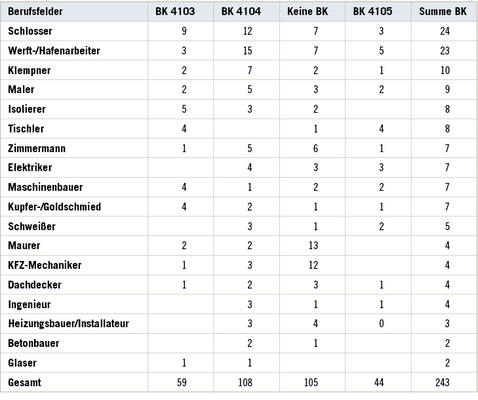
Die 328 Patienten verteilten sich auf insgesamt 44 verschiedene Berufsfelder Es dominieren Schlosser und Werft- bzw. Hafenarbeiter ( Tabelle 3 ). In 243 Fällen (74 %) war eine Berufsanamnese mit Expositionsangaben vorhanden (s. Tabelle 2).
Versicherungsträger
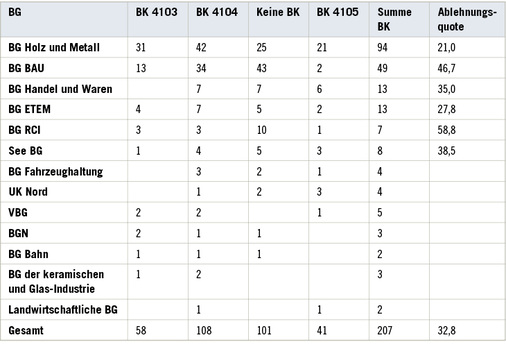
Die Sektionen erfolgten im Auftrag von 23 verschiedenen Unfallversicherungsträgern/Berufsgenossenschaften. Häufigster Auftraggeber sind die Berufsgenossenschaften des Baugewerbes (BG HM, BG BAU) und der rohstoffverarbeitenden Industrie (BG HW, BG ETEM, BG RCI) ( Tabelle 4 ).
Faserjahre und Asbestkörperzahlen
Für 147 Patienten lag eine Faserjahrberechnung des Versicherungsträgers vor. Die Ergebnisse lagen zwischen 0 und 27,3 Faserjahren (Mittelwert 7,1 Median 1,8) im Zusammenhang mit einer BK 4103, wobei hier die Faserjahrberechnung allerdings nicht von Bedeutung ist. Für die Hälfte der sezierten Patienten (n = 54) mit einem zur Anerkennung empfohlenen Lungentumor lag eine Faserjahrberechnung vor. Dabei reichten die berechneten Werte von 0 bis zum Spitzenwert von 194,6 Faserjahren, im Mittelwert um 17,2 Faserjahre. Der geforderte Wert von mindestens 25 Faserjahren wurde bei 9 % der untersuchten Patienten erreicht. In der Gruppe der nicht zur Anerkennung empfohlenen Lungentumoren wurde ebenfalls bei der Hälfte der Patienten (n = 58) eine Faserjahrberechnung übermittelt, die Werte lagen alle unter 25 Faserjahren. Obwohl die Berechnung der Faserjahre für das Mesotheliom nicht von Belang ist, lag eine Berechnung in 13 Fällen vor. Die ermittelten Werte lagen zwischen 0 und 37,2 Faserjahren, der Durchschnitt bei 6,4 und der Median betrug 1,4 Faserjahre.
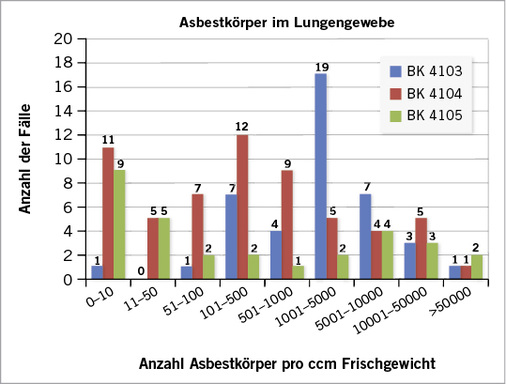
In 226 Fällen wurde eine Faserzählung in der Lungenstaubanalyse durchgeführt. Der Mittelwert lag bei den Asbestosen bei 5022 Asbestkörpern pro ccm Lungengewebe (10 – 65 200) und 731 (60 – 2300) freien Fasern. Die Ergebnisse der Faserzählung in Zusammenhang mit einem asbestassoziierten Lungentumor reichten bis zu 332 400 Asbestkörpern pro ccm Lungengewebe und 6400 freien Fasern. Der Mittelwert lag bei 8288 Asbestkörpern pro ccm Lungengewebe und 726 freien Fasern. Bei der Hälfte der Untersuchungen lag der Wert über 180 Asbestkörpern pro ccm Lungengewebe und 75 freien Fasern ( Abb. 5 ). Bei 90 % der Patienten (n = 94) mit einem asbestunabhängigen Lungentumor – ohne Brückenbefunde – wurde eine Lungenstaubanalyse durchgeführt. Die Werte lagen zwischen 10 und 300 Asbestkörpern pro ccm Lungengewebe, im Durchschnitt bei 43 und zu 50 % unter 20 Asbestkörpern pro ccm Lungengewebe. Bei 8 Patienten wurde zusätzlich eine elektronenmikroskopische Analyse durchgeführt, da autolytische Veränderungen des Gewebes die lichtmikroskopische Analyse erschwerten. Hierbei fanden sich zwischen 0 und 34 600 Chrysotilfasern und zwischen 0 und 103 800 Amphibolfasern pro g Lungengewebe, also deutlich unterhalb des Bereichs, in dem üblicherweise Asbestosen liegen. In Verbindung mit einem Mesotheliom wurden im Mittel in der Lungenstaubanalyse 41 995 Asbestkörper pro ccm Lungengewebe gezählt, ein Maximum wurde mit 936 000 Asbestkörpern pro ccm Lungengewebe erreicht, der Median lag bei 60 Asbestkörpern pro ccm Lungengewebe. Zusätzlich wurden im Durchschnitt 229 freie Fasern pro ccm Lungengewebe gezählt, die Spanne reichte hier von 10 bis zu 900 freien Fasern, der Median lag bei 75 freien Fasern.
Pathologisch-anatomische Befunde
Plaques
Bei 189 untersuchten Patienten konnten in der Sektion asbestassoziierte Plaques nachgewiesen werden, davon war in 39 % der Fälle auch das Zwerchfell befallen, in 3 % auch der Herzbeutel. 25 % der Plaques wiesen eine Verkalkung auf, wobei in Assoziation mit einer Asbestose die Plaques häufiger verkalkt waren (42 %) als im Zusammenhang mit einem Tumorleiden (18 % bzw. 19 %).
Als weitere pleurale Begleiterkrankungen, die allerdings nicht spezifisch für eine Asbestexposition sind, traten die diffuse Pleurafibrose (n = 31), eine Hyalinosis complicata (n = 4), eine Pleuraschwarte (n = 109) und Pleuraverwachsungen (n = 102) auf. Die diffuse Pleurafibrose (BK 12 %, keine BK 5 %) und die Pleuraschwarte (BK 38 %, keine BK 25 %) waren im Zusammenhang mit einer Berufserkrankung geringfügig häufiger festzustellen als ohne Berufserkrankung. Die Hyalinosis complicata (1 %) und Pleuraverwachsungen (31 – 32 %) waren in beiden Gruppen ungefähr gleich häufig vertreten.
Lungenfibrosen
Von 84 histologisch gesicherten Asbestosen wiesen 81 % nur einen geringen Schweregrad im Sinne einer sog. Minimalasbestose auf, 12 % hatten eine Asbestose Grad II und 4 % eine Asbestose Grad III. Bei 23 % der Patienten mit einem Lungentumor konnte eine Asbestose als Brückenbefund histologisch gesichert werden. Diese war zu 92 % eine Asbestose Grad I und in 8 % der Fälle eine Asbestose Grad II. In 32 % der Fälle (n = 14) trat das Mesotheliom in Kombination mit einer Lungenfibrose auf. In der Hälfte der Fälle handelte es sich um eine Minimalasbestose und bei 3 Patienten um eine Asbestose Grad II.
Tumorerkrankung
Zusätzlich zur Asbestose fanden sich unabhängig von der Berufskrankheit Karzinome der Prostata (4), des Urothels (2), des Darms (2) und ein Magenkarzinom sowie ein Ösophagus Karzinom.
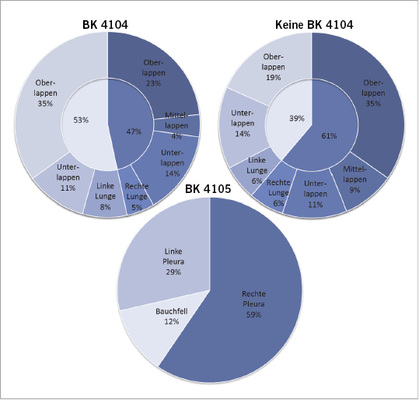
Die Lokalisation des asbestassoziierten Primärtumors der Lunge war ungefähr zu gleichen Anteilen auf die rechte und linke Lunge verteilt (47 % zu 53 %), wobei der Oberlappen zu 57 % betroffen war, der Unterlappen zu 25 %. Bei den asbestunabhängigen Lungentumoren traten die Tumoren zu 61 % in der rechten Lunge auf und zu 53 % im Oberlappen. Der Unterlappen war in 25 % der Fälle Ausgangspunkt des Primärtumors (Abb. 6). Histologisch handelte es sich bei den asbestassoziierten Tumoren zu 34 % um Plattenepithelkarzinome und zu 32 % um Adenokarzinome. Daneben traten zu 14 % kleinzellige Karzinome auf und in 9 % der Fälle lag eine Mischform vor. In 11 % der Fälle war ein nichtkleinzelliges Karzinom ohne nähere Angabe angegeben worden. Unter den nichtasbestassoziierten Tumoren fanden sich zu 33 % Adenokarzinome, 30 % Plattenepithelkarzinome und 21 % kleinzellige Karzinome. Eine Mischform trat in 7 % der Fälle auf und in 7 % der Fälle war der histologische Subtyp nicht näher identifizierbar. Unter den nichtasbestinduzierten Tumoren fanden sich außerdem ein anaplastischer Tumor und ein Sarkom der Lunge.
Zum Zeitpunkt der Sektion war die Tumorerkrankung bereits weit vorgeschritten. In 85 % der Fälle lagen Lymphknotenmetastasen vor und in 74 % der Fälle ließen sich Fernmetastasen finden. Die Metastasen verteilten sich auf die Lymphknoten (76 %), Knochen (43 %), Leber (36 %), Nebennieren (32 %), Lunge (29 %), Pleura (23 %), Gehirn (22 %), Niere (11 %), Herz (10 %), Schilddrüse (7 %), Peritoneum (7 %), Thoraxwand (4 %) sowie Pankreas, Milz, Darm, Harnblase, Zwerchfell, Hirnhäute, Haut.
In der Gruppe der untersuchten Mesotheliome lag in den meisten Fällen ein Pleuramesotheliom vor (88 %), das zu 57 % in der rechten Thoraxhälfte lokalisiert war, nur 12 % waren Mesotheliome des Peritoneums. 49 % der Pleuramesotheliome waren vom epitheloiden Subtyp, 15 % führend sarkomatoid und 36 % biphasisch. Unter den peritonealen Mesotheliomen fand sich ein biphasischer Subtyp unter ansonsten epitheloiden Mesotheliomen. Die Diagnosesicherheit nach dem Europäischen Mesotheliompanel wurde zu 71 % mit A bewertet und zu 29 % mit B.
Zum Todeszeitpunkt war die Mesotheliomerkrankung ebenfalls weit fortgeschritten. Zu 93 % war der Tumor in die umgebenden Organe eingebrochen und zu 86 % lagen Metastasen vor. Tumorabsiedlungen wurden zu 64 % in den Lymphknoten gefunden, aber auch im Knochen (32 %), Peritoneum (30 %), Lungenparenchym (23 %), der Leber (21 %), Nebennieren (18 %), Herz (14 %), Pleura (14 %), Gehirn, Zwerchfell, Thoraxwand, Niere, Pankreas und Milz.
Röntgenologische Befunde vs. Sektionsbefunde
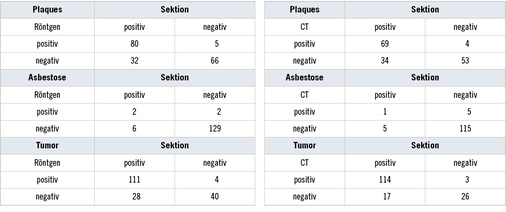
In 183 Fällen gab es eine Auswertung röntgenologischer Befunde in den Aktenunterlagen. In 160 Fällen war ein CT-Befund erhoben worden. Die Ergebnisse im Vergleich zum Sektionsbefund sind in Tabelle 5 dargestellt.
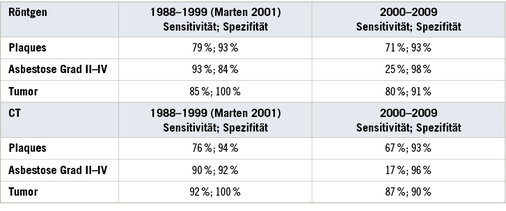
Der röntgenologisch erhobene Plaquestatus wurde in 146 Fällen bestätigt, in 5 Fällen war die bildgebend gesehene pleurale Veränderung keine asbestassoziierte hyaline Plaque und in 31 Fällen waren Plaques übersehen worden. Der CT-Befund wurde in 122 Fällen durch die Sektion bestätigt, in 4 Fällen wurde das CT-Ergebnis durch die Sektion widerlegt und in 34 Fällen waren die Plaques im CT-Befund nicht beschrieben worden. Somit ergibt sich eine Sensitivität von 71 % für das Röntgenergebnis und von 67 % für das CT-Ergebnis. Für beide Methoden ergibt sich eine Spezifität von 93 %.
Bei der Diagnose der Asbestose Grad II–IV wurde die röntgenologisch erhobene Diagnose in 131 Fällen durch die Sektion bestätigt, der CT-Befund in 116 Fällen. In 2 Fällen mit Röntgenbild und 5 Fällen mit CT-Aufnahme wurde die Diagnose nicht bestätigt, es lag zwar eine Fibrose vor, aber keine Asbestose. Bei 6 Röntgenaufnahmen und 5 CT-Befunden konnte in der Sektion trotz negativen bildgebenden Befunds eine Asbestose gesichert werden. Die Sensitivität der Röntgenbilder lag somit bei 25 %, die der CT-Aufnahmen bei 17 %. Die Spezifität war hingegen mit 98 % (Röntgen) und 96 % (CT) sehr gut.
Für die Tumordiagnose konnte ein ähnlicher Vergleich angestellt werden. In 151 Fällen bestätigte sich die röntgenologisch erhobene Verdachtsdiagnose in der Sektion, 140-mal bestätigte sich der im CT erhobene Befund. In 28 Fällen wurde bei der Sektion ein Tumorleiden der Lunge oder Pleura entdeckt, das im Röntgenbild nicht beschrieben worden war, in 17 Fällen lag ein Tumor vor, der im CT nicht ausgesprochen worden war. In 4 bzw. 3 Fällen wurde die bildgebend erhobene Verdachtsdiagnose eines Tumorleidens in der Sektion nicht bestätigt. Die Sensitivität der Röntgendiagnostik liegt somit bei 80 % die der CT-Befunde bei 87 %. Für die Spezifität ergeben sich Werte von 91 % für Röntgenbefunde und 90 % für CT-Befunde.
Brückenbefunde
Bei 10 sezierten Patienten mit einem Lungentumor konnte die geforderte Exposition von mindestens 25 Faserjahren erreicht werden und der Lungentumor somit als Berufskrankheit zur Anerkennung empfohlen werden. Allerdings lag zum Zeitpunkt der Sektion nur bei der Hälfte der Patienten überhaupt eine Faserjahrberechnung vor. In 23 % der Fälle ließ sich eine Asbestose mindestens Grad I als Brückenbefund nachweisen. Zu 94 % waren Plaques bei der Sektion gefunden worden und ließen sich als Brückenbefund werten.
Todesursache
Bei 246 von 247 Patienten mit einer Berufskrankheit ließ sich die Todesursache abschließend klären. Bei 4 Patienten war die Berufskrankheit Asbestose durch die daraus resultierende Herzinsuffizienz mitverantwortlich für den Tod, in 19 Fällen war eine Pneumonie auf dem Boden einer Asbestose alleinige Todesursache und in 9 Fällen führte die Pleuraasbestose mit ausgeprägten Pleuraverwachsungen und Verschwartungen durch die Minderbelüftung der Lunge zum Tod des Versicherten. In einem Fall lag eine Lungenfesselung vor, an der der Versicherte verstarb. In 56 % der Sektionen mit der Frage nach einer BK 4103 war die Berufskrankheit somit verantwortlich für eine Verkürzung der Lebenszeit. In 96 % der Fälle (n=104) hatte die Lungentumorerkrankung durch tumortoxisches Herz-Kreislauf-Versagen den Tod herbeigeführt, in 13 Fällen war der Lungentumor zumindest mitverantwortlich für den Tod. In 4 Fällen war eine Asbestose am Tod beteiligt und in 3 Fällen eine Lungenfesselung. Bei einer Mesotheliomerkrankung war in 95 % der Fälle (n = 42) der Tod auf das Mesotheliom zurück zu führen. In 8 Fällen war das Mesotheliom zumindest teilursächlich für den Tod verantwortlich und in 2 Fällen lag eine Lungenfesselung vor. Aufgrund von starken Fäulnisveränderungen ließ sich in einem Fall die Todesursache nicht mehr genau klären.
Gründe für die Ablehnung
Gründe für die Wertung als abzulehnende BK 4103 in dieser Arbeit waren zum einen der nicht nachgewiesene berufliche Asbestkontakt in 2 Fällen, zum anderen die Widerlegung der klinischen Diagnose. In diesen 3 Fällen lag keine asbestassoziierte Asbestose der Lunge oder der Pleura vor.
Trotz des Nachweises eines primären Lungentumors und Brückenbefunden in Form von Pleuraplaques wurde in 3 Fällen keine BK 4104 anerkannt, da sich durch den technischen Aufsichtsdienst des Unfallversicherungsträgers kein beruflicher Asbestkontakt nachweisen ließ. In einem Fall war der Tod durch ein konkurrierendes Krebsleiden verursacht worden. In den in dieser Arbeit als abgelehnte BK 4105 gewerteten Fällen ließ sich durch den technischen Aufsichtsdienst des Unfallversicherungsträgers in einem Fall kein beruflicher Asbestkontakt feststellen und in einem Fall lag kein Mesotheliom, sondern ein metastasiertes Magenkarzinom vor.
Diskussion
Das Ziel dieser Arbeit war die ausführliche Analyse der obduzierten asbestbedingten Berufserkrankungen am Institut für Rechtsmedizin des Universitätsklinikums Hamburg Eppendorf in den Jahren 2000 bis 2009 sowie die Ableitung neuer Entwicklungen aus Hamburg und Umgebung im Vergleich zu den zuvor untersuchten Dekaden. Hierfür wurden die Parameter Latenzzeit, Diagnosezeitpunkt, Expositionsdauer, Alter bei Erstexposition, Überlebenszeit nach Diagnosesicherung, Todesalter, Asbestkörper im Lungengewebe und die berechneten Faserjahre ausgewertet und verglichen ( Tabelle 6 ).
Es wurden alle am Hamburger Institut für Rechtsmedizin durchgeführten Obduktionen im Zusammenhang mit dem Verdacht auf eine asbestbedingte Berufserkrankung ausgewertet. Eine Selektion fand nicht statt, insofern ist das Kollektiv als repräsentativ für das Einzugsgebiet des Instituts zu betrachten, was im Wesentlichen den Hamburger Raum und dessen Umland betrifft. Da Hamburg lange Zeit eine Hochburg der asbestverarbeitenden Industrie war, waren entsprechend viele Berufstätige Asbeststaub exponiert, so dass mit 329 auswertbaren Obduktionen ein großes Kollektiv mit einer soliden Datengrundlage zusammengetragen werden konnte, was sich im Umfang der Ergebnisse widerspiegelt.
Für den Vergleich mit früheren Ergebnissen und die Darstellung aktueller Entwicklungen wurden zwei Kollektive herangezogen, die unter sehr ähnlichen Bedingungen zusammengetragen worden sind, da sie aus demselben Institut stammen. Daher waren die drei untersuchten Kollektive 1969 – 1987, 1988 – 1999 und 2000 – 2009 sehr gut vergleichbar.
Einschränkend ist zu sagen, dass diese Arbeit ausschließlich auf den Ergebnissen durchgeführter Obduktionen basiert, so dass Daten zu asbestbedingten Berufserkrankungen fehlen, die nicht obduziert werden, weil alle Fragen schon zu Lebzeiten eindeutig beantwortet werden konnten. Dies muss aber kein Mangel dieser Arbeit darstellen, da eine Obduktion nicht ausschließlich dann durchgeführt wird, wenn eine Berufserkrankung fraglich ist, sondern auch dann, wenn eine Berufserkrankung bereits anerkannt wurde, aber der Zusammenhang mit dem Tod zu klären ist. Dies ist insbesondere bei einer Berufserkrankung nach Ziffer 4103 der Fall (59,3 %), betrifft aber auch die beiden anderen ausgewerteten Fragestellungen BK 4104 (9,3 %) und BK 4105 (13,6 %; s. Tabelle 2).
Die Tatsache, dass ausschließlich Obduktionen ausgewertet wurden, bietet aber auch den Vorteil, dass eben auch Fragen eindeutig und abschließend beantwortet werden können, die sich zu Lebzeiten nicht mehr klären ließen.
Latenzzeit und Diagnosesicherung
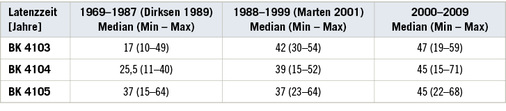
Asbestbedingte Berufserkrankungen wurden im Mittel im Alter von 69 Jahren diagnostiziert. Die Latenzzeit von der ersten Asbestexposition bis zum Ausbruch einer asbestbedingten Erkrankung betrug im Mittel 46 Jahre. Vergleicht man die drei Berufskrankheiten untereinander mittels Varianzanalyse, so ergeben sich keine signifikanten Unterschiede (p 0,05). In der Gegenüberstellung mit den Daten aus den vorangegangenen Dekaden hingegen ergibt sich ein deutlicher Anstieg der Latenzzeit für alle drei untersuchten Berufserkrankungen ( Tabelle 7 ). Dieses Ergebnis passt gut zu den Ergebnissen anderer Studien, die ebenfalls eine Zunahme der Latenzzeit beobachteten (Neumann et al. 2011; Roggli u. Vollmer 2008). Dies ist durchaus vereinbar mit dem stetigen Rückgang der Asbestbelastung durch ein generelles Verwendungsverbot in Deutschland seit 1993. Da Berufstätige keiner Asbestbelastung mehr ausgesetzt sind und Versicherte mit kürzeren Latenzzeiten bereits erkrankt sind, kommen nur noch Erkrankungen mit einer längeren Latenzzeit nach und die mittlere Latenzzeit verschiebt sich folglich in Richtung einer längeren Latenzzeit.
Auffallend ist die lange Latenzzeit von 47 Jahren in der Gruppe der Asbestosen. Andere Autoren dokumentieren eine Dauer von 10 bis 43 Jahren zwischen dem ersten Asbestkontakt und der Diagnose einer Asbestose (IVSS 2006; Roggli et al. 2010). Hier ist zu berücksichtigen, dass in dieser Arbeit überwiegend Asbestosen Grad I, also gering-gradige Asbestosen untersucht worden sind.
Für asbestbedingte Lungentumoren wurde in einer Zusammenfassung zahlreicher Studien zwischen 1997 und 2004 eine Latenzzeit von 10 bis 35 Jahre ermittelt (Henderson et al. 2004). Die in dieser Arbeit berechnete Latenzzeit von 45 Jahren liegt deutlich darüber, was mit dem späteren Untersuchungszeitraum (2000–2009) begründet ist und somit mit der Beobachtung korreliert, dass die Latenzzeit zunimmt.
Innerhalb der Mesotheliome passt die in dieser Arbeit berechnete Latenzzeit von 45 Jahren sehr gut zu den Ergebnissen anderer aktueller Studien von 42,5 Jahren bis zu 60 Jahren (Neumann et al. 2011; Tischoff et al. 2011).
Zu bedenken ist, dass dem in dieser Arbeit untersuchten Kollektiv ausschließlich Sektionen zugrunde lagen. Die Diagnosesicherung konnte zum Teil erst post mortem erhoben werden, so dass es hier im Vergleich zu anderen Arbeiten zu einer Verschiebung in Richtung eines älteren Lebensalters gekommen ist.
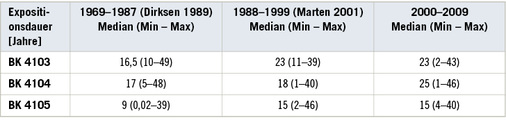
Ein Zusammenhang zwischen der Expositionsdauer und der Latenzzeit oder der Schwere einer Erkrankung hat sich in dieser Arbeit nicht ergeben. Die Expositionsdauer im untersuchten Kollektiv lag um 25 Jahre in der Gruppe der Asbestosen und Lungentumoren und bei 15 Jahren in der Gruppe der Mesotheliome. Im Vergleich zu früheren untersuchten Zeiträumen aus Hamburg und Umgebung ergibt sich kein signifikanter Unterschied in der Expositionsdauer seit dem Asbestverwendungsverbot. Lediglich im Untersuchungszeitraum der Sektionen von 1969 – 1987 ergeben sich kürzere Expositionszeiten, da diese Versicherten noch vor dem Asbest-Boom erwerbstätig waren. Für die Gruppe der Mesotheliome ergeben sich die kürzesten Expositionszeiten über alle Beobachtungszeiträume ( Tabelle 8 ). Die Ergebnisse zeigen, dass schon eine kurze Expositionsdauer von nur einem Jahr geeignet ist, ein Mesotheliom oder einen Lungentumor zu provozieren.
Überlebenszeit und Todesalter
Die Überlebenszeit differiert signifikant zwischen den Berufserkrankungen (p 0,05). Erwartungsgemäß ergibt sich für Tumorerkrankungen eine deutlich kürzere Überlebenszeit als für Asbestosen. Die Fünfjahresüberlebensrate lag bei den Tumorerkrankungen Lungenkrebs bzw. Mesotheliom bei nur 6 %, während sie für Asbestosen bei über 50 % lag. Entsprechend lag auch das Todesalter bei den Asbestosen deutlich höher, als bei den Tumorerkrankungen (s. Abb. 4). Die besonders kurze Überlebenszeit beim Lungenkrebs könnte wiederum in der Besonderheit des Kollektivs dieser Arbeit begründet sein, das ausschließlich aus Sektionen bestand. Bei den Asbestosen war eine Berufserkrankung in 60 % der untersuchten Fälle bereits zu Lebzeiten anerkannt worden. Die Sektion wurde durchgeführt, um die genaue Todesursache zu klären (s. Tabelle 2). In der Gruppe der Tumorerkrankungen waren nur sehr wenige Fälle zu Lebzeiten bereits anerkannt (Lungenkrebs: 9,3 % bzw. Mesotheliom 13,6 %). Hier diente die Sektion auch der Diagnosesicherung, da diese wegen des vorgeschrittenen Tumorstadiums oder des raschen Verlaufs der Erkrankung zu Lebzeiten nicht mehr hatte erfolgen können. Somit ergeben sich in dieser Arbeit besonders kurze Überlebenszeiten nach Diagnosestellung.
Asbestkörper
Im Vergleich der im Lungengewebe nachgewiesenen Asbestkörperzahl fällt ein signifikanter Unterschied zwischen der Gruppe der Asbestosen und der Gruppe der an einem asbestassoziiertem Tumor Erkrankten auf (p 0,05), wobei kein signifikanter Unterschied in der Asbestkörperzahl in Verbindung mit einem Lungentumor oder einem Mesotheliom beobachtet wurde. Innerhalb einer Gruppe kam es zu einer erheblichen Streuung der staubanalytisch ermittelten Werte (s. Tabelle 6). Bei den Tumorpatienten wurden deutlich höhere Maxima erreicht mit sichtbarem Einfluss auf den Mittelwert, wohingegen die untersuchten Asbestosen im Median betrachtet deutlich höhere Asbestkörperzahlen pro ccm Lungengewebe aufwiesen als das bei den analysierten Tumorpatienten der Fall war. Die Hälfte der analysierten Asbestosen hatten Asbestkörperzahlen über 2100 pro ccm Lungengewebe, wohingegen bei der Hälfte der Tumorpatienten unter 180 bzw. 60 Asbestkörper pro ccm Lungengewebe gefunden wurden. Dies wird auch von anderen Autoren beschrieben (Brockmann 1991; Roggli u. Vollmer 2008). Nach wissenschaftlichem Kenntnisstand sind für die Induktion einer Asbestose deutlich höhere Asbestexpositionen und pulmonale Belastungen notwendig, während für die Entwicklung eines Mesothelioms oder Pleuraplaques schon eine geringere Asbestbelastung ausreichend ist (Roggli et al. 2010).
Ein Grenzwert, unter dem eine Erkrankung durch Asbestgefährdung ausgeschlossen werden kann, kann nicht festgelegt werden.
Trotz der langen Latenzzeit von im Median 47 Jahren bis zu 59 Jahren und dem hohen Todesalter von 76 Jahren waren bei den Asbestosen die Asbestkörper noch sehr gut in der Lunge nachweisbar im Einklang mit den 1997 festgelegten Helsinki-Kriterien zur Diagnose einer Asbestose, die im Jahr 2014 aktualisiert wurden (Wolff et al. 2015). Dies wird auch von anderen Autoren beschrieben, die 30 Jahre und mehr nach der letzten Exposition noch Asbestfasern in der Lunge nachweisen konnten (Adib et al. 2013).
Faserjahre
Die Berechnung der Faserjahre wird durch den technischen Aufsichtsdienst des zuständigen Unfallversicherungsträgers durchgeführt. Die Faserjahrberechnung ist allerdings nur für die Anerkennung eines Lungentumors nach BK 4104 von Bedeutung, da der Nachweis einer kumulativen Asbestfaserstaubdosis am Arbeitsplatz von mindestens 25 Faserjahren (25 × 10 6 [Fasern /m 3 ) × Jahre] seit 1992 als ein Beweis für den Ursachenzusammenhang angesehen wird. 18,5 % der Patienten im Kollektiv mit einem asbestassoziierten Lungentumor wiesen diesen Wert auf, während in den beiden anderen Gruppen der Anteil mit über 25 Faserjahren unter 5 % bzw. 10 % lag.
Lungentumoren können auch durch viele andere – nicht berufsbedingte – konkurrierende Noxen verursacht werden. Hier ist vor allem das Rauchverhalten zu nennen (Mehrtens et al. 1998). In der Gruppe der Lungentumore waren 98 % (BK 4104) bzw. 100 % (keine BK 4104) Raucher, während in der Gruppe der Asbestosen zu 17 % und in der Gruppe der Mesotheliome 31 % Nichtraucher betroffen waren. Für die Anerkennung als Berufskrankheit ist aber der Nachweis eines eindeutigen Ursachenzusammenhangs zur Asbestexposition erforderlich, so dass die Hürden beim Lungentumor durch den Gesetzgeber höher gelegt worden sind. Im Gegensatz dazu gilt das Mesotheliom als Signaltumor, es besteht eine hohe spezifische Bindung zwischen Asbest und der Mesotheliomerkrankung.
Industriezweige
Die Mehrzahl der Patienten mit einer Verdachtsanzeige war in der asbestanwendenden Industrie tätig. Es zeigte sich eine große Palette an typischen Berufsbildern, die auch die Gruppe der zur Anerkennung empfohlenen Berufskrankheiten anführen, wobei Schlosser, Werft- und Hafenarbeiter und Klempner dominierten, gefolgt von Malern, Isolierern, Schreinern (s. Tabelle 3). Diese Berufsgruppe hatte vor allem Umgang mit Rohasbest oder nur lose gebundenem Asbest wie Spritzasbest und Isolierungen, der unter hoher Staubbelastung gesägt, geschnitten und geschliffen werden musste. In der Gruppe der Patienten bei denen die Anerkennung einer Berufskrankheit nicht empfohlen werden konnte, weil der Lungentumor sich nicht auf die Asbestbelastung am Arbeitsplatz ursächlich zurück führen ließ, fallen zahlenmäßig Maurer und KFZ-Mechaniker sowie Straßen- und Trockenbauer auf. In der letzten Gruppe wurde der Asbest eher fest gebunden im Asbestzement verarbeitet oder es trat nur in einem geringen Umfang eine Asbeststaubbelastung in der Luft am individuellen Arbeitsplatz auf (DGUV 2013). Eine Veränderung der Berufsbilder über den Beobachtungszeitraum ließ sich nicht feststellen. Ein ähnliches Bild ergibt sich für die zuständigen Unfallversicherungsträger. Die metallverarbeitende Industrie zeichnete sich für die meisten Sektionen verantwortlich, gefolgt von Unfallversicherungsträgern des Baugewerbes, des Warenhandels und der Elektrounternehmen. Bei den für die Metall- und Elektroindustrie durchgeführten Sektionen sprach sich der Gutachter überdurchschnittlich häufig für die Anerkennung einer Berufskrankheit aus, während die Ergebnisse der Sektionen im Rahmen des Baugewebes und der Rohstoffe verarbeitenden Industrie überdurchschnittlich häufig nicht zur Anerkennung empfohlen werden konnten, wobei zu berücksichtigen ist, dass das Ermittlungsverfahren zum Zeitpunkt des Sektionsgutachtens häufig noch nicht abgeschlossen war und die Ablehnungsquote somit unter Vorbehalt zu verstehen ist. Möglicherweise ist diese Beobachtung auch damit zu erklären, dass der Fachausschuss „Steine und Erden I“ als erster Versicherungsträger das Asbestspritzen in seinen Betrieben verboten hat und somit eine Vorreiterrolle in Sachen Arbeitsschutz einnimmt. Durch geeignete Arbeitsschutzmaßnahmen ging die Asbeststaubbelastung am Arbeitsplatz kontinuierlich zurück (Coenen 1997). Die Branchen der zuständigen Versicherungsträger passen durchaus auch zu den betroffenen Berufsgruppen.
Epidemiologische Aspekte
Vergleicht man diese Arbeit mit Arbeiten vorangegangener Dekaden aus dem Hamburger Institut für Rechtsmedizin, so fällt eine deutliche Zunahme der Sektionen im Zusammenhang mit Asbest von 108 Sektionen in 19 Jahren (Dirksen 1989) bzw. 190 Sektionen in 12 Jahren (Marten 2001) auf 328 Sektionen in 10 Jahren auf. Dies liegt einerseits am größeren Einzugsgebiet des Instituts. Neben Verstorbenen aus dem Hamburger Raum wurden im Beobachtungszeitraum auch Verstorbene mit ehemaligem Wohnsitz in Niedersachsen, Schleswig-Holstein, Bremen, Brandenburg und Friesland obduziert. Gleichzeitig korreliert die größere Fallzahl mit einem deutschlandweiten Anstieg der asbestassoziierten Erkrankungen bzw. der Verdachtsanzeigen nach der Statistik der DGUV (s. Abb. 1).
Sowohl im Hamburger Raum als auch im Bundesgebiet nehmen die Zahlen der asbestbedingten Berufserkrankungen und Verdachtsmeldungen zu. Dies liegt an den langen Latenzzeiten einer asbestassoziierten Erkrankung. Die Daten des untersuchten Beobachtungszeitraums dieser Arbeit (2000 – 2009) passen gut zur Einschätzung anderer Autoren, die einen Anstieg erwarten und das Maximum erst in den Jahren 2010 bis 2020 vorhersehen (Hieckel u. Hering 2010; Hagemeyer et al. 2006).
Pathologisch-anatomische Befunde
Plaques – Pleuraasbestose
Bei 90 % der Patienten mit einer asbestassoziierten Berufserkrankung, also der überwiegenden Mehrheit, konnten durch die Sektion asbesttypische hyaline Plaques sichergestellt werden. Bei 13 Patienten (6 %) handelte es sich um eine reine Pleuraasbestose ohne Verbindung zu einer Lungenasbestose oder einer Tumorerkrankung. 97 % der Patienten mit einer Asbestose wiesen Plaques auf, bei den asbestassoziierten Lungentumoren fanden sich in 94 % der Fälle auch Plaques und Mesotheliome waren zu 70 % mit Plaques assoziiert. Der niedrigere Anteil von Plaques in der Gruppe der Mesotheliome korreliert mit den Ergebnissen anderer Studien. Im Deutschen Mesotheliomregister wurden zwischen 1989 und 2009 bei 42 % der Mesotheliomdiagnosen auch Plaques dokumentiert (Neumann et al. 2011), in einer amerikanischen Langzeitstudie lag die Quote der Plaques beim Mesotheliom bei 54 % (Roggli u. Vollmer 2008) und in einer japanischen Untersuchung waren 35 % der Mesotheliome mit Plaques assoziiert (Kato et al. 2016). Möglicherweise wird der Plaquestatus beim Mesotheliom unterschätzt, wenn das Mesotheliom die Plaques überwächst. Oder sie werden im Befund nicht erwähnt, weil die bösartige Tumorerkrankung im Vordergrund steht. Oder sie werden nicht als solche erkannt, weil sie makroskopisch für Tumorabsiedlungen gehalten werden. Eine andere Erklärung wäre, dass das Mesotheliom an sich schon als Signaltumor für eine asbestassoziierte Erkrankung gilt und somit benigne Plaques im Zusammenhang mit einem Mesotheliom keine Bedeutung haben, während Fibrosen ätiologisch vieldeutig sind und radiologisch erst über den Plaquestatus oder histologisch über den Nachweis von Asbestkörpern im Lungengewebe einer asbestassoziierten Erkrankung zugeordnet werden können. Ebenso dienen Plaques beim Lungentumor als Brückenbefund. Ein Lungentumor ohne Plaques oder Asbestose kann bei fehlender Arbeitsanamnese nicht als asbestassoziiert angesehen werden. Daher treten Plaques überdurchschnittlich häufig im Zusammenhang mit Asbestosen oder asbestassoziierten Lungentumoren auf.
Andere benigne Pleuraveränderungen, die im Zusammenhang mit Asbest auftreten können, wie die Pleuraverschwartung nach Pleuritis, strangförmige Verwachsungen der Pleurablätter, die diffuse Pleurafibrose, Rollatelektasen und die Hyalinosis complicata werden nicht als unbedingt asbestspezifisch eingestuft. Sie können auch Folge von Infektionen, Traumata oder Tumorerkrankungen sein (Brockmann 1991). So traten diese Veränderungen in beiden Kollektiven der asbestabhängigen Berufserkrankungen und den asbestunabhängigen Erkrankungen zu gleichen Anteilen auf.
Lungenfibrose
Im Gesamtkollektiv der im Sektionsgutachten zur Anerkennung empfohlenen Berufskrankheiten nach BK 4103 – 4105 fanden sich 84 Patienten (40 %) mit einer Lungenasbestose, wobei es sich mit 81 % überwiegend um eine Asbestose Grad I also mit nur geringer Ausprägung vom Typ einer Minimalasbestose handelte. Diese Beobachtung, dass die Schwere der Asbestoseerkrankung abnimmt, wird auch von anderen Autoren geteilt. In einer finnischen Studie aus dem Jahr 2010 wurde bei ehemaligen Asbestarbeitern mittels HRCT eine Asbestose diagnostiziert. In 76 % der Fälle war die Fibrose nur gering ausgeprägt (Vierikko et al. 2010). Dies lässt sich sicher auf den seit 1979 reduzierten Asbestverbrauch sowie das seit 1993 bestehende absolute Asbestverwendungsverbot zurückführen. Der Rückgang der höhergradigen Asbestosen geht einher mit einer längeren Latenzzeit bis zur Diagnose der Erkrankung und erklärt auch das bessere Überleben dieser Patientengruppe.
Primärtumor
Lungenkrebs: Asbestassoziierte Erkrankungen wie Plaques und die Asbestose manifestieren sich betont im Unterlappenbereich. Für asbestassoziierte Lungentumoren wird dies ebenfalls in der Literatur beschrieben (Brockmann 1991; Weiss 2000). Unter asbestexponierten Patienten war zu 61,5 % der Unterlappen betroffen, während unter nichtasbestexponierten Patienten zu 74,6 % der Tumor im Oberlappen entstanden war (Karjalainen et al. 1993). In dieser Arbeit hingegen ergaben sich keine signifikanten Unterschiede zwischen der Gruppe der asbestassoziierten Lungentumoren und den nichtasbestassoziierten Lungentumoren (p 0,05). Die Ergebnisse entsprechen eher der allgemeinen Statistik für Lungentumoren, wonach diese bevorzugt im Oberlappen auftreten. Möglicherweise geht diese Entwicklung einher mit dem geringeren Schweregrad der assoziierten Asbestosen.
Im Hinblick auf die histologischen Subtypen ergeben sich ebenfalls keine Unterschiede zwischen den beiden Gruppen mit Lungentumoren. Dies entspricht auch den Ergebnissen anderer Autoren (Roggli u. Vollmer 2008; Marten 2001). Ein Zusammenhang zwischen Asbest und der Induktion eines bestimmten histologischen Subtyps lässt sich somit nicht ableiten. Auch ließ sich kein Unterschied im Ausbreitungs- und Metastasierungsmuster feststellen.
Mesotheliom: Im Einklang mit den Ergebnissen anderer Autoren (Roggli u. Vollmer 2008; Neumann et al. 2011) wurden auch in dieser Arbeit größtenteils Pleuramesotheliome mit überwiegend epitheloiden Subtypen (49 %) gefunden und nur ein kleiner Prozentsatz hatte den Ursprung im Bauchraum (12 %). Zum Zeitpunkt der Sektion zeigten die Mesotheliome bereits eine fortgeschrittene Ausbreitung, bei einer mittleren Überlebenszeit von nur 6,5 Monaten. Das Mesotheliom war also zum Zeitpunkt der Erstdiagnose bereits sehr groß oder es ist in nur wenigen Monaten sehr gewachsen. Fernmetastasen betrafen vor allem Lymphknoten, Knochen, das Peritoneum und die Lungen. Im Vergleich zu asbestassoziierten Lungentumoren metastasierte das Mesotheliom häufiger ins Peritoneum, Herz und Zwerchfell, während Absiedlungen von Lungentumoren häufiger in Lunge, Leber, Nebennieren, Gehirn und Niere gefunden wurden. Typische klinische Beschwerden der Mesotheliomerkrankung sind Atemnot, Thorax Schmerzen und symptomatische Pleuraergüsse (Moore et al. 2008). Dies spiegelt sich auch im untersuchten Kollektiv wider. 59 % der Patienten hatten zu Lebzeiten einen Pleuraerguss, 66 % litten unter Atemnot und 25 % klagten über Brustschmerzen.
Radiologische Befunde vs. Sektionsdiagnosen
Die ermittelten Sensitivitäten und Spezifitäten für die Röntgen- und CT-Diagnostik gemessen am Sektionsergebnis haben sich im Vergleich zu vorangegangenen Arbeiten verschlechtert ( Tabelle 9 ). Zu bedenken ist allerdings, dass im untersuchten Kollektiv überwiegend geringgradige Asbestosen vorhanden waren, die sich der radiologischen Diagnostik entziehen können. Dies gilt sowohl für die konventionelle Röntgentechnik als auch für die Computertomographie.
In speziellen radiologischen Arbeiten werden zwar hohe Sensitivitäten von 97 % und Spezifitäten von 100 % für das HRCT beschrieben (Friedmann et al. 1988; Clarke et al. 2006; Hieckel u. Hering 2010; Miller et al. 2013; Terra-Filho et al. 2015), im Gegensatz dazu kommen aber Arbeiten, die die radiologischen Befunde aus der klinischen Routinediagnostik auswerten, ebenfalls zu einer hohen Dunkelziffer für asbestbedingte Veränderungen. In der radiologischen Übersichtsaufnahme werden 10 – 18 % der Asbestosen und mindestens 10 % pleuraler Veränderungen übersehen (Roggli et al. 2010), nach anderen Arbeiten sogar bis zu 60 % der Plaques (Neumann et al. 2009).
Schwierigkeiten ergeben sich auch bei der Differenzierung von benignen und malignen Pleuraveränderungen. Hier lag die Spezifität bei 90 %, die Sensitivität bei 80 % bzw. 87 %. Für das Mesotheliom werden in der Literatur Spezifitäten zwischen 88 % und 100 % gefunden, die Sensitivität wird aber nur mit 36 % bis 56 % angegeben (Benamore et al. 2005). Auch retrospektiv konnten in CT-Aufnahmen von Patienten, die an einem Mesotheliom verstorben waren in 18 % der untersuchten Fälle keine Auffälligkeiten der Pleura entdeckt werden (Kato et al. 2016). Demgegenüber wurden in dieser Arbeit der radiologisch ausgesprochene Mesotheliomverdacht zu 75 % bzw. 88 % bestätigt. Für eine definitive Diagnose ist daher die histologische Abklärung erforderlich.
Ausgewertet wurden radiologische Befunde, die im Rahmen der klinischen Diagnostik erhoben worden sind, ohne spezielles Augenmerk auf asbestbedingte Veränderungen. Die Reevaluation der radiologischen Aufnahmen durch einen erfahrenen radiologischen Gutachter hätte sicherlich zu besseren Übereinstimmungen der bildgebenden Diagnostik mit den Sektionsbefunden führen können. So wurde zum Beispiel im Röntgenbefund eine „verbreiterte Pleura“ beschrieben, ohne diese als Plaque zu benennen. In dieser Arbeit wurde so eine Beschreibung nicht als positiv für Plaques gewertet, obwohl ein in der Beurteilung asbestassoziierter Veränderungen erfahrener Radiologe dies anhand einer eigenen Bewertung der Bilder vielleicht getan hätte. Auch entsprachen die CT-Aufnahmen nicht der Qualität eines HRCT nach der Falkensteiner Empfehlung, da sie im Rahmen des Tumorstagings angefertigt worden sind. Eine Wiederholung der CT-Diagnostik war oft aufgrund der vorgeschrittenen Tumorerkrankung nicht zumutbar oder der Patient ist vorher verstorben und wurde stattdessen obduziert. Daher gibt es im untersuchten Kollektiv wahrscheinlich einen Überhang mit nicht ausreichender radiologischer Diagnostik, was die schlechten Ergebnisse erklären könnte. Die verbesserte radiologische Diagnostik könnte auch die Abnahme der Sensitivität und Spezifität im Vergleich zu früheren Arbeiten erklären. Versicherte, bei denen der radiologische Befund bereits eindeutig ist, werden nur noch obduziert, wenn die genaue Todesursache zu klären ist. In dieser Arbeit lag daher möglicherweise eine Verzerrung der radiologischen Diagnostik vor. Festzuhalten bleibt, dass die Auswertung radiologischer Aufnahmen einem in der Bewertung asbestassoziierter Veränderungen besonders erfahrenen Radiologen vorbehalten bleiben sollte (Alfudhili et al. 2016; Rehbock et al. 2012).
Fazit und Prognose
Bestimmte asbesttypische Befunde sind klinisch nicht feststellbar. Hierzu gehören die röntgenologisch nicht sichtbare Minimalasbestose oder kleine, sich der Computertomographie entziehende Pleuraplaques. Zusätzlich problematisch ist, dass diese Befunde einen asymptomatischen Verlauf vorweisen und in der Regel keinen Einfluss auf die Lungenfunktion haben (Roberts et al. 2009; Clin et al. 2011). Oftmals kann nur die pathologisch-anatomische Untersuchung derartige Befunde erfassen und so den Bezug zu einer beruflichen Asbestexposition herstellen.
Sowohl die Ergebnisse des untersuchten Kollektivs als auch die epidemiologischen Daten aus Deutschland zeigen, dass die Zahl der angezeigten asbestassoziierten Berufserkrankungen in den letzten 10 Jahren weiter zugenommen hat, wobei die Tumorleiden weiter ansteigen, während die Zahl der Asbestosen stagnieren.
Eine prophylaktische Therapie zur Vermeidung einer Erkrankung nach erfolgter Asbestexposition gibt es nicht (Roberts et al. 2009). Auch lässt sich keine Hochrisikogruppe identifizieren. Trotz des Asbestverwendungsverbotes in Europa und strenger Arbeitsschutz Auflagen bei Altlastensanierungen ist mit einem Fortbestehen der Asbestproblematik zu rechnen, solange ein weltweites Asbestverbot fehlt (Kameda et al. 2014).
Literatur
Adib G, Labrèche F, De Guire L et al: Short, fine and WHO asbestos fibers in the lungs of quebec workers with an asbestos-related disease. Am J Ind Med 2013; 56: 1001–1014.
Alfudhili KM, Lynch DA, Laurent F, Ferretti GR et al.: Focal pleural thickening mimicking pleural plaques on chest computed tomography: tips and tricks. Br J Radiol 2016; 89: 20150792.
Benamore RE, O’Doherty MJ, Entwisle JJ: Use of imaging in the management of malignant pleural mesothelioma. Clin Radiol 2005; 60: 1237–1247.
Bohlig H, Dabbert AF, Dalquen P, Hain E, Hinz I: Epidemiology of malignant mesothelioma in Hamburg. Environ Res 1970; 3: 365–372.
Brockmann M: Asbestassoziierte Lungen- und Pleuraerkrankungen – Pathologische Anatomie. Pneumologie 1991; 45: 422–428.
Clarke C, Mowat F, Kelsh M, Roberts M: Pleural plaques: a review of diagnostic issues and possible nonasbestos factors. Arch Environ Occup Health 2006; 61: 183–192.
Clin B, Paris C, Ameille J et al.: Do asbestos-related pleural plaques on HRCT scans cause restrictive impairment in the absence of pulmonary fibrosis? Thorax 2011; 66: 985–991.
Coenen W: Asbest: Risikoermittlung und Präventionsansätze. Festschrift „25 Jahre ZAs 1972–1997 – Bilanz und Perspektiven“. DGUV & BG ETEM, 1997.
Deutsche Gesetzliche Unfallversicherung (DGUV): BK-Report 1/2013: Faserjahre. 2013.
Diagnostik und Begutachtung asbestbedingter Berufskrankheiten. Interdisziplinäre S2-Leitlinie der Deutschen Gesellschaft für Pneumologie und Beatmungsmedizin und der Deutschen Gesellschaft für Arbeitsmedizin und Umweltmedizin. AWMF Registernummer 002–038.
Dirksen M: Asbestbedingte Berufserkrankungen sowie Asbestbelastung der Allgemeinbevölkerung im Hamburger Raum. Med. Dissertation. Universität Hamburg, 1989.
Falkensteiner Empfehlung – Empfehlung zur Diagnostik und Begutachtung Asbeststaub bedingter Lungenerkrankungen. Deutsche Gesetzliche Unfallversicherung (DGUV), 2011.
Friedmann AC, Fiel SB, Fisher MS et al.: Asbestos-related pleural disease and asbestosis: a comparison of CT and chest radiography. AJR 1988; 150: 269–275.
Hagemeyer O, Otten H, Kraus T: Asbestos consumption, asbestos exposure and asbestos-related occupational diseases in Germany. Int Arch Occup Environ Health 2006; 76: 613–620.
Hain E, Dalquen P: Katamnestische Untersuchungen zur Genese des Mesothelioms. Bericht üer 150 Fälle aus dem Hamburger Raum. Int Arch Arbeitsmed 1974; 33: 15–37.
Henderson D, Rantanen J, Barnhart S et al.: Helsinki criteria Asbestos, asbestosis and cancer. The Helsinki criteria for diagnosis and attribution. Scan J Work Environ Health 1997; 23: 311–316.
Henderson D, Rödelsperger K, Woitowitz HJ, Leigh J: After Helsinki: a multidisciplinary review of the relationship between asbestos exposure and lung cancer, with emphasis on studies published during 1997–2004. Pathology 2004; 36: 517–550.
Hieckel H, Hering K: Asbestverursachte Veränderungen am Thorax. Radiologe 2010; 50: 623–634.
Husain AN, Colby T, Ordonez N et al.: Guidelines for pathologic diagnosis of malignant mesothelioma: 2012 update of the consensus statement from the International Mesothelioma Interest Group. Arch Pathol Lab Med. 2013;137: 647–667.
Internationale Vereinigung der Sozialen Sicherheit(IVSS): Asbest: Auf dem Weg zu einem weltweiten Verbot. Genf: in Eigendruck, 2006.
Kameda T, Takahashi K, Kim R et al.: Asbestos: use, bans and disease burden in Europe. Bulletin of the World Health Organization 2014; 92: 790–797.
Karjalainen A, Anttila S, Heikkilä L, Kyyrönen P, Vainio H: Lobe of origin of lung cancer among asbestos-exposed patients with or without diffuse interstitial fibrosis. Scand J Work Environ Health 1993; 19: 102–107.
Kato K, Gemba K, Fujimoto N et al.: Fatal pleural mesothelioma in Japan (2003–2008): evaluation of computed tomography findings. Jpn J Radiol 2016; 34: 432–438.
Lynch JP, Huynh RH, Fishbein MC et al.: Idiopathic pulmonary fibrosis: epidemiology, clinical features, prognosis, and management. Semin Respir Crit Care Med 2016; 37: 331–357.
Marten M: Asbestbedingte Erkrankungen im Hamburger Raum in den Jahren 1988 bis 1999. Med. Dissertation. Universität Hamburg, 2001.
Marten M, Schulz F, Hildebrand E, Püschel K: Asbestbedingte Erkrankungen im Hamburger Raum in den Jahren 1988 bis 1999. Arbeitsmed Sozialmed Umweltmed 2002; 37: 76–82.
Mehrtens G, Valentin H, Schönberger A: Arbeitsunfall und Berufskrankheit: Rechtliche und Medizinische Grundlagen für Gutachter, Sozialverwaltung, Berater und Gerichte. 6. Aufl. Berlin: Erich Schmidt, 1998.
Miller A, Widman SA, Miller JA et al.: Comparison of x-ray films and low-dose computed tomographic scans: demonstration of asbestos-related changes in 2760 nuclear weapons workers screened for lung cancer. J Occup Environ Med 2013; 55: 741–745.
Moore A, Parker R, Wiggins J: Malignant mesothelioma. Orphanet J Rare Dis 2008; 3: 34.
Neumann V, Kraus T, Fischer M et al.: Wertigkeit von pathologisch-anatomischen und staubanalytischen Untersuchungen bei asbestassoziierten Berufskrankheiten am Beispiel der BK 4104. Pneumologie 2009; 63: 588–593.
Neumann V, Löseke S, Tannapfel A: Mesothelioma and analysis of tissue fiber content. Recent Results Cancer Res 2011; 189: 79–95.
Püschel K, Marten M, Dirksen M et al.: Asbest-Screening im Autopsie-Material. Beitr Gerichtl Med 1988; 47: 503–507.
Rehbock B, Hofmann-Preiß K, Kraus T: Pitfalls in diagnostic imaging and assessment of benign asbestos-related thoracic diseases. Rofo 2012; 184: 412–419.
Roberts H, Patsois D, Paul N et al.: Screening for malignant pleural mesothelioma and lung cancer in individuals with a history of asbestos exposure. J Thorac Oncol 2009; 4: 620–628.
Roggli VL, Sporn TA: Carcinoma of the lung in the absence of asbestosis: The value of lung fiber burden analysis. Ultrastruct Pathol 2016; 40: 151–154.
Roggli VL, Gibbs AR, Attanoos R et al.: Pathology of asbestosis – an update of the diagnostic criteria. Report of the Asbestosis Committee of the College of American Pathologists and Pulmonary Pathology Society. Arch Pathol Lab Med 2010; 134: 420–434.
Roggli VL, Vollmer RT: Twenty-five years of fiber analysis: what have we learned? Human Pathology 2008; 39: 307–315.
Schneider J, Rödelsperger K, Pohlabeln H, Woitowitz H: Umwelt- und Innenraum-Gefährdung durch Asbestfaserstaub als Risiko- und Einflussfaktor des diffusen malignen Pleuramesothelioms (DMM). Zentralbl Hyg Umweltmed 1996; 1–23.
Terra-Filho M, Bagatin E, Nery LE et al.: Screening of miners and millers at decreasing levels of asbestos exposure: comparison of chest radiography and thin-section computed tomography. PLoS ONE 2015; 10: e0118585.
Tischoff I, Neid M, Neumann V, Tannapfel A: Pathohistological diagnosis and differential diagnosis. Recent Results Cancer Res 2011; 189: 57–78.
Vierikko T1, Järvenpää R, Toivio P et al.: Clinical and HRCT screening of heavily asbestos-exposed workers. Int Arch Occup Environ Health 2010; 83: 47–54.
Yusa T, Hiroshima K, Sakai F et al.: Significant relationship between the extent of pleural plaques and pulmonary asbestos body concentration in lung cancer patients with occupational asbestos exposure. Am J Ind Med 2015; 58: 444–455.
Weiss W: Asbestosis and lobar sites of lung cancer. Occup Environ Med 2000; 57: 358–360.
Wolff H, Vehmas T, Oksa P et al.: Asbestos, asbestosis, and cancer, the Helsinki criteria for diagnosis and attribution 2014: recommendations. Scand J Work Environ Health 2015; 41: 5–15.
Interessenkonflikt: F. Schulz, U. Lockemann, K. Püschel erstellen Gutachten für Berufsgenossenschaften und Sozialgerichte, A. Theile, A. Tannapfel erstellen fachpathologische Stellungnahmen für Berufsgenossenschaften und Sozialgerichte. Das Deutsche Mesotheliomregister erhält Drittmittel der DGUV. I.S. Feder ist wissenschaftliche Mitarbeiterin im Deutschen Mesotheliomregister und A.-S.C. Stühmer gibt an, dass kein Interessenkonflikt besteht.
Für die Verfasser
Prof. Dr. med. K. Püschel
Institut für Rechtsmedizin
Universitätsklinikum Hamburg-Eppendorf
Butenfeld 34
22529 Hamburg
Fußnoten
1 Universitätsklinikum Hamburg-Eppendorf, Institut für Rechtsmedizin (Direktor: Prof. Dr. med. Klaus Püschel)
2 Georgius Agricola Stiftung Ruhr, Ruhr-Universität Bochum an den BG Universitätskliniken Bergmannsheil, Deutsches Mesotheliomregister, Institut für Pathologie (Direktorin: Prof. Dr. med. Andrea Tannapfel)