Tiermodell zur Bestimmung der Asthma-Auslöseschwelle von Diisocyanaten und seine Relevanz für die Ableitung von Arbeitsplatzgrenzwerten
Die Ätiopathologie des Isocyanatasthmas geht mit komplexen Expositionsvariablen wie Dosis, Expositionspfad und Isocyanatcharakteristik (flüssig, fest, flüchtig) einher. Epidemiologische Studien und Arbeitsplatzanalysen sind nur bedingt geeignet, diese Komplexität so aufzulösen, dass hieraus definierte Grenzwerte für den Arbeitsplatz abgeleitet werden könnten. Das Brown-Norway-Rattenmodell ermöglicht die Ableitung relevanter Schwellendosen sowohl für die Atemtraktreizung wie auch für die Asthmaauslösung nach Sensibilisierung über die Haut, gefolgt von wiederholten inhalativen Booster-Expositionen. Die an den aromatischen Diisocyanaten MDI (4,4‘-Methylendiphenyldiisocyanat, Aerosol) und TDI (80:20-Gemisch aus 2,4-Toluylendiisocyanat und 2,6-Toluylendiisocyanat, Dampf) aufgezeigten Zusammenhänge verdeutlichen, dass asthmaähnliche Reaktionen nach Bronchoprovokation als Folge einer sowohl epikutanen wie auch inhalativen Sensibilisierung auftreten können. Die prominentesten asthmaähnlichen Reaktionen traten zweifelsfrei nach Sensibilisierung über die Haut auf. Gleichwohl belegen diese Studien, dass kryptische Hautexpositionen das Isocyanatasthma potenziell prädisponieren. Das klinisch manifeste Isocyanatasthma entsteht jedoch erst durch zusätzliche und wiederholt hohe Inhalationsexpositionen. Die an der Ratte abgeleiteten Schwellenkonzentrationen für die Atemtraktreizung entsprechen de facto den heute gültigen Arbeitsplatzgrenzwerten dieser Isocyanate. Bei der Asthmaauslösung liegt ein offensichtlicher Zusammenhang von akuter Atemtraktreizung und Stärke der Asthmareaktion vor. Diese Konvergenz belegt die arbeitsmedizinische Relevanz dieses Tiermodells für die Arbeitsplatzsicherheit und Grenzwertableitung.
Animal model for the determination of the elicitation threshold of diisocyanate asthma and its relevance for the derivation of occupational exposure levels
The etiopathology of the isocyanate asthma is complex and may result from equitably complex past exposures from both dermal and inhalation routes. Epidemiological evidence of asthma prevalence and workplace exposures has limitations in regard to the interrelationship of the exposure dose, route and characteristics of the isocyanate involved. Accordingly, it is doubted that its resolution is sufficient for the derivation of workplace standards. The relationship of asthma-like reactions following specific bronchoprovocation challenge with the aromatic diisocyanates MDI (4.4‘-methylene diphenyl diisocyanate, aerosol) and TDI (80:20 mixture of 2.4-toluene diisocyanate and 2.6-toluene diisocyanate, vapour) demonstrate that such response may occur following sensitization via the skin or through inhalation. The Brown-Norway rat model provides a means of deriving threshold levels for both respiratory tract irritation and the elicitation of asthma after skin sensitization followed by repeated inhalation booster-exposures. The most prominent asthma-like exacerbations occurred after epicutaneous sensitization. Likewise, these studies appear to suggest that past sensitizing skin encounters with isocyanates are likely to be causative of predisposition to isocyanate asthma when followed by recurrent high-level inhalation exposures. The derived threshold for respiratory tract irritation matches favourably with the current workplace standards of the isocyanates examined. This similarity demonstrates the relevance of this animal model for occupational medicine and safe workplace exposure limits.
Einleitung
Die Reaktivität und Toxizität der wirtschaftlich bedeutsamsten Diisocyanate werden durch das gemeinsame Merkmal Diisocyanat-Funktionalität „O=C=N-R-N=C=O“ charakterisiert. Die Elektrophilie der Kohlenstoffatome der Isocyanatgruppen begünstigt die Reaktion mit nukleophilen Strukturen, wie z. B. -OH, -SH oder -NH2. In Abhängigkeit von der Größe (Monomer, Oligomer, Homopolymer, Polymer) und weiteren chemischen Eigenschaften der Basisstruktur (R: alkyl oder aromatisch) kann sich die Chemie der Isocyanate hochselektiv darstellen. Isocyanate können bei Raumtemperatur dampfförmig, flüssig oder fest vorliegen, woraus unterschiedliche, zum Teil auch phasenspezifische, Expositionsintensitäten innerhalb des Respirationstrakts entstehen. Isocyanate mit nur einer funktionellen Gruppe (Monoisocyanate) werden vornehmlich als Zwischenprodukt bei chemischen Synthesen eingesetzt. Di- oder polyfunktionelle Isocyanate sind Ausgangsstoffe bei der Herstellung von Polymeren (z. B. Polyurethanen) und besitzen als Polyurethan-(PUR)-Verbindungen mit Einsatz als PUR-Harze, -Lacke, -Schaumstoffe und -Klebstoffe große technische Bedeutung. Als Folge ihrer (gewünschten) Reaktionsfreudigkeit gegenüber nukleophilen Reaktionspartnern können Isocyanate auch mit nukleophilen Molekülfunktionalitäten im biologischen System (ab)reagieren. Hier geschieht dies immer in Konkurrenz mit den ubiquitär vorhandenen Nukleophilen wie Wasser und den darin gelösten Peptiden und Proteinen. Diese Eigenschaft begrenzt die Wirkung der Isocyanate auf den Ort des ersten Kontakts mit dem biologischen System, d. h. Haut, Augen und/oder Atemtrakt. In Abhängigkeit von der Dosis und der Empfindlichkeit der jeweiligen Kontaktlokalisation stellt sich dies dann als eine durch Irritation verursachte Entzündung in Folge lokaler Proteindenaturierung bzw. Zerstörung von Membranstrukturen dar. Die Toxizität der Isocyanate ist somit auch von den am Kontaktort vorherrschenden Konkurrenzreaktionen mit niedermolekularen Nukleophilen wie Wasser oder Glutathion geprägt. Das biologische System muss ausreichend hohen Dosisraten ausgesetzt werden, um die Pufferkapazität von homeostatischen Gleichgewichten zu überschreiten. Entsprechend stellt sich die Toxizität dieser Substanzklasse in kontrollierten tierexperimentellen Studien schwellendosisabhängig dar. Es kann a priori nicht ausgeschlossen werden, dass die im subirritativen Bereich gebildeten Proteinaddukte antigene Eigenschaften aufweisen, was bei Reexposition die Ausbildung allergischen Asthmas begünstigen würde. Diese Differenzierung verlangt dem Toxikologen komplexe Prüfstrategien ab, und zwar sowohl hinsichtlich lokaler irritativ-entzündlicher Veränderungen und nachfolgenden immunologischen Reaktionen.
Generell gilt, dass die sensibilisierende Wirkung an der Haut im Sinne einer allergischen Kontaktdermatitis arbeitsmedizinisch von relativ geringer Bedeutung ist, jene am Respirationstrakt steht im Vordergrund (Isocyanatasthma). Sensibilisierungen entstanden, wenn die Exposition am Arbeitsplatz regelmäßig über den heutigen Grenzwerten lag oder nach nur wenigen besonders hohen Expositionen. Es wurden auch Erkrankungsfälle beschrieben, bei denen eine Exposition messtechnisch nicht nachweisbar war. In den letzten Jahren sind Diisocyanate in den Industrieländern zu einer der Hauptursachen berufsbedingter obstruktiver Atemwegserkrankungen geworden (Baur et al. 2003; Baur 2007; Barbinova u. Baur 2006; Lemière et al. 2000, 2002).
Ziel der Untersuchungen
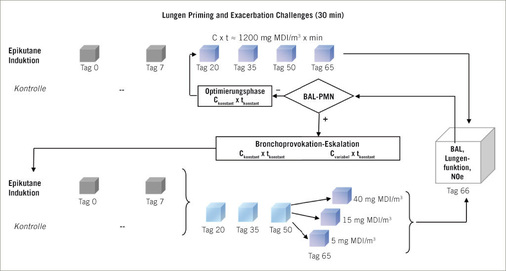
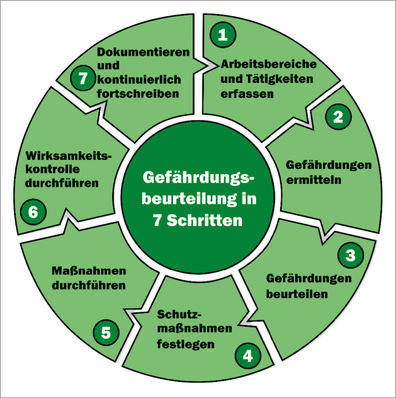
Diese Abhandlung stellt tierexperimentelle Versuchsanordnungen vor, die geeignet sind, sowohl das Potenzial als auch die Potenz der Isocyanat-induzierten Lungensensibilisierung quantitativ im Brown-Norway-Rattenmodell zu beschreiben. Dieses Modell orientiert sich an den in der Arbeitsmedizin ermittelten Zielparametern, die sich in Tiermodellen allerdings nur als rattenspezifische Surrogatendpunkte darstellen lassen. In diesem Tiermodell werden Ratten zunächst durch Hautexposition sensibilisiert. Die asthmatypische bronchiale Atemwegserkrankung wird mittels vier Inhalationsexpositionen im Abstand von 2 Wochen erzeugt. Die Auslöseschwellendosis, definiert als Produkt aus spezifischer Provokationskonzentration (C) und Provokationsdauer (t) wird im Bronchoprovokationstest ermittelt. Die Kombination von Sensibilisierung an der Haut und Auslösung am Respirationstrakt ermöglicht maximierte Sensibiliserungsbedingungen, ohne dabei eine reizinduzierte Entzündung im Respirationstrakt auszulösen.
Der Bewertung liegen die für das Isocyanatasthma typischen verzögert auftretenden Lungenfunktionsveränderungen und eine durch bronchoalveoläre Lavage nachgewiesene Erhöhung an neutrophilen Granulozyten zugrunde. Diese Untersuchungen haben zum Ziel, die Schwellendosis für die Auslösung asthmatypischer Veränderungen an dermal-inhalativ sensibilisierten Ratten zu ermitteln und ob die unter diesen modifizierten Bedingungen ermittelten Schwellendosen, nach speziesspezifischer dosimetrischer Adjustierung, mit bestehenden Arbeitsplatzgrenzwerten konvergieren. Mit Hilfe der beschriebenen Modelle lassen sich kausale Zusammenhänge hinsichtlich primär atemtraktreizender wie auch atemtraktsensibilisierender (Auslösung) Effekte objektiv erfassen und können somit einen wichtigen Beitrag für weitere arbeitsmedizinische Betrachtungen leisten.
Regulatorisches Umfeld
Die regulatorisch geforderte Risikobeurteilung des Arbeitsplatzes und damit auch die des Isocyanat-Asthmas schließen Expositionshistorien, Biomonitoringdaten und Ergebnisse aus Case Reports sowie epidemiologischer Studien ein. Letzteren wurde unter REACH (Registration, Evaluation, Authorisation, and Restriction of Chemicals 2006) ein besonderer Stellenwert eingeräumt, da für diesen Endpunkt noch keine allgemein harmonisierten und akzeptierten in vitro oder in vivo Testprotokolle vorliegen (ECHA 2008). Nichtsdestoweniger sind Stoffe mit einem solchen Potenzial einer harmonierten Klassifikation und Kennzeichnung zu unterziehen (REACH Artikel 115). „Respiratory sensitizers” werden in den Anhängen I und XI erwähnt. Guidelines für die Evaluierung dieses Potenzials fussen auf allgemein zugänglichen Empfehlungen wie European Council requirements for Classification, Labeling and Packaging of Substances and Mixtures (CLP 2008), REACH Guidance from the European Chemicals Agency (ECHA 2008) und United Nations Globally Harmonized System (GHS 2009).
Fehlende prädiktive Tiermodelle erfordern demzufolge eine Klassifikation bezüglich Gefährdung (Hazard Identification) auf der Basis von Humandaten (HD) unterschiedlichster Provenienz. Definitive Guidelines bezüglich der Wertigkeit solcher Deskriptionen liegen nicht vor. HD beruhen typischerweise auf opportunistischen Observationen und weniger experimentell ermittelten Daten mit der inhärenten Limitation fehlender Expositionsnachweise. Case Reports nehmen Bezug auf unkontrollierte, akzidentelle Überexpositionen, mit der Wahrscheinlichkeit einer Fehlklassifikation. HD reflektieren in der Tat die reale Welt wirklichkeitsnah, jedoch mit großen Unsicherheiten hinsichtlich individueller Hypersuszeptibilität und tatsächlicher Expositionshöhe. Paradoxerweise ist die Stärke der HD auch gleichzeitig ihre Schwäche. Tierexperimentelle Studien folgen demgegenüber streng validierten Standardprotokollen und gewährleisten damit die Integrität von Studiendesign und Interpretation relativ zu definierten Referenzstandards (OECD-Testrichtlinien). Die Interpretation von HD stellt sich oft weitaus komplexer und variabler dar, und zwar sowohl in der Messmetrik wie auch der Variabilität der Humansituation.
Auf Grund des breiten Anwendungsspektrums wächst die Zahl der gegenüber Isocyanaten exponierten Beschäftigten. In Übersichtsarbeiten wird oft der Frage nachgegangen, ob eine aussagekräftige quantitative Risikoabschätzung bezüglich des Isocyanat-Asthmas auf der Grundlage vorliegender epidemiologischer Studien möglich ist (Baur 2007; Baur et al. 2003). Die Autoren resümieren, dass die Risikoquantifizierung durch fehlende individuelle Messungen und zahlreichen analytischen Herausforderungen erschwert wird. Neben der inhalativen Exposition ist die Entwicklung des Isocyanat-Asthmas auch über die dermale Exposition möglich. Baur konkludiert, dass Weiterentwicklungen der Messmethoden zur Luftanalytik und des Biomonitorings geeignet sein sollten die Abschätzung von retrospektiven individuellen Expositionen, unter Berücksichtigung der dermalen Aufnahmewege, zu verbessen. Dieser Einschätzung folgend wurden in dieser Abhandlung eigene Biomonitoringdaten an Ratten (Pauluhn 2002a; Pauluhn u. Lewalter 2002) hinsichtlich dieser Verbesserungspotenziale analysiert.
Dosis-Effekt-Beziehungen und Expositionsnachweis
Arbeitsmedizinische Case-Reports im Kontext mit Isocyanatexpositionen fokussieren sich besonders auf Befunde wie Kontaktdermatitis, Haut und Atemtraktreizungen, Immunreaktionen (Sensibilisierung) und in weniger häufigen Fällen auch auf Hypersensitivitätspneumonitis. Epidemiologische Untersuchungen belegen, dass Diisocyanate eine prominente Rolle beim berufsbedingten Asthma einnehmen (Baur 2007; Bello et al. 2004, 2007; Malo et al. 1999; Vandenplas et al. 1993a,b; 1999). Die im Zusammenhang mit konventionellen epidemiologischen und klinischen Studien deskriptiv ermittelten Expositions-Wirkungs-Informationen lassen auf Grund der bereits genannten inhärenten Limitierungen keine robusten Betrachtungen hinsichtlich der relativen Sensibilisierungspotenz unterschiedlicher Isocyanate zu (Bello et al. 2004). Epidemiologische Studien sind daher nur bedingt geeignet Sensibilisierungpotenziale von niedrig potenten Isocyanaten mit hohem Expositionspotenzial und vice versa zweifelsfrei zu differenzieren.
Der Goldstandard für die differentialdiagnostische Betrachtung des berufsbedingten Isocyanatasthmas stellt der isocyanatspezifische Bronchoprovokationstest dar. Die resultierende bronchiale Hyperreaktivität gegenüber eingeatmeten Isocyanaten ist von zahlreichen Faktoren abhängig. Im Vordergrund steht jedoch die inhalierte Dosis, d. h. das Produkt aus Konzentration x Expositionsdauer (C x t) (Vandenplas et al. 1993a). Toxikologische Prüfstrategien orientieren sich am Vorsorgeprinzip („precautionary principle“), mit dem Ziel, primär atemtraktsensibilisierende Cxt-Expositionen als Startpunkt für das Isocyanatasthma zu vermeiden. Zudem soll festgestellt werden, ob eine quantifizierbare Beziehung der Asthmaauslösung zur Atemtraktreizdosis besteht. Letzterer Endpunkt wird in inhalationstoxikologischen Untersuchungen am Tier (bevorzugt Ratte) quantifiziert und stellt für diese Substanzklasse den empfindlichsten Ausgangpunkt für die Ableitung von Grenzwerten am Arbeitsplatz dar. Im Einklang mit den regulatorischen Vorgaben der EU ist für die Klassifizierung eines Stoffes als Asthmagen (Respiratory Sensitizer) die Asthma-ähnliche klinische Symptomatik entscheidend, unabhängig davon, ob eine immunologische Kausalität nachweisbar ist oder nicht (ECHA 2008).
Die Exposition gegenüber Isocyanaten am Arbeitsplatz findet über den Respirationstrakt oder über die Haut statt. Die potenzielle Gesundheitsgefährdung wird in beiden Fällen durch die Isocyanatreaktivität und lokale Dosis bestimmt. Je nach Höhe der Kontaktdosis und Art des Kontaktortes stellt sich diese Wirkung als Hautreizung oder Reizung von Schleimhäuten der Atemwege dar. In Abhängigkeit von der Molekülgröße nimmt der Dampfdruck ab, so dass niederflüchtige Isocyanate, z. B. polymeres MDI, im Gegensatz zum flüchtigeren TDI, eine Hochdosisuntersuchung nur als Aerosol oder als Flüssigkeit an der Haut zulassen. Die Expositionsdosimetrie an Haut und Respirationstrakt ist nicht trivial. Minimale Hautkontaminationen können eine arbeitstägliche Inhalationsdosis im Bereich des MAK-Wertes wesentlich übersteigen (Bello et al. 2004, 2007). Der Inhalationspfad wurde in der Vergangenheit als die primäre Expositionsroute für die Entstehung der Sensibilisierung und des Isocyanatasthmas betrachtet. Entsprechend haben sich expositionsmindernden Maßnahmen am Arbeitsplatz im Wesentlichen auf diesen Expositionspfad konzentriert. Isocyanat-Luftkonzentrationen am Arbeitsplatz wurden in gleichem Umfang durch umfangreiche Kontrollmaßnahmen und Substitution in Richtung weniger flüchtige Isocyanate reduziert. Trotz alledem sind Fälle von Isocyanatasthma nicht ungewöhnlich in Arbeitsbereichen mit Potenzialen für Hautexposition und in denen inhalative Isocyanatexpositionen sehr niedrig oder nicht nachweisbar waren.
Eine Fülle tierexperimenteller Arbeiten belegt einen offensichtlichen kausalen Zusammenhang von Hautexposition und asthmaauslösende Inhalationsexposition (Pauluhn 2005; 2006; Pauluhn u. Mohr 2005). Obwohl die Relevanz dermaler Expositionen am Arbeitsplatz als initiale Ursache für das Isocyanatasthma zunehmend kritisch diskutiert wird, nimmt die inhalative Exposition in der arbeitsmedizinischen Betrachtung und Bewertung von Arbeitsplätzen immer noch die zentrale Rolle ein. Der Grund hierfür ist sicherlich darin zu suchen, dass die dermale Expositionsintensität sich oft nur deskriptiv darstellen lässt und sich auch über retrospektiv angewendete Biomonitoringverfahren einer quantifizierbaren Deutung entzieht. Demgegenüber lässt die asthmatische Exazerbation (akzidentell oder im Inhalations-Bronchoprovokationstest) eine klare Kausalität und Dosisabhängigkeit zum Inhalationspfad erkennen. Wie im Weiteren ausgeführt, lassen sich retrospektiv beim Isocyanat- asthma quantifizierbare Expositions-Biomarker mit hoher prognostischer und prädiktiver Zuverlässigkeit nur schwer aufzeigen. Gleichwohl haben Hypersensitivitäts-Biomarker wie Lungenfunktionsprüfungen oder die Atemwegsentzündung-integrierende diagnostische Methoden, wie z. B. Zytodifferenzierung von Zellen im induzierten Sputum oder als exhalierte Entzündungsmarker wie Stickstoffmonoxid (NO), an Bedeutung zugenommen (Barbinova u. Baur 2006; Lemière et al. 2002; Vandenplas et al. 1993a,b; 1999)
Systemische Belastungen gegenüber Isocyanaten finden de facto nur in Form von Protein-Konjugaten oder niedermolekularen Peptidaddukten statt, die letztendlich renal eliminiert werden. Hämoglobinaddukte (Hb-A), möglicherweise durch Transcarbamoylierung aus adduktiertem Glutathion entstanden (Day et al. 1996), sind als kumulierende Langzeitexpositionsmarker geeignet. Nach Totalhydrolyse dieser Addukte werden die freigesetzten Amine als die die Gesamtexposition charakterisierenden Biomonitoring-Marker herangezogen. Kontrollierte tierexperimentelle Untersuchungen an Ratten und Hunden mit MDI belegen, dass Hb-A nicht zwangsläufig über den häufig postulierten MDA (Diphenylmethan-4,4‘-amin)-Weg entstehen, da diese auch über MDI-Glutathionaddukte mittels Transcarbamoylierung gebildet werden (Pauluhn et al. 2006). Ratten wurden dermal und inhalativ kontrolliert exponiert und ein Tag post expositionem hinsichtlich MDI-Biomarkern in Blut und Urin (nach Totalhydrolyse) untersucht. Nach inhalativer Exposition lag die Wiederfindungsrate der Urin-Biomarker (kumulierte Urinsammlung über ca. 20 h nach Expositionsende) bei ca. 0,03% und nach epikutaner Exposition in einem Bereich von 0,001–0,01%. Diese Werte erhöhen sich zeitproportional nach dermaler Exposition mit längeren Urin-Sammelperioden über 3 Tage. Bei Applikation von MDA, lag für beide Expositionspfade die Wiederfindungsrate um den Faktor 10- bis 100fach höher. Dieser Befund belegt, dass Biomonitoring-Expositionsmarker infolge hygienischer Maßnahmen falsch-positive Expositionen reflektieren können (Abwaschen der kontaminierten Haut). Die HbA-Biomarker betrugen etwa ein Hundertstel der Urin-Biomarkerdosis (Pauluhn u. Lewalter 2002). Diese Daten stützen die Schlussfolgerung, dass Urin-Biomarker in der Tat eine Reflektion von zeitnahen inhalativen MDI-Expositionen darstellen. Eine verlässliche Rückrechnung auf das tatsächliche Expositionsprofil ist selbst unter kontrollierten und definierten tierexperimentellen Versuchsbedingungen von erheblichen Fehlerbreiten geprägt. Die fortgesetzte renale Elimination von Biomarkern im Urin steht aller Wahrscheinlichkeit nach in einem Kausalzusammenhang mit einer zeitabhängig zunehmenden Bioverfügbarkeit von MDI-konjugierten Proteinen aus exponierten Hautarealen mit Rekonstitution. Eine spezifische Zuordnung bezüglich des Aufnahmepfads ermöglicht diese alle Expositionsrouten integrierende Analysenmethode somit nicht. Systematische Untersuchungen an Ratten stützen diese Schlussfolgerung (die Expositionsdosis-adjustierte Ausbeute von Isocyanatequivalenten im Urin war nach inhalativer Exposition um Größenordnungen höher als nach kutaner Exposition).
Bezüglich der Einschätzung und Bewertung potenziell sensibilisierender Expositionen kann dem Biomonitoring weder eine besondere prognostische noch eine spezifische pathodiagnostische Wertigkeit zugesprochen werden, da sich zeitlich begrenzte, lokale Expositionsprofile mit Hilfe von integrierenden, systemischen Expositionsmarkern nicht hinreichend genau abbilden lassen. Die Analyte aus dem Totalhydrolysat lassen zudem keine Rückschlüsse bezüglich lokal haptenierter Proteine (Allergene) oder aufnahmepfadspezifischen Proteinaddukten zu, da potenzielle Leitstrukturen und renale Ausscheidungskinetiken dieser potenziellen Leitstrukturen weitgehend unbekannt sind. Es ist davon auszugehen, dass die lokal begrenzte akute Sensibilisierung nicht zwangsläufig mit „systemischer Bioverfügbarkeit“ einhergeht, da die „systemische Sensibilisierung“ per se eher in einem ätiopathologischen Zusammenhang mit zirkulierenden aktivierten T-Lymphozyten Effektor-/Memoryzellen steht als mit hydrolysierten Isocyanat-Proteinaddukten im Urin.
Mechanistische Betrachtungen
Kontrollierte Studien an Ratten belegen, dass MDI und TDI nur zu einem sehr geringen Anteil (< 1 %) über die Rattenhaut absorbiert werden. Der Hauptteil der applizierten Dosis verbleibt in den oberen Hautschichten und unterliegt dort proteingebunden oder polymerisiert einer sehr langsamen Clearance (Hoffmann et al. 2010). Die Absorption beschränkt sich aller Wahrscheinlichkeit nach auf Reaktionsprodukten von Proteinen mit Isocanaten. Die menschliche Haut weist im Allgemeinen eine um den Faktor 3 geringere Penetrationsfähigkeit als die Rattenhaut auf (Poet 2000). Das in den oberen Hautschichten abreagierte Isocyanat könnte somit in situ stationär hohe lokale Konzentrationen an haptenierten, potenziell antigenen Proteinen erzeugen.
Residente Alveolarmakrophagen (AM), als Teil des Langerhans-dentritischen-Zellnetzwerks von Haut und Lunge, verhindern überschießende immunologische Entzündungsreaktionen in der Lunge. AM wirken supprimierend auf die dentritischen Zellen der Lunge Antigene zu präsentieren; d. h., der Erhalt der Lungenfunktion wird immunologischen Entzündungsreaktionen übergeordnet (Condon et al. 2011; Holt et al. 1993). Während die Makrophagen in der Haut antigenpräsentierende Eigenschaften aufweisen, inhibieren die Lungenmakrophagen eine T-Lymphozytenaktivierung. Die isocyanattypische Konstellation Irritation und Antigenität könnte somit in der Lunge, im Gegensatz zur Haut, ein Tolerogenese begünstigen. Die Aktivierung dendritischer Zellen mit sich anschließender T-Lymphozytentransformation in den die Haut drainierenden Lymphknoten entstehen dann systemisch zirkulierende aktivierte T-Lymphozyten-Effektor-/Memoryzellen (Condon et al. 2011; Lira 2005). Die Morphologie und Physiologie des Respirationstrakts, wie auch die geringere Dosisrate bei der Einatmung, haben im Vergleich zur Haut deutlich niedrigere Stationärkonzentrationen an Haptenkonjugaten/Antigenen zur Folge. Proteinaddukte (löslich) in der die Lunge auskleidenden Flüssigkeit (Surfactant) werden rasch absorbiert (Eliminationshalbwertszeit aus der Lunge ca. 0,8 Tage; Pauluhn 2011), Isocyanatpolymerisationsprodukte (Präzipitate) werden von AM phagozytiert und dann proteolytisch mit einer Eliminationshalbwertszeit von 1–2 Wochen abgebaut (Pauluhn 2002a, 2011). Der Mensch weist höhere Glutathionkonzentrationen in der Lunge auf als die Ratte (Slade et al. 1993).
Dieser mechanistisch-dosimetrische Exkurs verdeutlicht, dass man bei der Klasse der Isocyanate bezüglich der Atemtraktreizung einen eindeutigen Zusammenhang von Dosis (als Cxt) und Wirkung erwarten kann, vorausgesetzt man bedient sich zeitgemäßer Tiermodelle und Methoden. Einen solchen Zusammenhang für das deutlich komplexere Isocyanatasthma aufzuzeigen ist nur durch simplifizierte Modelle möglich und praktikabel. Dennoch erscheinen die folgenden Schlussfolgerungen wissenschaftlich fundiert und plausibel:
- Eine spezifische Quantifizierung der Hautexposition mit nachfolgender In-situ-Initiierung der „systemischen“ Sensibilisierung erscheint nicht zielführend, da die Metrik der immunologisch effektiven Hautdosis-Wirkungsbeziehung noch kontrovers diskutiert wird.
- Prädiktive Tiermodelle sollten jedoch den epikutanen Initiierungsprozess soweit abbilden, dass der klinisch dormante Zustand einer potenziellen Hypersuszeptibilität simuliert wird.
- Sollte sich das Isocyanatasthma aus der Kombination dermaler Induktion(en) und inhalativen (Re-)Expositionen ausreichend hoher Cxt-Dosen progressiv entwickeln, dann ist nur der pulmonale Prozess einem systematischen Risikomanagement zugänglich.
Maßnahmen zum Hautschutz dürften weitestgehend ausgeschöpft sein, die mögliche unkontrollierbare Ausnahmesituation zu kontrollieren, ist nicht Gegenstand dieser Betrachtung. Das im weiteren experimentellen Teil dargestellte Tiermodell versucht, diese komplexen Zusammenhänge von initiierender epikutaner Exposition und wiederholter inhalativer Exazerbation systemisch zu quantifizieren.
Tiermodell
Tierspezies
Die Brown-Norway-Ratte bildet im Gegensatz zum Meerschweinschen (IgG-mediiert) eine IgE-mediierte allergische Entzündung aus. Nach spezifischer Bronchoprovokation mit Isocyanaten werden Hyperreaktivitätsreaktionen vom Sofort-Typ wie auch vom verzögerten Typ beobachtet. Typisch sind auch unspezifische Atemwegshyperreaktivität gegenüber Metacholin, Acetylcholin oder Serotonin. Allergisch-entzündliche Reaktionen werden in diesem Rattenstamm durch die folgenden Endpunkte charakterisiert: erhöhte Transsudation von Kapillarflüssigkeit in das Lumen der Atemwege, mit vermehrten neutrophilen und eosinophilen Granulozyten sowie Lymphozyten im Lungengewebe bzw. BAL-Flüssigkeit. Das heißt, in diesem Tiermodell stellt sich das Isocyanatasthma als Atemwegsentzündung und weniger als Bronchokonstriktion dar.
Protokoll und Dosisauswahl
Das zur Ermittlung der asthmaauslösenden Wirkung verwendete Rattenmodell ist in Abb.1 schematisch wiedergegeben. Wie bereits ausgeführt, ist davon auszugehen, dass die dermale Exposition aus dosimetrisch-kinetisch-mechanistischer Sicht der wohl effizienteste Expositionspfad eine spezifische T-Lymphozytenaktivierung herbeizuführen (Pauluhn et al. 2005). Es lassen sich an der Haut, im Vergleich zur inhalativen Belastung der Lunge, in kurzer Zeit deutlich höhere Dosen mit wesentlich längerer Kontaktdauer applizieren. Dies wurde anhand von MDI experimentell für drei unterschiedliche Cxt-Produkte mit entweder 10- und 360-minütiger Expositionsdauer empirisch im beschriebenen Rattenmodell nachgewiesen (Pauluhn u. Poole 2011). Bei dosisäquivalenten inhalativen Expositionen erwies sich grundsätzlich das Expositionsmuster mit der kürzesten Expositionsdauer und höchsten Konzentration als am effizientesten, einen asthmaähnlichen Zustand zu provozieren. Die Cxt-überproportionale konzentrationsabhängige Atemtraktreizung beinhaltet Wirkungsverstärkung. Hinsichtlich der Provokationsschwellendosis erforderten alle sensibilisierenden inhalativen Cxt-Produkte deutlich höhere Provokationsdosen als Protokolle mit dermalen Induktionen (Abb.2a, Abb.2b. Das reziproke Verhältnis von Induktions- und Provokationsdosis (Friedmann 2007) erfordert grundsätzlich eine maximierte Induktion, um die Provokationstestung konservativ anlegen zu können. Auf der Basis der mit MDI aufgezeigten Zusammenhänge lässt sich dieses Ziel nur bei dermaler Induktion erreichen. Im ersten Schritt des Modells wird MDI in einem geeigneten Vehikelsystem (Gemisch aus Aceton-Olivenöl) im Abstand von einer Woche an den kontralateralen Hautflanken der Ratte appliziert (Tag 0 und 7). Danach folgt eine 4-malige inhalative Provokation über 30 Minuten im Abstand von jeweils 2 Wochen.
Konzeptionell folgt die Induktions-Provokationssequenz dem in Abb. 1 skizzierten Schema. Durch die erste inhalative Provokation werden durch die dermale Sensibilisierung zirkulierende Effektor-Lymphozyten in der Lunge sequestriert; der Startpunkt für ein lungenspezifisches Isocyanatasthma ist damit gesetzt. Durch wiederholte Booster-Inhalationsexpositionen folgt dann die isocyanatspezifische allergische Entzündung (Asthma), die an Stärke nach jeder weiteren Provokation zunimmt (Abb.3; Pauluhn et al. 2005). Der zeitliche Abstand von 2 Wochen zwischen den Provokationszeitintervallen verhindert eine reizinduzierte Wirkungsverstärkung; d. h., die Reizdosis wird so bemessen, dass nur minimale und rasch reversible Reizstimuli ausgelöst werden (z. B. Nasenausfluss, vorübergehende sensorische Effekte). Die Dosiswahl orientiert sich an etablierten Lungenreizmodellen für die den oberen (URI, upper respiratory tract) und unteren (LRI, lower respiratory tract) Atemtrakt reizende Stoffe (Pauluhn 2000, 2002b, 2004a–c; 2005, 2008). Für Provokationen mit Aerosolen können die eine Alveolitis auslösenden Schwellendosen (URI) mittels BAL und Lungenfunktionsprüfungen (Pauluhn 2004a) im Rattenmodell mit hoher Präzision ermittelt werden. Flüchtige Isocyanate bewirken in diesem Modell eine sensorische Reizung des oberen Respirationstrakts mit einhergehender konzentrationsabhängiger Reflexbradypnoe. In Abb.4 ist die für flüchtige Isocyanate typische Konzentrationsabhängigkeit der Ventilation wiedergegeben; d. h., höhere Konzentrationen haben unterproportional inhalierte Dosen zur Folge. Diesem Umstand wird durch die im Weiteren beschriebenen Adjustierungen Rechnung getragen.
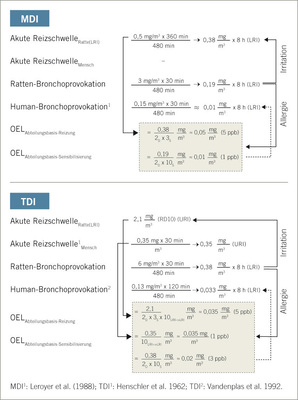
Die im Rattenmodell eingesetzten Expositionskonzentrationen erscheinen aus arbeitsmedizinischer Sicht zunächst irrelevant hoch, da der heute gültige Arbeitsplatzgrenzwert für Isocyanate im Tiermodell offensichtlich um Größenordnungen überschritten wird. Asthma ist eine Erkrankung der peripheren Luftwege. Dieses macht eine Serie von Ratte-zu-Mensch und Vice-versa-Adjustierungen erforderlich: Testaerosole werden für Ratten optimiert. Gleichwohl ist eine speziesspezifische Dosisadjustierung von Nasenatmung-Ratte auf Mundatmung-Mensch (Dosis-Adjustierungsfaktor: x2D) erforderlich. Weitere dosimetrische Adjustierungen entfallen, da die BAL-Methode die für den Menschen relevante periphere Lungenregion repräsentiert (LRI). Die Dosisadjustierung stellt sich bei flüchtigen Isocyanaten deutlich komplexer dar. Das Ausmaß der Penetration des flüchtigen Isocyanats in die periphere Lunge hängt von isocyanatspezifischen Faktoren wie Reaktivität und Wasserlöslichkeit ab; d. h., diese physikochemischen Eigenschaften lassen sich experimentell nicht für Ratten optimieren. Entsprechend der höheren zu berücksichtigen Komplexität ist der die Penetrationstiefe bestimmende Dosis-Adjustierungsfaktor mit x3–10URI–>LRI anzunehmen. Die experimentell ungünstigste Ausgangssituation ist dann gegeben, wenn die LRI mittels URI abzuschätzen ist (x10URI–>LRI). Diese experimentelle Unsicherheit reduziert sich auf x3LRI, wenn die LRI-Schwellendosis empirisch ermittelt wurde. Beim TDI liegen keine adäquaten Studien zur Abschätzung der LRI vor. Diese Unsicherheit wurde durch einen höheren kumulativen Adjustierungsfaktor als beim MDI-Aerosol berücksichtigt (Abb.5).
Inhalative Provokationstests zur arbeitsmedizinischen Differentialdiagnostik des Isocyanatasthmas haben zweifelsfrei eine Cxt-Dosisabhängigkeit belegt (Lemière et al. 2002; Malo et al. 1999). Bei Anwendung der für den Menschen gültigen Provokationsparadigmen ergibt sich für nichtflüchtige Isocyanate hinsichtlich der Atemtraktreizung (LRI) ein Ratten : Mensch-Adjustierungsfaktor von 2D x 3S (hypersuszeptible Humanpopulation gegenüber Atemtraktreizung); d. h., humanäquivalente Rattenexpositionen bezüglich Reizschwellenäquivalenz müssen für wenig flüchtige LRI-Isocyanate (z. B. MDI-Aerosol) mit einer Provokationsschwellendosis von mindestens 2 x 3 x 480 (Arbeitstag-min)/30 (Provokations-Min.) = 96 x MAK-Wert (oder Äquivalent) = 5 mg/m³ x 30 min Anfangsdosis durchgeführt werden. Demgegenüber ergibt sich für flüchtige Isocyanate ein Ratten-zu-Mensch-Adjustierungsfaktor von 2D x 3S x 10URI–>LRI (hypersuszeptible Humanpopulation gegenüber Atemtraktreizung). Bei TDI läge dieser Wert bei 2 x 3 x 10 x 480 (Arbeitstag-min)/30 (Provokations-min) = 960 x MAK-Wert (oder Äquivalent) = 34 mg/m³ x 30 min. Bei den Priming & Booster Provokationen wurden abgestuft höhere Cxt-Produkte eingesetzt, um im Tiermodell einen asthma-ähnlichen Status induzieren zu können. Provokationsdosen im unteren Reizschwellenbereich lassen keine differenzierenden Potenzialbetrachtungen zu, es sei denn, Hypersensitivität beinhaltet eine höhere Empfindlichkeit gegenüber Reiznoxen unterhalb der idealisierten Reiz- bzw. Auslöseschwelle. Diese dosimetrischen Aspekte wurden beim terminalen Bronchoprovokationstest berücksichtigt. Zudem wird am TDI-Beispiel deutlich, dass die Abschätzung der bronchialen Dosisäquivalenz bei Spezies mit Nasen- und Mundatmung eine Herausforderung darstellt.
Neuere Untersuchungen mit flüchtigem TDI lassen die Schlussfolgerung, dass durch Anwendung einer konstanten Provokationskonzentration mit variabler Provokationszeit stabilere Aussagen als bei der zeitkonstanten, konzentrationsabhängigen Provokation erzielen lassen. Hierdurch werden Unsicherheiten hinsichtlich der Konzentrationsabhängigkeit der Penetrationstiefe in die Lunge reduziert. Als Resümee ergibt sich somit ein Provokationsregimen, dass nahezu exakt dem in der arbeitsmedizinischen Diagnostik üblichen spezifischen Provokationsprotokoll entspricht.
Endpunkte und Bewertung
Die höchste pathodiagnostische Empfindlichkeit wiesen die die allergische Entzündungsreaktion integrierenden Endpunkte Lungenfunktion und bronchoalveoläre Lavage (BAL) auf. Serum IgE war in epikutan sensibilisierten Tieren relativ zu nicht sensibilisierten jedoch gleichartig inhalativ provozierten Ratten leicht erhöht (Pauluhn 2005). In sensibilisierten Ratten zeigte sich ein signifikanter Anstieg an exhaliertem NO etwa 20 Stunden nach Provokation. Zytokinmuster wurden in BAL-Zellen und BAL-Flüssigkeit wie auch den die Lunge drainierenden Lymphknoten gemessen (Pauluhn u. Vohr 2006). Ein kongruentes Bild der erfassten pro-inflammatorischen Faktoren in den unterschiedlichen Kompartimenten ergab sich nicht. Mit Capsaicin vorbehandelte Ratten (Inhibition von C-Fasern) ließen sich Hinweise auf eine neuroimmunologische Modulation dieser Faktoren erkennen. Die Analyse proinflammatorischer Faktoren war hinsichtlich ihrer diagnostischen Wertigkeit den Lungenfunktionsprüfungen und besonders der BAL-Analyse deutlich unterlegen.
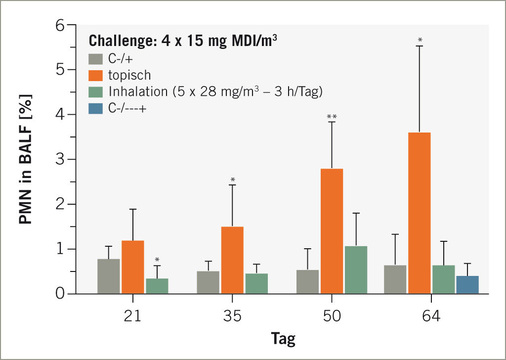
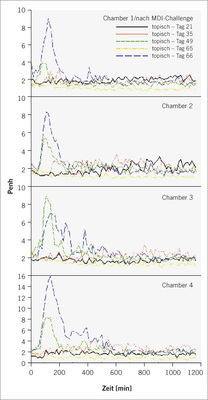
Lungenfunktionsprüfungen erfolgten an spontan atmenden Ratten in barometrischen Ganzkörperplethysmographen über ca. 20 Stunden nach inhalativer Provokation. Der Endpunkt „Penh“ hat kein humanes Korrelat, ermöglicht jedoch die nichtinvasive, kontinuierliche Erfassung der Dauer der Apnoeperiode (Pause zwischen Einatmung und Ausatmung). Damit ermöglicht Penh eine kontinuierliche indirekte Quantifizierung entzündlich-exsudativer Prozesse in der Lunge; Pauluhn 2004a). Penh erwies sich als valider Endpunkt den exakten Zeitpunkt und die Intensität verzögert auftretender Veränderungen der Lungenfunktion nach Provokation zu erfassen. Die Detektion verzögert auftretender, reversibler Atmungsreaktionen stellt ein wesentliches qualitatives Adjunkt zur Abgrenzung von allergischen und irritativen Effekte dar. Biphasische Reaktionen werden ebenfalls detektiert. Das in Abb. 2 wiedergebende Beispiel (MDI) belegt das Auftreten verzögert auftretender, transienter Lungenfunktionsveränderungen, die sich mit zunehmender Anzahl an Provokationen signifikant verstärkten. In Einklang mit der Eingangshypothese wurde nach der ersten Bronchoprovokation keine Reaktion festgestellt. Kontrolltiere wurden nicht dermal sensibilisiert aber den exakt gleichen Provokationsprotokollen unterworfen. Etwa 20 Stunden nach der letzten Provokation erfolgte eine bronchoalveoläre Lavage mit Fokus Zellzahl und Zytodifferenzierung. Neutrophile Granulozyten in der BAL erwiesen sich als differenzierende Leitparameter für die allergische Entzündung.
Die Dosis-Wirkungs-Beziehung im Eskalations-Provokationstest (variable Expositionskonzenrationen von MDI-aerosol über eine konstante Provokationsdauer von 30 Minuten) ist in Abb. 3 für die dermale oder wiederholte inhalative Induktion wiedergegeben. Untersuchungen mit vollständiger Histopathologie des Respirationstrakts belegen eine prominente peribronchiale Zunahme an eosinophilen Granulozyten in der Mukosa bzw. Lamina propria der Atemwege. Diese histologisch nachgewiesene Eosinophilenzunahme ließ sich in der BAL nur angedeutet nachvollziehen. Ein nicht ungewöhnlicher Befund, da durch die BAL-Methode im Wesentlichen nur intraluminale, nicht jedoch die Parenchym-basierenden Entzündungsprozesse beprobt werden.
Diskussion und Schlussfolgerungen
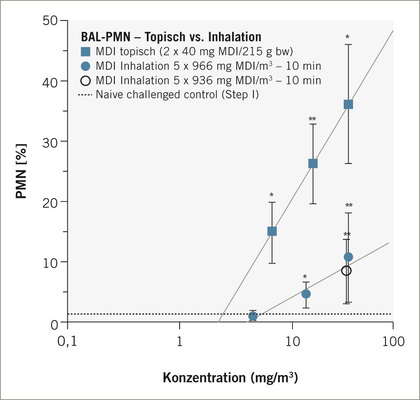
Die Heterogenität des Respirationstrakts wie auch der bronchiale Wirkort des Isocyanatasthmas erfordert klar stratifizierte tierexperimentelle Testprotokolle, um diesen spezifischen Asthmatyp in klinisch relevanter Art und Weise duplizieren und quantifizieren zu können. Eine Kombination aus epikutaner Induktion gefolgt von mehreren Bronchoprovokationen hat sich als konservatives Testprotokoll erwiesen. Der Eskalations-Bronchoprovokationstest an der Ratte, bei adäquater dosimetrischer Adjustierung, ist geeignet wesentliche Phänotypen des beruflichen Isocyanatasthmas sowohl für MDI-Aerosol und TDI-Dampf abzubilden. Die Art der Dosisadjustierung (Produkt aus Konzentration und Provokationsdauer) folgte den Empfehlungen von Leroyer et al.(1998) und Vandenplas et al. (1993a). Neuere arbeitsmedizinische Publikationen unterstreichen die zunehmende Bedeutung der Neutrophilen in der Asthmapathogenese (Jung u. Park 1999; Jatakanon et al. 1999; Lindén u. Adachi 2002; Lemière et al. 2002). Die Dosisabhängigkeit der Provokationsreaktion stellt eine objektivierbare Basis für die Ermittlung spezifischer Auslöseschwellen dar. Nicht alle Aspekte des beruflichen Isocyanatasthmas lassen sich exakt humanspezifisch im Tiermodell reproduzieren. Dennoch zeigt die Schwellendosisabhängigkeit der modellspezifischen Surrogatendpunkte eine verblüffende Konvergenz von tierexperimentell und arbeitsmedizinisch abgeleiteten Grenzwerten (s. Abb. 5).
Auch beim flüchtigeren TDI ergab sich eine solche Konvergenz, allerdings mit höherer experimenteller Unsicherheit, da auch für TDI-Dampf das MDI-Aerosol spezifische Cvariabel x tkonstant-Provokationsprotokoll angewendet wurde. Neuere, aber experimentell noch nicht abgeschlossene Untersuchungen stützen eine modifizierte Vorgehensweise für reaktive, dampfförmige Isocyanate. Ein Ckonstantxtvariabel-Provokationsprotokoll gewährleistet für alle Eskalationsstufen eine identische Penetrationstiefe in die Lunge. Dies erklärt, dass bei ausreichend hohen Konzentrationen eindeutige Unterschiede zwischen mit TDI-sensibilisierten und naiven Ratten feststellbar waren, bei niedrigeren Konzentrationen die bronchiale Targetstruktur offensichtlich durch Dampfretention in den oberen Luftwegen unterdosiert wurde. Die den oberen Respirationstrakt reizenden Schwellendosen (rattenbasiert adjustiert: 0,35 mg TDI/m³, Humandaten: 0,35 mg/m³; s. Abb. 5) folgten der Prädiktion. Beim TDI-Dampf lässt sich somit resümieren, dass die an der Brown-Norway-Ratte ermittelten asthmabasierten Grenzdosen für die Auslösung de facto den von Baur et al. (1994) und Sastre et al. (2003) berichteten Auslösekonzentrationsbereichen am asthmatischen Arbeiter entsprechen.
Diese Konvergenz belegt die arbeitsmedizinische Relevanz des Tiermodells für die Arbeitsplatzsicherheit und Grenzwertableitung. Die systematischen Untersuchungen stützen somit einen von der Atemtraktreizung abhängigen Cxt-Mechanismus für die Entstehung des Isocyanatasthmas in durch dermale Exposition prädisponierten Arbeitern.
Literatur
Barbinova L, Baur X. Increase in exhaled nitric oxide (eNO) after work-related isocyanate exposure. Int Arch Occup Environ Health 2006; 79: 387–395.
Baur X, Marek W, Ammmon J, Czuppon A B, Marczynski B, Raulf-Heimsoth M, Roemmelt H, Fruhmann, G. Respiratory and other hazards of isocyanates. Int Arch Occup Environ Health 1994; 66: 141–152.
Baur X, Latza U, Barbinova L, Yu F. Isocyanat-bedingte Gesundheitsgefahren. Arbeitsmed Sozialmed Umweltmed 2003; 38: 270–277.
Baur X. Evidence for allergic reactions in isocyanate asthma. J Allergy Clin Immunol 2007; 119: 757–758.
Bello D, Woskie SR, Streicher RP, Liu Y, Stowe MH, Eisen EA, Ellenbecker MJ, Sparer J, Youngs F, Cullen MR, Redlich CA. Polyisocyanates in occupational environments: a critical review of exposure limits and metrics. Am J Ind Med 2004; 46: 480–491.
Bello D, Herrick CA, Smith TJ, Woskie SR, Streicher RP, Cullen MR, Liu Y, Redlich CA. Skin exposure to isocyanates: reasons for concern. Environ Health Perspect 2007; 115: 328–335.
CLP (Classification L. and Packaging of Substances). Regulation (EC) No 1272/2008 of the European Parliament and of the Council. Official Journal of the European Union 2008; 51: L353.
Condon TV, Sawyer RT, Fenton MJ, Riches WH. Lung dendritic cells at the innate-adaptive immune interface. Leukoc Biol 2011; 90: 883–895.
Day BW, Jin R, Karol MH. In vivo and in vitro reactions of toluene diisocyanate isomers with guinea pig hemoglobin. Chem Res Toxicol 1996; 9: 568–573.
ECHA (European Chemical Agency). Guidance on information requirements and chemical safety assessment pp. Chapter R.7a: endpoint specific guidance 2008.
Friedmann PS. The relationships between exposure dose and response in induction and elicitation of contact hypersensitivity in humans. Br J Dermatol 2007; 157: 1093–1102.
GHS (Globally Harmonized System of Classification and Labeling of Chemicals). 3rd edn. New York, Geneva: United Nations, 2009.
Henschler D, Assmann W, Meyer KO. Zur Toxikologie der Toluenediisocyanate. Arch Toxikol 1962; 19: 364–387.
Hoffmann HD, Leibold E, Ehnes C, Fabian E, Landsiedel R, Gamer A, Poole A. Dermal uptake and excretion of 14C-toluene diisocyante (TDI) and 14C- methylene diphenyl diisocyanate (MDI) in male rats. Clinical signs and histopathology following dermal exposure of male rats to TDI. Toxicol Lett 2010; 199: 364–371.
Holt PG, Oliver J, Bilyk N, McMenamin C, McMenamin PG, Kraal G, Thepen T. Downregulation of the antigen presenting cell function(s) of pulmonary dendritic cells in vivo by resident alveolar macrophages. J Exp Med 1993; 177: 397–407.
Jatakanon A, Uasuf C, Maziak W, Lim S, Chung KF, Barnes PJ. Neutrophilic inflammation in severe persistent asthma. Am J Respir Crit Care Med 1999; 160: 1532–1539.
Jung K-S, Park H-S. Evidence for neutrophil activation in occupational asthma. Respirology 1999; 4: 303–306.
Lemière C, Romeo P, Chaboillez S, Tremblay C, Malo JL. Airway inflammation and functional changes after exposure to different concentrations of isocyanates. J Allergy Clin Immunol 2002; 10: 641–646.
Lemière C, Weytjens K, Cartier A, Malo JL. Late asthmatic reaction with airway inflammation but without airway hyperresponsiveness. Clinical Experimental Allergy 2000; 30: 415–417.
Leroyer C, Perfetti L, Cartier A, Malo JL. Can reactive airways function syndrome (RADS) transform into occupational asthma due to “sensitization” to isocyanates? Thorax 1998; 53: 152–153.
Lindén A, Adachi M. Neutrophilic airway inflammation and IL-17. Allergy 2002; 57: 769–775.
Lira AA. A passport into the lymph node: Lymphocytes continuously recirculate throughout the body. Evidence now suggests chemokine receptor CCR7 actively controls lymphocyte entry into afferent lymphatic vessels. Nature Immunology 2005; 6: 866–868.
Malo JL, Ghezzo H, Elie R. Occupational asthma caused by isocyanates: patterns of asthmatic reactions to increasing day-to-day doses. Am J Respir Crit Care Med 1999; 159: 1879–1883.
Pauluhn J. Acute inhalation toxicity of polymeric diphenyl-methane-44’-diisocyanate (MDI) in rats: time course of changes in bronchoalveolar lavage. Arch Toxicol 2000; 74: 257–269.
Pauluhn J. Critical analysis of biomonitoring endpoints for measuring exposure to polymeric diphenyl-methane-44’-diisocyanate (MDI) in rats: a comparison of markers of exposure and markers of effect. Arch Toxicol 2002a; 76: 13–22.
Pauluhn J. Short-term inhalation toxicity of polyisocyanate aerosols in rats: comparative assessment of irritant-threshold concentrations by bronchoalveolar lavage. Inhal Toxicol 2002b; 14: 287–301.
Pauluhn J, Lewalter J. Analysis of markers of exposure to polymeric methylenediphenyl diisocyanate (pMDI) in rats: a comparison of dermal and inhalation routes of exposure. Exp Toxic Pathol 2002; 54: 135–146.
Pauluhn J. Comparative analysis of pulmonary irritation by measurements of Penh and protein in bronchoalveolar lavage fluid in Brown Norway rats and Wistar rats exposed to irritant aerosols. Inhalation Toxicology 2004a; 16: 159–175.
Pauluhn J. Pulmonary irritant potency of polyisocyanate aerosols in rats: comparative assessment of irritant-threshold concentrations by bronchoalveolar lavage. J Appl Toxicol 2004b; 24: 231–247.
Pauluhn J. Brown Norway Rat asthma model of diphenylmethane-44‘-diisocyanate. Inhalation Toxicology 2005; 17: 729–739.
Pauluhn J, Mohr U. Review. Experimental approaches to evaluate respiratory allergy in animal models. Exp Toxic Pathol 2005; 56: 203–234.
Pauluhn J, Woolhiser MR, Bloemen L. Repeated inhalation challenge with diphenylmethane-44‘-diisocyanate in Brown Norway rats leads to a time-related increase of neutrophils in bronchoalveolar lavage after topical induction. Inhal Toxicol 2005; 17: 67–78.
Pauluhn J. Review. Animal models of respiratory allergy. In: Gardner DE, Crapo JD, Massaro EJ (Hrsg.): Target organ series – toxicology of the lung. New York: Raven Press, 2006, pp. 419–460.
Pauluhn J, Vohr H-W. Partial C-fiber ablation modulates diphenylmethane-44‘-di- isocyanate (MDI)-induced respiratory allergy in Brown Norway rats. Toxicology 2006; 228: 188–199.
Pauluhn J, Brown W, Hext W, Leibold E, Leng G. Analysis of biomarkers in rats and dogs exposed to polymeric methylenediphenyl diisocyanate (pMDI) and its glutathione adduct. Toxicology 2006; 222: 202–212.
Pauluhn J. Brown Norway rat asthma model of diphenylmethane-44‘-diisocyanate (MDI): the elicitation dose-response relationship. Toxicol. Sciences 2008; 104: 320–331.
Pauluhn J. Interrelating the acute and chronic mode of action of inhaled methylenediphenyl diisocyanate (MDI) in rats assisted by computational toxicology. Regulatory Pharmacology and Toxicology. Regul Toxicol Pharmacol 2011; 61: 351–364.
Pauluhn J, Poole A. Brown Norway rat asthma model of diphenylmethane-44-diisocyanate (MDI): Determination of the elicitation threshold concentration of after inhalation sensitization. Toxicology 2011; 281: 15–24.
Poet TS. Assessing dermal absorption. Toxicol Sci 2000; 58: 1–2.
REACH (Registration Evaluation Authorisation and Restriction of Chemicals) Regulation (EC) No 1907/2006 of The European Parliament and of the Council of 18 December 2006. ...
Für die Verfasser:
Prof. Dr. rer. nat. Jürgen Pauluhn
Experimental Toxicology
Bayer Pharma AG
42096 Wuppertal
E-Mail: juergen.pauluhn@bayer.com