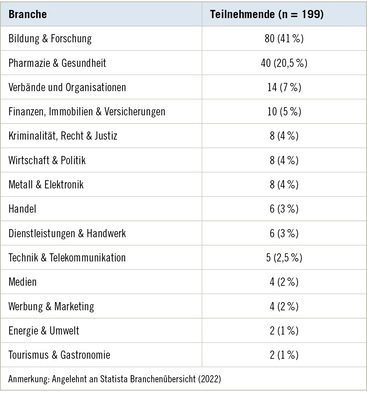
Radiologische Darstellung quarzstaubbedingter Erkrankungen von Lunge und Pleura
Weltweit ist die Silikose die häufigste Berufskrankheit. Im Bergbau überwiegen dabei die Mischstaubpneumokoniosen. In Deutschland ist durch den starken Rückgang des Bergbaus und die Staubbekämpfungsmaßnahmen die Silikose deutlich rückläufig. Im Jahr 2014 wurden insgesamt noch 758 Silikosen, 6 Silikotuberkulosen und 41 durch Quarzstaub bedingte Lungenkrebserkrankungen anerkannt. Derzeit sind jedoch noch mehr als 2/3 der Todesfälle benigner berufsbedingter Lungenerkrankungen durch eine Silikose / Mischstaubpneumokoniose verursacht.
In Deutschland auftretenden Neuerkrankungen sind heute meist klassische Silikosen, die im Rahmen der Natur- und Kunststeinbearbeitung, im Tunnel- und Straßenbau auftreten können. Hier finden sich überwiegend chronische Verlaufsformen z. T. auch bei jüngeren Arbeitnehmern. Akute Silikosen werden vor allem bei Sandstrahlarbeiten und im Tunnelbau beobachtet sind bei deutschen Arbeitnehmern in den letzten Jahren jedoch nicht mehr beschrieben worden.
Die radiologischen Befundmuster der unterschiedlichen Verlaufsformen der Silikose sowie von durch Tuberkulose bzw. immunologische Erkrankungen komplizierten Verläufen werden sowohl für die Übersichtsaufnahmen als auch die Computertomographie beschrieben. Insbesondere wird auch auf die bildmorphologische Differenzierung zur Sarkoidose, die morphologisch ähnliche Bilder zeigen kann, und auf die Beteiligung der Pleura im Rahmen der Silikose eingegangen.
Schlüsselwörter: Silikose – akute, chronische Verlaufsform, Komplikationen der Silikose – Differenzialdiagnose: Silikose, Sarkoidose, Tuberkulose – radiologische Untersuchungen bei Silikose
Radiologic depiction of lung and pleural diseases caused by silica dust
Silicosis is the most frequent occupational disease worldwide. In Germany silicosis is decreasing on the whole due to the great decrease of mining. In 2014 a total of 758 cases of silicosis, 6 cases of silicotuberculosis and 41 lung carcinomas due to silica dust were recognised as occupational diseases. At present, more than two-thirds of deaths in benign occupational lung diseases are still caused by silicosis/coal miner’s pneumoconiosis.
In mining the majority of cases are coal miner’s pneumoconiosis. New diseases in Germany today are mostly classic silicosis in workers in the natural and artificial stone working trade and in tunnel and road construction. Mostly chronic forms of the disease are found here, even in younger workers.
Acute cases of silicosis are observed above all in sandblasting and in tunnel construction, but have not been reported among German workers in the past few years.
The radiologic patterns of the various courses of silicosis as well as those complicated by tuberculosis or immune disorders are described for chest X-rays as well as computed tomography. A description is given of the patterns of acute, accelerated and chronic silicosis, its complications and accompanying diseases, as well as the difference from sarcoidosis, which may present morphologically similar images.
Keywords: silicosis – acute, accelerated and chronic complications of silicosis – differential diagnosis: silicosis, sarcoidosis, tuberculosis – imaging of silicosis
Arbeitsmed Sozialmed Umweltmed 2016; 51: –516
Einleitung
Weltweit ist die Silikose derzeit noch die häufigste Berufskrankheit. Ursächlich dafür ist ihre hohe Prävalenz vor allem in Schwellenländern. Zwischen 1997 und 2009 wurden z. B. in China 122.333 Neuerkrankungen festgestellt; besonders häufig sind dort Arbeiter in Metallbergwerken betroffen (Zhang et al. 2013). In Indien sind etwa 10 Millionen Arbeiter quarzstaubexponiert. Bei indischen Achatarbeitern liegt die Prävalenz der Silikose bei 38 % (Saiyed u. Tiwari 2004). In den Industrieländern ist durch den starken Rückgang des Bergbaus und die Staubbekämpfungsmaßnahmen die Silikose hingegen deutlich rückläufig. Im Jahr 2014 wurden in Deutschland insgesamt noch 758 Silikosen, 6 Silikotuberkulosen und 41 durch Quarzstaub bedingte Lungenkrebserkrankungen anerkannt. Derzeit sind jedoch noch mehr als 2/3 der Todesfälle benigner berufsbedingter Lungenerkrankungen durch die Silikose/Mischstaubpneumokoniose verursacht (DGUV 2014). Neuerkrankungen treten heute in Deutschland vor allem in der Natur- und Kunststeinbearbeitung und im Tunnelbau auf.
Pathogenese der Silikose
Die Silikose ist eine fibrosierende Lungenerkrankung, die durch das Einatmen von Stäuben entsteht, die alveolengängiges kristallines Siliziumdioxyd (Quarzfeinstaub) oder seine kristallinen Modifikationen Tridymit bzw. Cristobalit enthalten. Prädisponierende Faktoren sind der Anteil der alveolengängigen Staubfraktion, der Gehalt an kristallinem Siliziumdioxyd in diesem Staub, die Art der Begleitstäube wie auch die Expositionsdauer und -höhe sowie die individuelle Reinigungsfähigkeit der Lunge (Müller u. Grewe 1992).
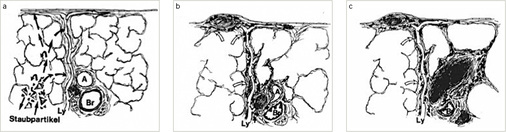
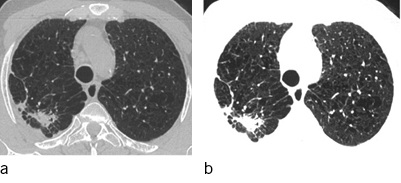
Der inhalierte alveolengängige Quarzstaub wird von Alveolarmakrophagen aufgenommen, die daran zugrunde gehen und die SiO2-Partikel wieder freigeben. Weitere Makrophagen setzen den Prozess fort. Durch den Zerfall der Makrophagen werden Zytokine und TNF freigesetzt. Dies löst eine fibroblastische Reizwirkung aus, in deren Folge im Lungeninterstitium durch Neubildung von kollagenem und retikulärem Bindegewebe Knötchen – sog. silikotische Noduli – entstehen, die sich aus Histiozyten/Makrophagen mit inkorporiertem (Quarz-)Staub, einem zellfreien Kern und einer kollagenen Faserhülle zusammensetzen (Müller 1983; Müller u. Grewe 1992) ( Abb. 1). Silikotische Noduli entstehen vor allem entlang der Abtransportwege in den Lymphbahnen und in den Lymphknoten. Bei der akzelerierten und der chronischen Silikose kann sich, vor allem bei Mischstaubexposition, in der Umgebung dieser Noduli durch Schrumpfung ein perifokales Emphysem ausbilden. Zunehmende Koaleszenzen silikotischer Noduli führen insbesondere bei der Mischstaubpneumokoniose (Ulmer u. Reichel 1976) zur Ausbildung größerer Schwielen. Bei weiterem Fortschreiten der Fibrosierung können die Schwielen „wandern“ und verursachen Distorsionen von Bronchien und Gefäßen. Charakteristisch für eine chronische Silikose sind neben den pulmonalen hyalinen Noduli auch vergrößerte, eierschalenartig verkalkte Lymphknoten mediastinal und hilär.
Radiologische Befunde quarzstaubbedingter Erkrankungen der Lunge
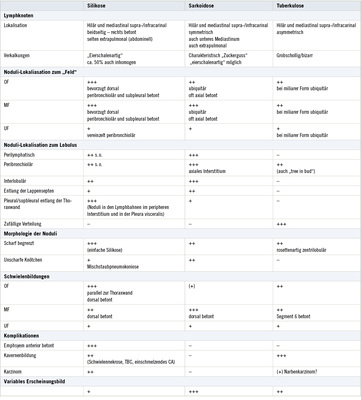
Eine Zusammenfassung der CT-Morphologie zeigt Tabelle 1.
Akute Silikose (Silikoproteinose)
Bei sehr hoher Quarzstaubexposition und unzureichenden Absaugvorrichtungen (z. B. bei Sandstrahlarbeiten oder auch im Tunnelbau) bzw. bei unzureichender personenbezogener Schutzausrüstung kann innerhalb von Monaten das klinische Bild einer akuten Silikose entstehen. Der Verlauf der akuten Silikose ist gekennzeichnet durch plötzlich auftretende in der Regel rasch progrediente Atemnot, gelegentlich auch Fieber und endet frühzeitig im Tod durch pulmonales Versagen. In Deutschland wurden in den letzten Jahren wohl aufgrund der meist relativ guten Arbeitsschutzmaßnahmen keine derartigen Fälle bekannt.
Histologisch finden sich neben doppelbrechenden Kristallen Zeichen einer interstitiellen Fibrose und Pneumonitis, nur wenige rundliche scharf berandete Verdichtungen (Noduli) und PAS-positives Material in den Alveolen vereinbar mit einer Alveolarproteinose (Uehlinger 1949).
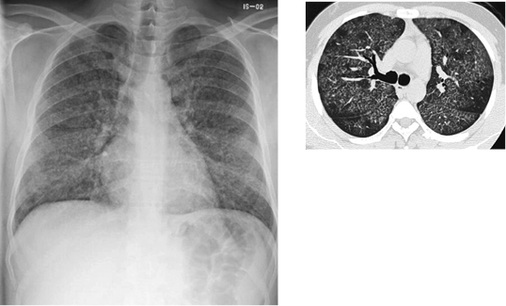
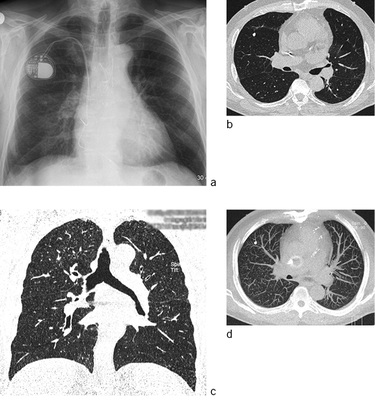
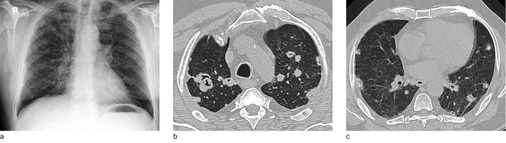
In der Thoraxaufnahme kommen im Gegensatz zu den klassischen Verlaufsformen mit nodulärem bzw. nodulär-retikulärem Bildmuster Milchglastrübungen zur Darstellung. Der Befund kann aufgrund der oft symmetrischen und bevorzugt perihilären Ausbreitung einem Lungenödem ähneln. Computertomographisch zeigen sich fokale Milchglastrübungen und Verdickungen der interlobulären Septen sowie des axialen Interstitiums, vereinbar mit einem Crazy-paving-Muster („crazy paving“ = Mosaikpflaster). Diese Befunde erinnern bildmorphologisch an eine primäre Alveolarproteinose ( Abb. 2). Im Gegensatz zur Alveolarproteinose finden sich jedoch zusätzlich unscharf begrenzte zentrilobuläre Verdichtungen und größere konfluierende Konsolidierungen (Alper et al. 2008; Doganay et al. 2010; Marchiori et al. 2007; Taeger 2011). Punktförmige Verkalkungen innerhalb der Konsolidierungen wurden von Marchiori et al. (2007) in 83 % der Fälle gesehen und als charakteristisch für eine Silikoproteinose beschrieben. Die Läsionen sind überwiegend dorsal angeordnet. In etwa 50 % der Fälle finden sich vergrößerte mediastinale Lymphknoten, die zum Teil auch verkalken (Marchiori et al. 2007), eierschalenartige Verkalkungen wurden jedoch nicht nachgewiesen. Uehlinger beschreibt erstmals 1949 bei starker Ausprägung der Erkrankung eine Betonung der Befunde in den Unterfeldern, diese wird auch in späteren Arbeiten bestätigt.
Akzelerierte Silikose
Die akzelerierte Silikose wird bei hoher Quarzstaubexposition innerhalb von 4–5 Jahren nach Expositionsbeginn klinisch manifest. Sie zeigt im Wesentlichen das radiologische Bild der chronischen Silikose, Konsolidierungen (Lungenschwielen) können sich jedoch im Gegensatz zur chronischen Silikose im Verlauf von Monaten entwickeln (Alper et al. 2008; Doganay et al. 2010; Hutyrová et al. 2015; Nicol et al. 2015).
Unkomplizierte chronische Silikose/Mischstaubpneumokoniose
In der Regel zeigt die unkomplizierte chronische Silikose/Mischstaubpneumokoniose einen über Jahrzehnte langsam progredienten Verlauf, der auch nach dem Ende der Exposition fortschreiten kann. Manifest wird die chronische Silikose, die bereits bei relativ geringer Quarzstaubexposition entstehen kann, etwa 10–20 Jahre nach Expositionsbeginn (Ulmer u. Reichel 1976). Das radiomorphologische Bild der Silikose wird durch den Quarzgehalt des eingeatmeten Staubs beeinflusst; je höher der Gehalt an kristallinem Siliziumdioxyd, umso dichter und schärfer begrenzt erscheinen die Knötchen. Mischstäube können das Erscheinungsbild so beeinflussen, dass auch irreguläre Schatten auftreten (Arakawa et al. 2007; Ulmer u. Reichel 1976).
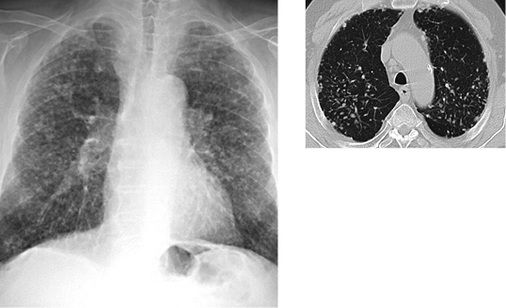
In der Thoraxübersicht ist das Bild der unkomplizierten Silikose geprägt durch rundliche Verdichtungen (Noduli) häufig unterschiedlicher Durchmesser, mit einer Lokalisation vor allem in den Ober- und Mittelfeldern. Die in der älteren Literatur verwendeten Begriffe „Schrotkorn-, Schneegestöber- und Gittertülllunge“ beschreiben die unterschiedliche „Röntgendichte“ der silikotischen Noduli und die begleitenden interstitiellen Muster in der Thoraxübersichtsaufnahme. Eine „Schrotkornlunge“ mit scharf begrenzten, verkalkten Knötchen (ILO „cn“) findet sich vor allem bei Exposition gegenüber Stäuben mit hohem Quarzgehalt, z. B. bei Sandstrahlern oder Tunnelbauern. Die „Gittertülllunge“ mit retikulärem Muster und eher unscharf begrenzten Noduli wird bevorzugt bei Mischstaubpneumokoniosen mit begleitender alveolärer bzw. bronchiolitischer Reaktion beobachtet (Ulmer u. Reichel 1976).
Die Größe der rundlichen Noduli wird in Abhängigkeit von ihrem Durchmesser für die Thoraxübersichtsaufnahme nach der ILO-Klassifikation mit p
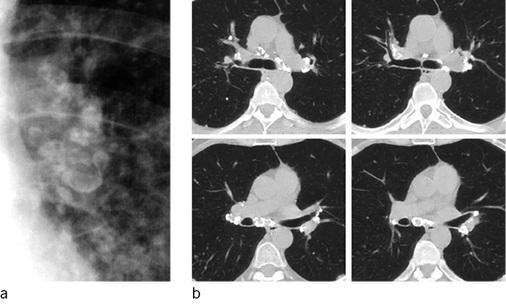
In der Computertomographie zeigt die chronische unkomplizierte Form der Silikose überwiegend scharf berandete zum Teil auch verkalkte Noduli (Chong et al. 2006; Cox et al. 2014). Charakteristisch ist eine perilymphatische Verteilung der Knötchen. Diese liegen sowohl im Lungenmantel, hier radiologisch von der Pleura nicht zu trennen, als auch im Parenchym, entsprechend der Ablagerung des inhalierten Staubs, meist in der Umgebung der respiratorischen Bronchiolen. Auch in der Pleura visceralis selbst können durch den Abtransport von Quarzstaub über die pleuralen Lymphbahnen silikotische Noduli im Verlauf der Lymphbahnen entstehen. Da bei Mischstaubablagerungen häufig geringfügig fibrös-entzündliche Reaktionen ablaufen (Müller 1983), kommt es zu Einziehungen der Pleura visceralis, dadurch wird das silikotische Knötchen scheinbar in das Lungenparenchym eingezogen (Ulmer u. Reichel 1976). Bei ungünstiger Dokumentation in der Computertomographie, d.h. Darstellung nicht in allen drei Raumebenen, können peripher gelegene silikotische Noduli bildmorphologisch mit asbestassoziierten parietalen Verdickungen der Pleura verwechselt werden. Zu dieser Missinterpretation tragen auch die im angloamerikanischen Sprachgebrauch üblichen und teilweise in den deutschen Sprachgebrauch übernommenen Bezeichnungen „Pseudoplaques“ oder „subpleural pearls“ für diese Lokalisation silikotischer Noduli bei ( Abb. 3a,b).
Silikotische Noduli sind überwiegend in den Oberlappen und den kranialen Anteilen der Unterlappen lokalisiert. Sie finden sich dominant dorsal der Trachealebene. Die Anzahl der Herde nimmt üblicherweise von kranial nach kaudal ab. Beginnende Koaleszenzen der silikotischen Noduli sind in der Computertomographie deutlicher als anhand der Übersichtsaufnahmen abzugrenzen. Dominiert der Staubanteil mit geringer fibrogener Wirkung, zeigen sich der Computertomographie vor allem bronchioloalveoläre Verdickungen und unscharfe zentrilobuläre Knötchen sowie ein Lungenemphysem.
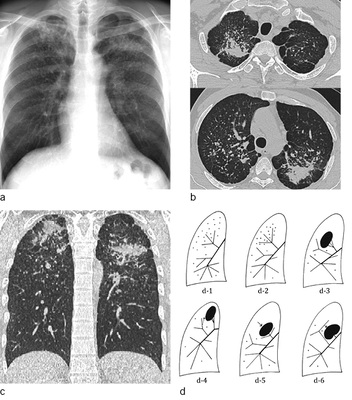
Mikronoduläre Verdichtungen (P-Schatten), mit geringer Streuung sind in den CT-Rekonstruktionen mit 1 mm Schichtdicke schwer von orthogonal getroffenen Gefäßen zu unterscheiden. Auch ein Lungenemphysem kann die Detektion gering gestreuter kleiner silikotischer Knötchen deutlich erschweren. Aus diesem Grund ist die Anfertigung von MIP-(Maximum Intensity Projection)-Rekonstruktionen mit 5-mm-Schichtdicke bei der Diagnostik nodulärer Erkrankungen obligatorisch um den Streuungsgrad sicher einschätzen zu können. Die Schichtdicke von 5 mm wurde gewählt, da die verfügbaren Referenzfilme zum großen Teil ebenfalls mit einer Schichtdicke von 5 mm dokumentiert wurden ( Abb. 4a–d).
Lymphknotensilikose
In der Lunge deponierter Quarzstaub wird über die Lymphwege sowohl entlang der Lymphbahnen des axialen als auch des peripheren Interstitiums abtransportiert und in den Lympknoten deponiert. Bei relativ geringer Quarzstaubexposition treten zunächst Vergrößerungen der hilären und mediastinalen Lymphknoten auf (Taeger 2011), sie sind meist symmetrisch, die rechte Seite kann bevorzugt sein. Rein einseitige Lymphknotenvergrößerungen sind für eine Silikose uncharakteristisch (Uehlinger 1949). Die Verkalkung der Lymphknotenrandsinus (Eierschalensilikose; Abb. 5a,b) ist in einer gegenüber Quarzstaub exponierten Population fast pathognomonisch für eine Silikose, tritt aber – wenn auch seltener – bei der Sarkoidose, Berylliose und Amyloidose auf. Für eine Silikose sind gleichmäßig geformte Kalkschalen charakteristisch, während unregelmäßige oder zentrale bzw. „granuläre“ Verkalkungen für eine Silikose nicht pathognomonisch sind. In diesen Fällen ist differenzialdiagnostisch auch an eine Tuberkulose zu denken. Eine Lymphknotensilikose kann auch ohne begleitende Parenchymveränderungen vorkommen. In einzelnen Fällen sind auch abdominelle Lymphknoten betroffen (Ulmer u. Reichel 1976).
Komplikationen der chronischen Silikose
Schwielenbildung (progressive massive Fibrose) und Hilusdistorsion
Durch zunehmende Schrumpfungsvorgänge im Rahmen der Fibrose können einzelne silikotische Knötchen zu mehr oder weniger ausgedehnten Konsolidierungen (silikotische Schwielen) verschmelzen. Im Gegensatz zur „reinen Silikose“ finden sich bei der Mischstaubpneumokoniose meist unregelmäßige Außenkonturen der Konsolidierungen und ein umgebendes perifokales Emphysem (Otto u. von Hinüber 1972; Remy-Jardin et al. 1990, 1992; Ulmer u. Reichel 1976).
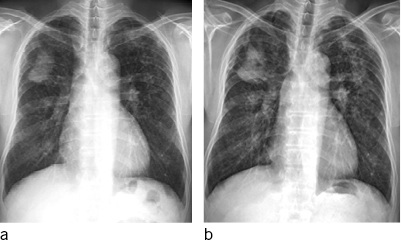
Die Schwielen sind häufig hantelförmig konfiguriert und ordnen sich bevorzugt bilateral parallel zur Thoraxwand in den Oberfeldern dorsal der Trachealebene an. Gelegentlich treten Schwielen auch im Mittel- und Unterlappen auf. Die rechte Lunge ist etwas häufiger betroffen. Im weiteren Verlauf kann es zu einer Schwielenwanderung kommen (Bohlig 1988) ( Abb. 6a), im unkomplizierten Verlauf wandern die Schwielen in Richtung Hilus, bei begleitenden parenchymalen Narben kann auch eine Wanderung der Schwiele nach peripher mit Distraktion der Hilusstrukturen erfolgen. Die von den Hiluslymphknoten ausgehende Verschwielung kann zu Verziehungen der Gefäße und Bronchien auch mit Bronchiektasen führen. Die Bronchiallumina können eingeengt werden, in fortgeschrittenen Fällen können Bronchialverschlüsse mit angrenzenden Atelektasen besonders im Mittellappen auftreten. Differenzialdiagnostische Schwierigkeiten bestehen in der Abgrenzung von nekrobiotischen Einschmelzungen dieser Schwielen gegenüber silikotuberkulösen Kavernen und zentral einschmelzenden Lungenkarzinomen (Barboza et al. 2008; Chong et al. 2006).
Silikotuberkulose
Mit dem allgemeinen Rückgang der Tuberkulose ist auch die tuberkulöse Superinfektion der Silikose in Deutschland selten geworden, obwohl die Tuberkuloserate bei der Silikose höher ist als bei der übrigen Bevölkerung.
Bei Arbeitern in afrikanischen Goldminen wird ein gegenüber der Normalpopulation 2,8fach erhöhtes Risiko, an Tuberkulose zu erkranken, beobachtet (Cowie 1994). Die Tuberkulose kann präexistent sein und exazerbieren, kann sich aber auch in einer vorbestehenden Silikose entwickeln. Auch bei der Infektion mit atypischen Mykobakterien kann das klinische und radiologische Bild der Silikotuberkulose auftreten. Bei morphologisch ähnlichen Befunden zwischen Silikose und Tuberkulose ist insbesondere der Vergleich mit Voruntersuchungen von eminenter Bedeutung. Finden sich neu aufgetretene Tree-in-bud-Phänomene, schnell zunehmende asymmetrisch ausgeprägte Noduli oder Konsolidierungen, insbesondere mit Einschmelzungen, ist differenzialdiagnostisch an eine floride Silikotuberkulose zu denken (Barboza et al. 2008; Martins et al. 2010) ( Abb. 6b).
Silikose und Pleuraverbreiterung
Bei der chronischen Verlaufsform der Silikose können sich durch den Abtransport quarzhaltiger Stäube auch über die im peripheren Interstitium bzw. in der Pleura gelegenen Lymphbahnen silikotische Knötchen ausbilden (Müller 1983; Müller u. Grewe 1992; Otto u. Breining 1961). Die Schrumpfung großer silikotischer Schwielen im Lungenmantel kann lokal zu Invaginationen der Pleura führen, die bildmorphologisch Parenchymbändern gleichen (Arakawa et al. 2005; Ulmer u. Reichel 1976). In Einzelfällen werden ganze Anteile der Lunge „abgeschnürt“. Silikotische Konsolidierungen können in diesen Fällen das Bild einer Rundatelektase zeigen. Die in der Pleura gelegenen silikotischen Knötchen verursachen per se keine flächenhaften Pleuraverwachsungen. Wenn in der Umgebung jedoch durch entzündliche Reaktionen eine Pleuritis entsteht, können Pleuraergüsse und auch flächenhafte viszerale Verbreiterungen der Pleura entstehen (Arakawa et al. 2005; Otto u. Breining 1961). In der Literatur gibt es Hinweise, dass diese pleuralen Befunde bei einer Silikose häufiger im Zusammenhang mit einer Silikotuberkulose stehen (Arakawa et al. 2005).
Emphysem, chronische Bronchitis und Silikose
Nachdem durch arbeitshygienische Maßnahmen die komplizierten verschwielenden Verlaufsformen der Silikose nahezu völlig zurückgedrängt wurden, steht heute die chronische obstruktive Emphysembronchitis mit ihren schweren Folgen für die kardiorespiratorische Funktion im Vordergrund. Bereits 1972 wurde durch Otto u. von Hinüber beschrieben, dass die verschiedenen Formen des Emphysems unabhängig von lokalen Staubablagerungen und silikotischen Knötchen bei Autopsien beruflich staubbelasteter Personen deutlich häufiger als bei Autopsien nicht staubbelasteter Personen auftreten. Es finden sich fokale und generalisierte Emphysemformen wie das perinodöse Traktionsemphysem, das dilatative zentrilobuläre Emphysem bis hin zur generalisierten Form der sog. „schwarzen Löcherlunge“ sowie das bullöse bronchostenotische Emphysem, häufig mit einer persistierenden Bronchitis und Bronchiolitis kombiniert. Bei ausgeprägtem Lungenemphysem können anhand der Übersichtsaufnahme silikotische Noduli vollständig entgehen. Computertomographisch zeigen sich in diesen Fällen häufig neben dem ausgeprägten Emphysem zusätzlich Bronchialwandverdickungen als Zeichen einer Bronchitis sowie unscharfen zentrilobulären Knötchen als Zeichen einer Bronchiolitis und scharf berandete Noduli im Sinne silikotischer Knötchen ( Abb. 7). Das Ausmaß des Lungenemphysems korreliert nach Literaturangaben wohl deutlich mit der Einschränkung der Lungenfunktion, eine gute Korrelation mit der Ausprägung der nodulären Veränderungen besteht jedoch nicht (Bergin et al. 1986; Gevenois et al. 1998; Lopes et al. 2008; Meijer et al. 2011).
Lungenkarzinom
Die kanzerogene Wirkung von einatembarem kristallinem Siliciumdioxid wurde in der medizinischen Wissenschaft lange kontrovers diskutiert. Die IARC (International Agency for Research on Cancer) hat im Jahre 1997 Quarz als „krebserregend für den Menschen“ eingestuft. 1999 wurde die Frage durch die Senatskommission zur Prüfung gesundheitsschädlicher Arbeitsstoffe der Deutschen Forschungsgemeinschaft neu bewertet. Als Ergebnis ist kristallines Siliciumdioxid als sog. Kategorie-I-Stoff (gesichert krebserzeugend für den Menschen) ausgewiesen (BMA 2002, 2015). Eine durch kristallines Siliziumdioxid induzierte Verdopplung des Lungenkrebsrisikos in Verbindung mit dem Nachweis einer Silikose wird bei einem Streuungsgrad 1/1 nach der ILO-Klassifikation bzw. einem Gesamtstreuungsgrad von zumindest 2 nach ICOERD-Klassifikation (Voraussetzung: Streuungsgrad 1 im rechten und im linken Oberfeld) als wissenschaftlich gesicherte Assoziation betrachtet (Baur et al. 2016). Insofern kommt dem radiologischen Nachweis einer Silikose mindestens vom Streuunggrad 1/1 nach der ILO-Klassifikation bzw. einem Gesamtstreuungsgrad von mindestens 2 in der Computertomographie eine entscheidende Bedeutung bei der Diagnosestellung eines quarzstaubbedingten Lungenkarzinoms im Sinne einer BK 4112 zu ( Abb. 8).
Sonderformen
IPF und Silikose
Bekannt ist, dass abhängig vom Quarzgehalt und der weiteren Zusammensetzung der inhalierten Stäube neben nodulären auch retikuläre Bildmuster auftreten können. In der Literatur gibt es einzelne Hinweise, dass auch Veränderungen nachzuweisen sind, die den Charakter eines UIP-Musters (UIP = „usual interstitial pneumonia“) haben (Arakawa et al. 2007). Als potenzieller Risikofaktor für die Entstehung einer IPF (IPF = idiopathische pulmonale Fibrose), die bildmorphologisch einem UIP-Muster aufweist, wurde von Bouros (2013) in einer Metaanalyse neben dem Nikotinabusus auch die Inhalation von quarzhaltigen Stäuben,organischen Stäuben sowie von Metallstaub identifiziert.
Silikose und immunologische Erkrankungen mit Lungenbeteiligung
In den letzten Jahren werden bei bekannter Silikose zunehmend Fälle von immunologischen Erkrankungen beschrieben, die auch eine pulmonale Beteiligung aufweisen können (s. folgende Übersicht; Caplan et al. 1958; Calvert et al. 2003; Laney u. Weissman 2012; Makol et al. 2011; Parks et al. 1999; Rafnsson et al. 1998).
Zunächst wurden diese Erkrankungen als zufällig neben der Silikose auftretend angesehen. In der Zwischenzeit mehren sich die Hinweise in der Literatur, dass durch die Silikose immunologische Vorgänge getriggert werden könnten. In Einzelfällen können also in der Computertomographie neben dem Befundmuster der Silikose zusätzlich die Befundmuster der immunologischen Grunderkrankung nachweisbar werden.
Als Beispiel sei das Caplan-Syndrom, eine Kombination aus Silikose und rheumatischer Arthritis, aufgeführt. Bei bekannter Silikose – auch geringer Ausprägung – treten in diesem Fall rasch progrediente, häufig auch einschmelzende, solitäre und/oder multiple pulmonale Rundherde auf. Diese liegen überwiegend in der Lungenperipherie, haben einen Durchmesser 1 cm oder und können auch zeitlich nicht kongruent mit der klinischen Manifestation einer primär chronischen oder subakuten Polyarthritis auftreten ( Abb. 9) (Caplan et al. 1958; Rozenberg u. Shapera 2014; Schreiber et al. 2010).
Differenzierung Silikose – Sarkoidose – Tuberkulose
Eine Zusammenfassung der Differenzialdiagnose zeigt Tabelle 2.
Eine Differenzierung von Silikose, Sarkoidose und Tuberkulose gelingt bis auf seltene Fälle in der Computertomographie nach den oben beschriebenen Kriterien mit hinreichender Wahrscheinlichkeit.
Liegen scharf berandete noduläre Verschattungen mit perilymphatischer Verteilung mit einer Befundbetonung in den Mittelfeldern der Lunge und einer bevorzugten Ausbreitung entlang des axialen Interstitiums vor, ist in erster Linie an die Sarkoidose zu denken. Bei einer zufälligen Verteilung im Lobulus und einer Betonung in den Oberfelden ist eine Tuberkulose primär wahrscheinlich. Sind die Herde sowohl im Lobulus als auch in den Lungenfeldern zufällig verteilt, sind differenzialdiagnostisch in erster Linie Metastasen in Betracht zu ziehen.
Möglichkeiten zur Differenzierung der Lungenerkrankungen mit nodulärem Verschattungsmuster in der Computertomographie zeigt Tabelle 2.
In der Literatur werden seit 1956 immer wieder einzelne Fälle beschrieben, in denen Silikose und Sarkoidose histologisch gesichert nebeneinander auftreten (Hübener et al. 1986; Makol et al. 2011; Wieser u. Siegenthaler 1957).
Nach Literaturangaben (Hübener et al. 1986) bildet sich die Sarkoidose bei gleichzeitig an Silikose Erkrankten nicht spontan zurück. Eine sichere Unterscheidung der beiden Krankheitsentitäten gelingt in diesen Fällen rein bildmorphologisch nicht mehr.
Anzeigekriterien der Silikose als Berufskrankheit BK 4101
Anzeigekriterium für eine Silikose/Mischstaubpneumokoniose anhand der Thoraxaufnahme ist ein Streuungsgrad 1/1 nach der ILO-Klassifikation. In der Computertomographie kann eine Silikose/Mischstaubpneumokoniose ab einer Gesamtstreuung rundlicher Verdichtungen von mindestens 2 als gesichert angesehen werden, wenn eine Beteiligung beider Oberfelder vorliegt und eine perilymphatische/peribronchioläre Verteilung der Noduli besteht.
Eierschalenartige Lymphknotenverkalkungen können bei gesicherter Quarzstaubexposition sowohl in der Thoraxübersichtsaufnahme als auch im CT auch ohne das Vorliegen einer Parenchymerkrankung alleiniges Anzeigekriterium sein (Baur et al. 2016).
Einsatz radiologischer Untersuchungen
Nach den Empfehlungen der DGUV (2014) wird für arbeitsmedizinische Untersuchungen die Thoraxaufnahme nur in 1 Ebene im posterior-anterioren Strahlengang angefertigt. Da in der Thoraxübersichtsaufnahme alle im Strahlengang befindlichen Strukturen in einer Ebene summiert werden, resultiert insbesondere bei bestehendem Lungenemphysem oder einer kardialen Dekompensation ein hohes Maß an Fehleinschätzungen der Befunde (Remy-Jardin et al. 1992). Lediglich anhand der Thoraxaufnahme diagnostizierte, nach der ILO-Klassifikation gering gestreute Silikosen, lassen sich in der CT-Untersuchung häufiger nicht objektivieren. Hingegen erlaubt die Computertomographie als Schnittbildverfahren im Gegensatz zur Thoraxübersichtsaufnahme (Gevenois et al. 1994) durch die klare Abgrenzbarkeit insbesondere mikronodulärer oder gering gestreuter Läsionen die differenzialdiagnostische Zuordnung bzw. den Ausschluss einer Silikose mit weitaus größerer Sicherheit. Deshalb wird in der aktualisierten Fassung der Leitlinie (Baur et al. 2016, im Druck) vergleichbar zur Bochumer Empfehlung (DGUV 2011) insbesondere bei gering gestreuter Silikose im Rahmen der Erstbegutachtung eine Low-Dose-Volumen-CT als obligatorisch angesehen. Bei Nachbegutachtungen, wie auch im Rahmen der Vorsorge, besteht die Indikation zur Computertomographie lediglich dann, wenn sich ein wesentliche Änderung des Beschwerdebildes oder des Befundes in den Funktionsuntersuchungen bzw. der Thoraxaufnahme ergibt.
Die rechtfertigende Indikation zur Röntgenaufnahme wie auch der CT-Untersuchung ist insbesondere bei klinisch asymptomatischen Versicherten kritisch zu prüfen. Sowohl in der Leitlinie als auch in der Bochumer Empfehlung wird ausdrücklich darauf hingewiesen, dass das gesamte vorhandene Bildmaterial vor der Durchführung jeder weiteren radiologischen Untersuchung zu bewerten ist. Aus Gründen der Strahlenhygiene ist insbesondere zu beachten, das alle schon existenten CT-Untersuchungen der Lunge, auch die, die aus anderer Ursache angefertigt wurden, vor der Indikationsstellung zu einer erneuten CT-Untersuchung herangezogen werden. Erst wenn die Sichtung dieser Aufnahmen keine eindeutige Diagnose zulässt, kann die erneute Anfertigung einer leitlinienkonformen – BMI-adaptierten – Low-dose-Volumen-CT-Untersuchung empfohlen werden.
Literatur
Alper F, Akgun M et al.: CT findings in silicosis due to denim sandblasting Eur Radiol 200 8;18: 2739–2744.
Arakawa H, Honma K et al.: Pleural disease in silicosis: pleural thickening, effusion, and invagination. Radiology 2005; 236: 685–693.
Arakawa H, Johkoh T et al.: Chronic interstitial pneumonia in silicosis and mix-dust pneumoconiosis: its prevalence and comparison of CT findings with idiopathic pulmonary fibrosis. Chest 2007; 131: 1870–1876.
Barboza CEG, Winter DH et al.: Tuberculosis and silicosis: epidemiology, diagnosis and chemoprophylaxis. J Bras Pneumol 2008; 34: 961–968.
Baur X, Heger M et al.: Diagnostik und Begutachtung der Berufskrankheit Nr. 4101 Quarzstaublungenerkrankung (Silikose); S2-Leitlinie nach AWMF-Schema der Deutschen Gesellschaft für Pneumologie und Beatmungsmedizin und der Deutschen Gesellschaft für Arbeitsmedizin und Umweltmedizin. Update 2016, im Druck.
Bergin CJ, Müller NL et al.: CT in silicosis: correlation with plain films and pulmonary function tests. AJR AmJ Roentgenol 1986; 146: 477–483.
BMA: Merkblatt zur BK Nr. 4112. BArbBl 2002; 11: 64–65.
BMA: Wissenschaftliche Stellungnahme zu der Berufskrankheit Nr. 4112 der Anlage 1 zur Berufskrankheiten-Verordnung_„Lungenkrebs durch die Einwirkung von kristallinem Siliziumdioxid (SiO2) bei nachgewiesener Quarzstaublungenerkrankung (Silikose oder Siliko-Tuberkulose)“. Bek. des BMAS vom 5. Oktober 2015 – IVa 4 –45222-4112 – GMBl 2015; 61: 1199 ff.
DGUV: 9. Bochumer Empfehlung – Empfehlung für die Begutachtung von Quarzstaublungenerkrankungen (Silikosen). Redaktion: Dr. Andeas Kranig, Stefanie Palfner, Melanie Duell. DGUV 2011, www.dguv.de/publikationen
Bohlig H: Inhalationsschäden durch anorganische Stäube. In: Schinz (Hrsg.) Radiologische Diagnostik, 7. Aufl., Bd. 1, Teil 2: Lunge, Pleura, Thoraxwand. Stuttgart: Thieme, 1988.
Bouros D: Risk factors for idiopathic pulmonary fibrosis. Editorial. Pneumon 2013; 2: 117–119.
Caplan A, Cowen ED et al.: Rheumatoid pneumoconiosis in a foundry worker. Thorax 1958; 13: 181–184.
Calvert GM, Rice FL et al.: Occupational silica exposure and risk of various diseases: an analysis using death certificates from 27 states of the United States. Occup Environ Med 2003; 60: 122–129.
Chong S, Lee KS et al.: Pneumoconiosis: Comparison of imaging and pathologic findings. RadioGraphics 2006; 26: 59–77.
Cowie RL: The epidemiology of tuberculosis in gold miners with silicosis. Am J Respir Crit Care Med 1994; 150: 1460–1462.
Cox CW, Rose CS et al.: State of the Art: Imaging of occupational lung disease. Radiology 2014; 270: 681–696.
Doganay S, Gocmen H et al.: Silicosis due to denim sandblasting in young people: MDCT findings. Eurasian J Med 2010; 42: 21–23.
DGUV: DGUV Grundsätze für arbeitsmedizinische Untersuchungen, 6. Aufl. Stuttgart: Gentner, 2014.
DGUV: Statistiken für die Praxis 2014. Deutsche Gesetzliche Unfallversicherung e. V. (DGUV) Paderborn: Bonifatius
Gevenois PA, Pichot E et al.: Low grade coal worker’s pneumoconiosis. Comparison of CT and chest radiography. Acta Radiol 1994; 35: 351–356.
Gevenois PA, Sergent G et al.: Micronodules and emphysema in coal mine dust or silica exposure: relation with lung function. Eur Respir J 1998; 12: 1020–1024.
Hübener E, Kühne W et al.: Koinzidenz von Silikose und Sarkoidose, 2. Mitteilung: Zusammenhänge zwischen Silikose und Sarkoidose sowie gutachterliche Konsequenzen. Erkrank Atm Org 1986; 166: 186–193.
Hutyrová B, Smolková P, Nakládalová M et al.: Case of accelerated silicosis in a sandblaster. Industrial Health 2015; 53: 178–183.
Laney AS, Weissman DN: The classic pneumoconioses new epidemiological and laboratory observations. Clin Chest Med 2012; 33: 745–758.
Lopes AJ, Mogami R et al.: High-resolution computed tomography in silicosis: correlation with chest radiography and pulmonary function tests. J Bras Pneumol 2008; 34: 264–272.
Makol A, Reilly MJ et al.: Prevalence of connective tissue disease in silicosis (1985–2006) – a report from the state of Michigan surveillance system for silicosis. Am J Ind Med 2011; 54: 255–262.
Marchiori E, Souza CA et al.: Silicoproteinosis: high-resolution CT findings in 13 patients. Am J Roentgenol 2007; 189: 1402–1406.
Martins P, Marchiori E et al.: Cavitated conglomerate mass in silicosis indicating associated tuberculosis. Hindawi Publishing Corporation. Case Reports in Medicine Volume, 2010.
Meijer E, Tjoe Nij E et al.: Pneumoconiosis and emphysema in construction workers: results of HRCT and lung function findings. Occup Environ Medi 2011; 68: 542–546.
Müller K-M: Pleura. In: Doerr W, Seifert G (Hrsg.): Spezielle pathologische Anatomie. Band 16 Pathologie der Lunge. Berlin: Springer, 1983.
Müller K-M, Grewe P: Pathologie der Pneumokoniosen. Atemw Lungenkrankh 1992; 8: 428–436.
Nicol LM, McFarlane PA et al.: Six cases of silicosis: implications for health surveillance of stonemasons. Occup Med 2015; 65: 220–225.
Otto H, Breining H: Die Veränderung der Pleura bei Porzellanstaublungen. Beitr Path Anant 1961; 124: 361–375.
Otto H, von Hinüber G: Zur Häufigkeit des Emphysems, der Tuberkulose und des Bronchuskarzinoms bei Staublungenerkrankungen. Prax Pneumol 1972; 26: 145–158.
Parks C, Conrad K et al.: Occupational exposure to crystalline silica and autoimmune disease. Environ Health Perspect 1999; 107 (Suppl 5): 793–802.
Rafnsson V, Ingimarsson O et al.: Association between exposure to crystalline silica and risk of sarcoidosis. Occup Environ Med 1998; 55: 657–660.
Remy-Jardin M, Remy J et al.: Computed tomographic evaluation of silicosis and coal workers’ pneumoconiosis. Radiol Clin North Am 1992; 30: 1155–1176.
Remy-Jardin M, Degreef JM et al.: Coal worker’s pneumoconiosis: CT assessment in exposed workers and correlation with radiographic findings. Radiology 1990; 177: 363–371.
Rozenberg D, Shapera S: What to do with all of these lung nodules? Can respir J 2014; 21: e52–e54.
Rubin E, Weisbrod GL et al.: Pulmonary alveolar proteinosis: relationship to silicosis and pulmonary infection. Radiology 1980; 135: 35–41.
Saiyed HN, Tiwari RR: Occupational health research in India. Industrial Health 2004; 42: 141–148.
Schreiber J, Koschel D et al.: Rheumatoid pneumoconiosis (Caplan‘s syndrome). Eur J Int Med 2010; 21: 168–172.
Taeger D: Beziehung zwischen Lungensilikose und Lymphknoten-Silikose bei deutschen Uranerzbergarbeitern mit Lungenkrebs. Inaugural Dissertation 2011, Aus dem Institut für Community Medicine der Universitätsmedizin der Ernst Moritz Arndt Universität Greifswald.
Tioe Nij E, Heederik D: Risk assessment of silicosis and lung cancer among construction workers exposed to respirable quartz. Scand J Work Environ Health 2005; 31 (Suppl 2): 49–55.
Uehlinger E: Die akute Silikose des Sarganser Beckens. Pathologie und Bakteriologie 1949; 12: 150–157
Ulmer WT, Reichel G: Handbuch der inneren Medizin. 5. Aufl., Bd. 4 Atmungsorgane, 1. Teil Pneumokoniosen. Berlin: Springer, 1976.
Wieser C, Siegenthaler W: Ein ungewöhnlicher Fall von Silikose und gleichzeitigem Morbus Boeck der Lunge. Fortschr Röntgenstr 1957; 86: 723–727.
Zhang M, Wang D, Zheng YD, DU XY, Chen SY: Analyses on the characteristics and the trends of pneumoconiosis notified between 1997 and 2009, in China. Zhonghua Lao Dong Wei Sheng Zhi Ye Bing Za Zhi 2013; 31: 321–334.
Für die Verfasser
Priv.-Doz. Dr. med. Karina Hofmann-Preiß
Institut für bildgebende Diagnostik und Therapie (BDT)
Medizinisches Versorgungszentrum Erlangen (MVZ)
Wetterkreuz 21
91058 Erlangen-Tennenlohe
K.Hofmann-Preiss@bdt-erlangen.de
Interessenkonflikt: Die Autoren sind als Gutachter zur Thematik für Berufsgenossenschaften und Sozialgerichte tätig.
Fußnoten
1 Institut für bildgebende Diagnostik und Therapie (BDT), Medizinisches Versorgungszentrum Erlangen (MVZ)
2 Klinik für Radiologie (Chefarzt: Priv.-Doz. Dr. med. Jens Rodenwaldt), Klinikum Westfalen (Knappschaftskrankenhaus), Dortmund
3 Institut für Arbeitsmedizin und Arbeitsmedizin (Direktor: Prof. Dr. med. Thomas Kraus), Uniklinik RTW Aachen
Info
Übersicht: Immunologische Erkrankungen, die bei Silikose in der Literatur beschrieben werden
- Rheumatoide Arthritis (Caplan-Syndrom)
- Sklerodermie
- Systemischer Lupus Erythematodes
- Granulomatose mit Polyangiitis (Morbus Wegener)