Einleitung
In einer stetig alternden Gesellschaft sind degenerative Organerkrankungen häufiger zu erwarten und werden vielfach als unabdingbar altersbedingt angesehen. Dabei muss darauf hingewiesen werden, dass Altern und Degeneration verschiedenartige Mechanismen darstellen, die kein biologisches Kontinuum beschreiben.
Unter Altern soll verstanden werden die mit der Zeit physiologisch abnehmende Fähigkeit des Organismus, auf äußere Einflüsse zu reagieren und die erforderliche homöostatische Balance aufrecht zu erhalten. Altern auf den Gesamtorganismus bezogen „ist die progrediente Minderung der physiologischen Funktion, ein innewohnender altersbezogener Verlust der Vitalität und eine erhöhte Verletzbarkeit“. Auf die zelluläre Leistung bezogen ist „Altern ein progredientes Schrumpfen des homöostatischen Raumes durch genomische Instabilität, Brüchigkeit der Telomere, epigenetische Schäden, verminderte Syntheseleistung, mitochondriale Dysfunktion und verminderte interzelluläre Kommunikation“ (Lopez-Otin 2010). In allen Fällen liegt eine artentypische Lebensperiode zugrunde mit einer quantitativen Minderung der allgemeinen Vitalfunktionen.
Unter Degeneration soll – orientiert am lateinischen Begriff – eine Organminderwertigkeit verstanden werden, die über die altersphysiologisch geminderte Organfunktion hinaus den qualitativen Funktionsverlust beinhaltet. Merkmal der Degeneration ist der mit Narben- und Fettgewebe einhergehende Umbau eines Organs mit Verlust der spezifischen Zellen und des Gewebsverbandes, die durch geringer differenzierte Zellen aus dem Bindegewebe ersetzt werden. Diese Bindegewebszellen ersetzen die indigenen Organzellen mit der Folge einer Funktionsminderung, die dem Altersprozess ähnelt und zahlreiche Überschneidungen bietet. Degeneration aber mündet in einen qualitativen Funktionsverlust analog zum Verlust der organspezifischen Zellarchitektur und endet schließlich im Organversagen. So ist beispielsweise die Degeneration der Leber begleitet von einer progredienten Fibrose mit narbigem Umbau, der sich von pluripotenten Bindegewebszellen ableitet. Dabei wird bei der Degeneration die Form des Organs und dessen Stützfunktion mehr oder weniger erhalten, nicht aber dessen spezifische Funktion.
In der Orthopädie beinhaltet Degeneration beispielsweise den Ersatz der Bandscheibenknorpelzellen durch Narbengewebe, wobei das gesamte Bewegungssegment betroffen ist und die narbige Verfettung der regionalen Rückenmuskulatur einbezieht. Allerdings finden sich auch bei Hochbetagten vielfach gesunde Gelenksoberflächen, keine krankhafte Knorpelatrophie oder Veränderungen der kollagenen Matrix des Stützgewebes (Mohr 2000). Ein dem Lebensalter entsprechend normales oder über dieses hinaus gehendes Maß der Degeneration gibt es daher nicht; nach der Heidelberger Hundertjährigen-Studie weist nur etwa die Hälfte der Teilnehmer Arthrosen (ohne weitere Angaben nach Schwere und Lokalisation) auf (Jopp et al. 2016).
Die allgemeine Organdegeneration kann daher nicht einfach als eine „Linksverschiebung“ eines normalen Altersganges definiert werden, da die Biologie des normalen Alterns mit einer quantitativen Minderung der Organreserven einhergeht, nicht aber mit einem qualitativen Funktionsverlust unter narbiger oder fettiger Degeneration. Die in der Orthopädie populäre „Linksverschiebung“, als Vorverlegung mit dem Alter ohnehin sich einstellender Funktionsschäden, beispielsweise der Bandscheibendegeneration, geht auf Junghanns zurück. Dieser sah darin den Beleg für altersbezogene Schäden durch kumulierte biomechanische Einwirkungen. Allerdings beschrieb auch Junghanns einen im Alter steigenden Anteil Organgesunder, wofür er keine Erklärung bot (Junghanns 1968). Dies wird auch in anderen Untersuchungen bestätigt und bedeutet nichts anderes, als dass auch Organgesunde in der Orthopädie die höchste Lebenserwartung aufweisen (Goekoop et al. 2010).
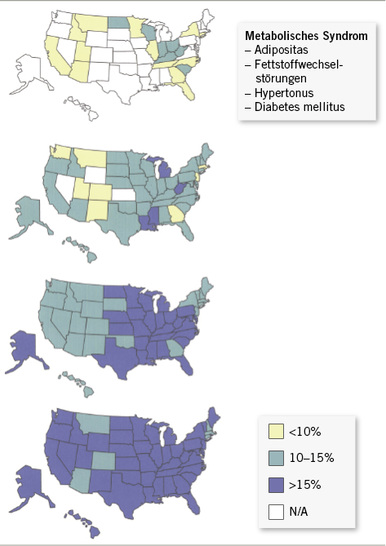
Der vorzeitige Funktionsverlust von Gelenken im Sinne degenerativer Arthrosen muss die biologischen Faktoren identifizieren, die nachhaltig die sehr stabilen Strukturen von Knochen und Knorpelzellen schädigen. Bedeutsame Hinweise bieten die Ergebnisse der neueren Epidemiologie zum Risikofaktorenkonzept, das im Metabolischen Syndrom zusammengefasst wird.
Neuere epidemiologische Studien zu Risikofaktoren und Organdegeneration
Neben biomechanischen Einwirkungen durch Arbeit, denen in manchen epidemiologischen Studien als Arbeit deklariert krankmachende Eigenschaften zugesprochen werden, gelten biomechanische Einwirkungen als Sport deklariert offenbar grundsätzlich als gesund. Ein wesenhafter Unterschied der einen und der anderen Einwirkung auf den Bewegungsapparat ist bislang nicht überzeugend belegt, vielmehr können im Profi- und Amateurbereich Belastungen vorliegen, die berufliche Anforderungen weit übersteigen. Auch Sport im Alter gilt als gesund und soll gerade degenerative Schäden am Bewegungsapparat verhindern helfen. Bislang fehlt allerdings jeder Beleg, dass Alterssportler einer biologisch unverwüstlichen Elite angehören sollen, denen Biomechanik offenbar nichts anhaben kann.
Eine der sehr wenigen wissenschaftlichen Untersuchungen an Hochbetagten ist die Leyden 85-plus Studie mit n = 82 „well-functioning“ Neunzigjährigen als Querschnittsstudie. Die Befragung führte zu Angaben, dass das Kollektiv vielfach körperlich belastende Berufe ausgeübt hatte und einen allgemein bewegungsorientierten Lebensstil verfolgte bis ins hohe Alter hinein. „Die vorliegende Studie zeigte unerwartet, dass eine Vorgeschichte mit schwerer beruflicher Arbeit positiv assoziiert war mit dem Fehlen einer Osteoarthrose und vielmehr mit der Bewahrung gesunder Gelenke. Weiterhin ergab die Analyse der Osteoarthrose nach Gelenksgruppen, dass die Vorgeschichte mit schwerer Berufsarbeit assoziiert war mit dem Fehlen von Arthrosen der Hand. Dieses gewiss überraschende Ergebnis, das im Gegensatz zur früheren Literatur steht, könnte erklärt werden durch das wahrscheinliche Vorliegen protektiver Faktoren“ (Goekoop et al. 2010, S. 5). Wie bereits auch von Junghanns zuvor bei der „Linksverschiebung“ beschrieben, beobachteten auch die Autoren der Leyden 85-plus Study ein Prävalenzplateau der Osteoarthrose, das jenseits des siebten Lebensjahrzehnts wieder abfiel. Mit anderen Worten: Die Faktoren, die mit der Gelenksgesundheit verknüpft sind, stehen offenbar auch mit der allgemeinen Lebenserwartung im Zusammenhang.
Die Verbindung von Faktoren des Lebensstils mit degenerativen Organschäden des Herz-Kreislauf-Systems findet im Konzept der Risikofaktoren eine plausible und weithin akzeptierte Erklärung. Von großer Bedeutung ist, dass die Gefäßschäden ubiquitär, wenn auch nicht stets in gleicher Ausprägung entstehen und mit dem westlichen Lebens- und Ernährungsstil verknüpft sind. So hat sich in den vergangenen Jahrzehnten Fettleibigkeit, Bluthochdruck und Diabetes mellitus im Erwachsenenalter stetig weiter und namentlich in die jüngeren Altersgruppen hinein explosionsartig ausgebreitet. Der Komplex gefäßschädigender Einwirkungen ist als Metabolisches Syndrom bekannt und für die allgemeine Volksgesundheit von größter Bedeutung ( Abb. 1).
Faktoren des Metabolischen Syndroms sind Hypertonie, Fettstoffwechselstörungen, Diabetes mellitus und Adipositas, denen sich „dosisabhängig“, d. h. nach dem Ausprägungsgrad, Organschäden zuordnen lassen. Die statistische Assoziation dieser Risikofaktoren ist reproduzierbar auch mit degenerativen Schäden des Bewegungsapparates assoziiert und führte zu der Forderung, die degenerative Arthrose in die definitorischen Kriterien des Metabolischen Syndroms aufzunehmen (Katz et al. 2010; Rahman et al. 2014; Kluzek et al. 2015; Shoeib et al. 2015). In einer stetig wachsenden Zahl von Studien lassen sich dabei für jeden einzelnen der Risikofaktoren Assoziationen zu prinzipiell sämtlichen Gelenkslokalisationen aufzeigen, die vielfach miteinander verknüpft sind; so gelten Fingergelenksarthrosen als Vorboten degenerativer Arthrosen der großen Gelenke der unteren Extremitäten. Der Begriff der Polyarthrose wird nachfolgend nicht wie im englischsprachigen Schrifttum auf die Polyarthrose der Fingergelenke beschränkt, deren Ursache in der Literatur bislang wesentlich als Rheumavariante verstanden wurde.
Von besonderer Bedeutung sind Beobachtungen in der Epidemiologie, dass sich in den vergangenen Jahrzehnten nicht so sehr die isolierten Arthrosen beispielsweise der HWS, der Hände usw. ausgebreitet haben, sondern sich vielmehr in bunter Mischung Arthrosen an verschiedenen Abschnitten des Bewegungsapparates beim einzelnen Individuum ausprägen. Ferner zeigt sich, dass sich Vielfacharthrosen (Polyarthrosen) in immer jüngere Alterskohorten hinein ausdehnen und weiteren Organdegenerationen desselben Individuums um viele Jahre vorausgehen können (Frank 2007). Dieses Phänomen der Multiorgandegeneration in immer jüngeren Alterskohorten hinein erfordert ein Konzept der Degeneration, das den gemeinsamen biologischen Mechanismus identifiziert, der die Organfunktion fundamental kompromittiert.
Von großem präventiven Interesse ist ferner, dass sich demonstrieren lässt, wie die Kontrolle der Risikofaktoren der Gefäßdegeneration zu einer Verlangsamung der Multiorgandegeneration auch in der Orthopädie führen: So führt eine Stoffwechselsanierung auch zu einer Minderung von Arthrosebeschwerden und geringerem Medikamentenbedarf (Bruyere 2015). Zu betonen ist ferner, dass sich die Risikofaktoren der Gefäßdegeneration nicht zufällig in der Bevölkerung verteilen, sondern klare schichtspezifische Verteilungsmuster aufweisen; dies spiegelt sich auch in der klar schichtspezifisch unterschiedlichen Lebenserwartung wider, die sich in den vergangenen Jahrzehnten keineswegs verringert hat (Frank 2007).
Wie funktioniert Degeneration an Gelenken, was ist das arthrogene Prinzip?
Zum Verständnis eines chronischen Krankheitsbildes unverzichtbar ist es, das Zusammenspiel des fundamentalen biologischen Dreigestirns von Gefäß, Zwischengewebe (Interstitium) und Zellen als konstruktives Grundprinzip des gesamten Tier- und Pflanzenreichs zu beschreiben. Allgemeiner Motor von Lebensprozessen ist das Konzentrationsgefälle metabolischer Produkte beziehungsweise von Druckunterschieden, die als rein physikalisches Phänomen vitale Stoffströme antreiben und einen Druckausgleich anstreben (Homöostase); Grundlage ist das allgemeine thermodynamische Gesetz (Entropie). Lebensprozesse können daher auch als das stetige Spiel aktiv erzeugter Konzentrationsunterschiede und deren passiver Ausgleich verstanden werden.
Seit Jahrzehnten ist bekannt, dass die wesentlichen pathologischen Veränderungen bei Arthrosen nicht im Gelenksknorpel beginnen, sondern lange zuvor in der Subchondralregion. Ferner ist durch Angiographien ebenfalls lange schon bekannt, dass der venöse Abfluss des Blutes aus dem Knochen am schwersten geschädigt ist mit einer lokalen Hypertonie, die sich von der venösen Kongestion im Knochen ableitet. Das ossäre Gefäßbild im Knochen entspricht der Chronisch Venösen Insuffizienz (CVI), die sich bei Varikosis an den unteren Extremitäten einstellt. Es findet sich auch im Knochen ein eigenartiges Nebeneinander von völlig verödeten Bezirken ohne regelrechte Kapillaren und strotzend blutgefüllten Sinusoiden (Blutseen), die funktionell einer schweren Ischämie entsprechen – das stagnierende Venenblut ist hyperton, hyperazid, hyperkapnisch und hypooxid (Brookes u. Revell 1998; Resnick 2002; Laroche 2002). Eine umfassende Beschreibung der als ossäre Vasosklerose anzusprechenden Veränderungen mit ausgeprägten Kalkherden der Venenwände findet sich beispielsweise bei Brookes u. Helal (1968), Arnoldi et al. (1972) und Esses u. Moro (1992).
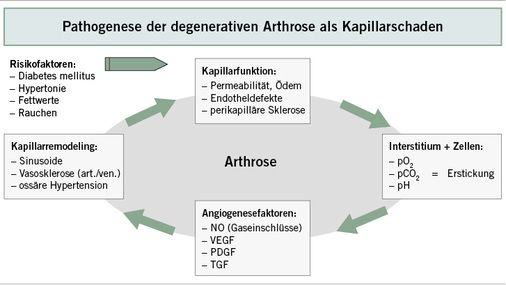
Das arthrogene Prinzip ist daher die chronische Stase des Venenblutes im Knochen, die eine Druckerhöhung in der Ausflussbahn zur Folge hat. Degenerative Veränderungen der arteriellen Gefäßbahn im Knochen sind dagegen weniger beeindruckend und beginnen mit pathologischen Leckagen der Gefäßendothelien und der Basalmembranen unter der nachhaltigen Wirkung der Risikofaktoren des Metabolischen Syndroms. Jeder der Faktoren ist geeignet, eine Kapillarfehlfunktion zu erzeugen und dies grundsätzlich auch in sämtlichen Stromgebieten. Paradigmatisch für die Wirkung der Risikofaktoren auf die Kapillaren sei auf die kapillardynamischen Untersuchungen zu Diabetes mellitus von Bollinger u. Fagrell verwiesen (1990).
Motor der allgemeinen Organdegeneration ist die Nivellierung des arteriovenösen Druckgefälles, das eine chronische Erstickungsreaktion des Zielgewebes auslöst. Der Beginn der Degeneration liegt auf Seite der arteriellen Kapillaren, deren pathologische Leckage einen Circulus vitiosus antreibt, der Zwischengewebe und Zielgewebe schädigt. Grund für die gerade auf der Ausflussbahn eindrückliche Gefäßpathologie ist das progrediente Versagen des Zwischengewebes (ICR) mit pathologischen Einlagerungen unlöslichen Amyloids. Dieses aggregiert spontan aus makromolekularen Eiweißfiltraten im chronisch aziden interstitiellen Milieu, d. h. nicht enzymatisch zu Amyloid, das schleierartige Kondensate bildet und die Transport- und Filterfunktion kompromittiert. Amyloid findet sich im subchondralen Interstitium degenerativ veränderter Gelenke (Bullough 2004) und als pathologische Ablagerungen auch im Knorpelzwischengewebe zu 100 % bei fortgeschrittenen Arthrosen nach Kellgren und Lawrence (Akasaki et al. 2015).
Das Modell der sog. Amyloid-Arthropathie beispielsweise bei dialysepflichtiger Niereninsuffizienz oder bei Multiplem Myelom muss daher auf Grundlage neuerer biochemischer Studien erheblich erweitert werden. Rheologische Untersuchungen deuten ferner darauf hin, dass die Vorstufen des Amyloids (A-SAA: akute Phase-Serum Amyloid A) durch die Gefäßwand diffundieren und im Zwischengewebe deponiert werden. Der Schritt löslicher Aggregate zu unlöslichem Amyloid vollzieht sich dann spontan im pathologisch sauren Milieu, da bereits die interstitiellen Aggregate proinflammatorische und katabole Wirkung mit chronischer Azidose erzeugen (de Seny et al. 2013; Akasaki et al. 2015).
Das Interstitium ist das Metaorgan im Körper, daher sind bei einer Kapillarfehlfunktion prinzipiell sämtliche Organe einbezogen. Bei intakter Funktion des Gefäßendothels und der Basalmembranen werden makromolekulare Eiweiße in der Gefäßbahn zurückgehalten. Bei Versagen der Kapillarschranke – paradigmatisch ist die Kapillarschädigung bei Diabetes mellitus – gelangen Makroproteine in das Zwischengewebe und bilden als sog. Beta-Faltblattfibrillen unlösliches Amyloid, das wie ein Schwamm im Zwischengewebe die Diffusion behindert. Da die beschriebene Pathologie für die Organdegeneration allgemein gültig ist und für die Plaquebildung auch im Gehirn verantwortlich zeichnet, sind chronisch entzündliche Prozesse aller Art geeignet, diverse Organamyloidosen zu erzeugen. So konnte bei einem Alzheimer-Modell im Tierversuch eindrucksvoll gezeigt werden, dass künstlich erzeugte Arthrosen zur Neuroinflammation und Ausprägung von A-Beta-Aggregaten mit großen unlöslichen Plaques im Gehirn führen. Von großem Interesse ist dabei, dass körperliche Belastung und Bewegung die proinflammatorische Kaskade und Plaquebildung im Zwischengewebe deutlich reduzieren konnte (Kyrkanides et al. 2011).
Notwendigerweise landen die von den Knorpelzellen freigesetzten Faktoren im venösen Kapillarschenkel und erzeugen dort eine chronische Kapillaritis, die die ossäre Ausflussbahn in der Muskulatur einbezieht. Folge ist ein völlig verwüstetes Gefäßbild ossär und extraossär im Sinne der chronisch venösen Insuffizienz, die z. B. als Verfettung der Muskulatur („Muskelpumpe“) imponiert. Diese Veränderungen werden beispielsweise in Höhe geschädigter Bewegungssegmente der Wirbelsäule praktisch nie vermisst, finden aber in der Regel keinen Eingang in die radiologische Befundung.
Anders als nach Verletzungen mit einer selbstlimitierten Kapillaritis mündet die Erstickungssituation in eine massive und dauerhafte angiogenetische Stimulation mit lokalen Entzündungskaskaden. Von großer physiologischer Bedeutung ist das praktisch völlige Fehlen lymphatischer Kapillaren im Knochen, so dass die in anderen Organen bedeutsame lymphatische Klärfunktion des Interstitiums einzig vom venösen Kapillarsystem im Knochen übernommen werden kann. Dies ist Grundlage des ossären Kompartmentsyndroms, das sich mit Mikrodrucksonden im Gelenk und im Zwischengewebe mit pathologisch erhöhten Druckwerten objektivieren lässt (Goddard u. Gosling 1988; Esses u. Moro 1992; Gosh u. Cheras 2001). Lokale Druckerhöhungen und Arthroseschmerzen stehen dabei in einem linearen Verhältnis. Chronische Ödembezirke im MRT als Folge der progredienten Stase im Knochen (KMÖ: Knochenmarksödem) fehlen daher als Marker des Drainageversagens bei degenerativen Arthrosen praktisch nie (Guangyi et al. 2013; Abb. 2).
Da die Risikofaktoren der Gefäßdegeneration vor keinem Stromgebiet des Bewegungsapparates Halt machen, finden sich prinzipiell alle Gelenke und Teile davon betroffen – beispielsweise die Bandscheiben –, mit einem beliebigen Bild biomechanisch „belasteter“ und „unbelasteter“ Gelenke. Die Kontrolle der Risikofaktoren mit Gewichtsreduktion, Optimierung der Blutfette, Einstellung des Hypertonus und eines Diabetes mellitus wirkt über die Sanierung der Kapillarfunktion und kann dem progredienten Gelenksaufbrauch entgegen steuern (Bruyere et al. 2015). Weitere Varianten entzündlicher Degeneration am Bewegungsapparat sind sog. Engpasssyndrome wie CTS, Tendinitis, Faszitis, Bursitis und Arthritis mit pathologischen Stoffwechselprodukten der Harnsäure und Sauerstoffradikalen. Auch solche „weichteilrheumatischen Störungen“ sind metabolischen Ursprungs und erfolgreich einer Stoffwechselsanierung zuzuführen. Eine von biomechanischen Vorstellungen abzuleitende Schonung vor chronisch-pathologischen Überlastungen der Gelenke ist bislang weder epidemiologisch noch pathologisch überzeugend belegt und als spätromantischer Mythos („Gelenke kaputt geschafft“) abzulehnen. Im Gegenteil ist heute – aus der Erfahrung abgeleitet – die gezielte Gelenksbelastung in Verbindung mit einer Stoffwechselsanierung eine wesentliche Grundlage moderner Behandlungsstrategien.
Kritisch muss in diesem Zusammenhang auch die Frage einer genetischen Ursache der Arthrose kommentiert werden. Bis heute lassen sich keine Argumente finden für einen wesentlichen genetischen Ursachenanteil; so fehlt ein genetisches Erklärungsmodell, wie normal entwickelte und über Jahrzehnte funktionierende Gelenke beim Erwachsenen ohne erkennbaren Anlass degenerieren sollen. In der Regel lassen sich „familiäre Vorbelastungen“ ebenso wenig demonstrieren, wie für genetische Erkrankungen gewöhnlich typische Befalls- oder Verlaufsmuster. Es findet sich auch kein genetisches Modell, das allein die Zeitdynamik der Ausbreitung von (Poly)Arthrosen in wenigen Jahrzehnten in der westlichen Welt und in stetig jüngere Alterskohorten hinein erklären könnte. Schließlich fehlt auch jeder Beleg, dass beispielsweise Alterssportler einer besonderen genetischen Elite angehören sollen, deren offenbar unverwüstlichen Gelenken allen biomechanischen Einwirkungen trotzen. Überdies verschwindet zunehmend die früher so stabil erscheinende Trennung rheumatischer und degenerativer Schäden am Stütz- und Bewegungsapparat und macht einer breiteren Sicht des Organversagens Platz auf Grundlage chronisch inflammatorischer Prozesse im Zwischengewebe (Gomez et al. 2011; de Seny 2013).
Komplexe zelluläre Signalpfade und Reaktionskaskaden im Rahmen der degenerativen Arthrose, wie RANKL, Zytokine, IGF, Metalloproteinasen usw., bilden daher nur die Biochemie der Erstickungsreaktionen im Zell- und Gewebsverband ab mit Kaskaden entzündlicher Aktivierungen (Sharma et al. 2013). Ohne Zweifel sind die möglichen biochemischen Reaktionsmuster genetisch vorgegeben, Indizien der Ätiologie sind diese ebenso wenig, wie Belege einer wesentlichen genetischen Ursache. Publikationen zum Thema lassen bisher greifbare Erkenntnisse vermissen und es besteht kein Anlass für Optimismus, dass die stete Wiederholung derselben genetischen Untersuchungen an immer größeren Kollektiven irgendwann einmal zu grundlegend anderen Ergebnissen kommen sollte. Stellvertretend für eine Vielzahl weiterer Untersuchungen: „Zusammenfassend vermerkt unser systematischer Review multiple genetische Polymorphismen, die mit der Entwicklung lumbaler Bandscheibendegeneration im Verbindung stehen; allerdings … bleibt das Evidenzniveau solcher Assoziationen schwach. Als solches stellt unser Review die Grenzen des aktuellen Status genetischer Assoziationen heraus zu Studien hinsichtlich lumbaler Bandscheibendegeneration“ (Eskola et al. 2012).
Aus dem Blickwinkel erworbener Gefäßschäden und einer progredienten Fehlfunktion des Zwischengewebes erscheint auch der Begriff der Disposition in einem neuen Licht. Hier finden endlich auch chronische biomechanische Einwirkungen ihren Platz, da beispielsweise durch berufliche Vibrationseinwirkung an den Händen pathologische Permeabilitätssteigerungen der Kapillarendothelien entstehen können mit chronischen interstitiellen Ödemen und Knochennekrosen (Berufskrankheit der Ziffer 2103: Mondbeintod u. a.). Die Magnetresonanztomographie (MRT) leistet dabei einen wesentlichen Beitrag mit der Darstellung chronisch-subchondraler und interstitieller Ödeme, die den funktionellen Zusammenbruch der Diffusion abbilden. Stattgehabte Traumen können so zu interstitiellen, extraossären Ödemen disponieren über den Verlust der lymphatischen Klärfunktion; hier findet auch der Begriff des Mikrotraumas durch Vibration mit Verlust interstitieller Lymphkapillaren seine Berechtigung. Der Nachweis von Mikrotraumen im Knochen steht dagegen noch immer aus, gedanklich liegt der biomechanischen Theorie gewissermaßen eine Miniaturisierung des Traumabegriffs zugrunde, die jedoch, in den Rang einer Arthrosetheorie gehoben, bisher versagt hat.
Beispiele degenerativer Arthrosen
Lange schon ist bekannt, dass Personen mit Varikosis der unteren Extremitäten und Ausbildung einer chronisch venösen Insuffizienz (CVI) eine erhöhte Neigung für Gonarthrosen und Arthrosen der Sprunggelenke mit kontraktem Spitzfuß aufweisen. Das arthrogene Prinzip ist die fortgeleitete Abflussstörung des Venenblutes aus dem Knochen, dieser wird „durchgestaut“. Das Krankheitsbild ist als phleboarthrotischer Komplex oder als venöses Kompartmentsyndrom bekannt (Hach 2001), anatomische Grundlage ist die sog. Venenpumpe, die über die Muskelbewegung die ossäre Zirkulation antreibt.
Mithilfe von Drainagelöchern (Pridie-Bohrungen) lassen sich Arthroseschmerzen spontan bessern. Dies ist ein bedeutsamer klinischer Beleg, dass sich der dreiphasige Arthroseschmerz von der ossären Hypertonie ableitet: Ruheschmerz bei lokaler ossärer Hypertonie, Anlaufschmerz und Besserung bei Bewegung (Aktivierung der Muskelpumpe) und Rückkehr der Schmerzen unter fortgesetzter Belastung (erneute Ödembildung im Knochen).
Bereits bei Jugendlichen lässt sich eine besondere Arthroseform beobachten, die zu schwerwiegenden Wachstumsstörungen führen: die idiopathische Skoliose in der Adoleszenz (AIS), die für 80–90 % aller Skoliosen verantwortlich ist. Die Verformung der Wirbelsäule folgt überaus monoton einer Rechtskonvexität der mittleren Brustwirbelsäule (ca. 90 % der Fälle). Minderformen der idiopathischen Skoliose finden sich bei etwa der Hälfte der Normalbevölkerung, die sehr viel geringeren Prävalenzen in der Literatur beziehen sich auf Verformungen der Wirbelsäule von 10° oder darüber. Diese Definition verstellt allerdings den Blick für das Wesentliche: die Häufung und die Monotonie der Veränderungen deutet auf ein konstruktives Problem, das mit der degenerativen Arthrose viel gemein hat. Die pathologisch-anatomischen Veränderungen an den Wachstumsfugen der Kinder und Jugendlichen lassen an einem Arthroseprozess keine Zweifel aufkommen, der sich bereits in der späten Kindheit als Degeneration der linksseitigen Wachstumsfugen einstellt. Die Fugen der rechten Seite funktionieren dagegen normal, die Rechtskonvexität der BWS ist die logische Konsequenz. Bislang fehlt jeder Beleg einer neurogenen oder biomechanischen Ursache der idiopathischen Skoliose, vergleichbar kritisch wird der Erfolg entsprechend orientierter Behandlungen in der Literatur beurteilt.
Die Gefäßentwicklung im Knochen und die der Venendrainage wurde in der Orthopädie bislang nicht systematisch untersucht und soll an dieser Stelle nur angedeutet werden. Bei symmetrischen embryonalen Gefäßanlagen von Arterien und Venen, entwickelt sich eine physiologische Linksdominanz der arteriellen Leitungsbahn (Aorta) und eine Rechtsdominanz der venösen (Vena cava superior und inferior); dies hat eine Reihe von Gefäßkreuzungen zur Folge, bei denen Venenblut von links nach rechts geführt werden muss, mit Engpasssyndromen, die mit spezifischen Krankheitsbildern der Rumpforgane verbunden sind – im Thorakalraum ist dies die idiopathische Skoliose.
Da sich diese Gefäßarchitektur bereits beim Säugling findet, nicht aber diese spezifische Form der Skoliose, muss die terminale Reifung der Gefäße in der Pubertät besonders beachtet werden. In der Embryogenese finden sich parallele Gefäßnetze, einerseits aus allseits vernetzten Kapillaren (Vaskulogenese) und ein erst in der Pubertät ausgereiftes organspezifisches Gefäßnetz (Angiogenese). Dieses ist diskret, d.h. die allseitige anastomotische Vernetzung fehlt gerade. Für die organspezifische Reifung der ossären Gefäßarchitektur gibt es angiographische, histologische und biochemische Indizien, die einen fundamentalen Verlust anastomosierender Kapillaren in der Pubertät belegen (Boos et al. 2002; Kusumbe et al. 2014). Erst dann wird die konstruktive extraossäre Abflussstörung zum Problem, da der alternative intraossäre Blutfluss beim Kind durch den Anastomosenverlust unterbunden wird. Nur so wird die Skoliosemanifestation in der Pubertät verständlich, arthrogenes Prinzip ist wiederum die Venenobstruktion an der mittleren BWS. Vergleichbares lässt sich ausführen für die Krankheitsdynamik des Morbus Scheuermann, die ebenso nur unter Kenntnis der Gefäßentwicklung im Knochen verständlich wird (Frank u. Kentner 2014).
An der unteren Lendenwirbelsäule findet sich ebenfalls eine chronische Abflussstörung des Beckenvenenblutes an der Kreuzungsstelle der Arteria communis und der Vena iliaca der linken Seite vor dem 5. LWK. Pathologische intimale Veränderungen der Iliakalvenen an der Kreuzungsstelle finden sich überaus häufig in der Normalbevölkerung, der chronische Rückstau des Venenblutes führt typischerweise zu fast immer nur links zu beobachtenden Beckenvenenthrombosen. Das Krankheitsbild ist als May-Thurner-Syndrom bekannt. Weitere Erkrankungen mit arteriovenösen Kollisionen im Abdominalbereich mit Obstruktion des Venenabflusses (Nutcracker-Syndrom, Pelvic Congestion Syndrome, Midline Congestion Syndrome etc.) finden sich anschaulich bei Scholbach (2014). Neuerdings werden auch chronisch-degenerative zentralnervöse Prozesse mit einer chronischen zerebrospinalen venösen Insuffizienz (CCSVI) in Verbindung gebracht und als Ursache beispielsweise der chronischen Enzephalopathie, der Multiplen Sklerose oder der Demenz vom Alzheimer-Typ diskutiert (Zivadinov u. Chung 2013).
Resümee
Zusammenfassend und mit Blick auf die Grundfunktionen des Lebens entspricht die Biologie der allgemeinen Organdegeneration einem irreversiblen Verlust der Diffusion. Diese nimmt ihren Anfang mit einer erworbenen Fehlfunktion der arteriellen Kapillaren, die unter der nachhaltigen Wirkung der Risikofaktoren zu pathologischen Leckagen für makromolekulare Eiweiße führen. Diese vernetzen spontan zu irreversiblen Fibrillen im Zwischengewebe (Amyloid), die die Filter- und Transitfunktion beeinträchtigen und damit die Versorgung des Zielgewebes kompromittieren. Sie reagieren mit der Freisetzung zahlreicher Angiogenesefaktoren, die notwendigerweise im venösen Schenkel landen und unter dem Bild einer unlimitierten Kapillaritis das Drainagesystem verwüsten (chronisch-venöse Insuffizienz).
Die Pathogenese der degenerativen Arthrose unterscheidet sich somit nicht grundlegend von Degenerativprozessen anderer Organsysteme und ist wesentlich häufiger als weitere zur Degeneration führende physikalische Einwirkungen wie Strahlung, Hitze oder Kälte. Chronische biomechanische Schäden sind dagegen bislang weder begrifflich noch pathophysiologisch hinreichend definiert und harren, wie auch die sog. biomechanische Theorie, seriöser wissenschaftlicher Belege. Einen biomechanischen Sonderweg der Organdegeneration in der Orthopädie gibt es daher nicht. Umso mehr muss es mit Blick auf die wenig überzeugenden Ergebnisse biomechanischer Studien in der Epidemiologie – zuletzt die mit großem Aufwand betriebene Deutsche Wirbelsäulenstudie – Wunder nehmen, welch große Bedeutung eine Erklärungsansatz ohne überzeugende biologische Bodenhaftung bei der Schöpfung neuer Berufskrankheiten erlangt hat.
LITERATUR
Brookes M, Revell MJ: Blood Supply of Bone. Springer Berlin, Heidelberg, New York 1998
Frank K, Kentner M: Ätiologie, Pathogenese und Begutachtung der anlagebedingten Wirbelsäulenveränderungen im Rahmen von BK 2108/2110. Fallbeispiel Morbus Scheuermann bei eineiigen Zwillingen. ASU 2014, 49: 198-206
Frank K: Degenerative Erkrankungen des Bewegungsapparates. Biomechanische Theorie, soziale Schicht und Metabolisches Syndrom. ASU 2007, 42: 262-273
Kluzek S, Newton JL, Arden NK: Is osteoarthritis a metabolic disorder? British Medical Bulletin 2015, 115: 111-121
Sharma AR, Jagga S, Lee S, Nam JS: Interplay between cartilage and subchondral bone contributing to pathogenesis of osteoarthritis. Int J Mol Sci 2013, 14: 19805-19830
Shoeib A, Badr R, El-Askari A: Metabolic syndrome associated arthropathy. Biolofe 2015, 3: 807-810
Die vollständige Literaturliste kann beim Autor oder beim Verlag angefordert werden.
Literaturempfehlung zum Thema
- Aktueller Wissensstand bei Grundlagen und nichtoperativen Maßnahmen wie ernährungsmedizinischen Strategien, Physio- und Sporttherapie, Medikamenten, intraartikulärer Arthrosetherapie, Naturheilkunde und Akupunktur.
- Überblick über die moderne operative Therapie mit gelenkerhaltenden Operationen, chondralen Rekonstruktionen und Endoprothetik
- Neues multidisziplinäres Therapiekonzept: Der Patient wird im Sinne einer Gelenkschule in ein individuell auf ihn abgestimmtes Programm eingebunden. Damit können Sie den Patienten besser über seine Erkrankung und die Therapiemöglichkeiten informieren, seine Compliance stärken und ihn zu einem eigenen Beitrag zur Therapie motivieren.
- Für Ärzte, Physio- und Sporttherapeuten
- Spezielle Bewegungsübungen für Arthrose-Patienten auf CD-ROM zum Ausdrucken