Einleitung
Die Leitlinie behandelt Hautschutz-, Hautreinigungs- und Hautpflegemittel (zusammengefasst als „berufliche Hautmittel“), die den Beschäftigten eines Betriebs im Rahmen eines integrativen Hautschutzkonzepts zur Prävention beruflich bedingter Hauterkrankungen vom Arbeitgeber zur Verfügung gestellt werden. Im Zusammenhang mit einem Hautarztverfahren oder einer Anzeige bei Verdacht einer Berufskrankheit können diese Mittel auch von Ärzten zu Lasten des jeweiligen Unfallversicherungsträgers verordnet werden.
Anders als bei Arzneimitteln, ist die Prüfung der Wirksamkeit von Hautschutzmitteln durch klinische Studien gesetzlich nicht vorgeschrieben. Hautmittel unterliegen der Kosmetik-Verordnung, die zwar für die ausgelobten Eigenschaften den Nachweis der Wirksamkeit fordert, die Art des Wirksamkeitsnachweises aber offen lässt.
In der Vergangenheit konnten häufiger Auslobungen von Hautschutzmitteln (z. B. „flüssiger Handschuh“) weder im Rahmen von Studien, noch in der praktischen Anwendung nachvollzogen werden. Auch die klassische Vorstellung, wonach hydrophile Hautschutzmittel (z. B. O/W-Emulsionen) grundsätzlich beim Umgang mit lipophilen Arbeitsstoffen und lipophile Hautschutzmittel (z. B. W/O-Emulsionen) grundsätzlich beim Umgang mit wässrigen Arbeitsstoffen besonders gut wirksam sind, kann als wissenschaftlich widerlegt gelten.
Unbestreitbar können jedoch die Anwendung von rückfettenden Hautexterna sowie die Durchführung einer schonenden Hautreinigung dazu beitragen, dass die Haut die Belastungen am Arbeitsplatz besser toleriert und sich bei eingetretenen Belastungen schneller regeneriert. Insbesondere bei häufigem Arbeiten im feuchten Milieu (Feuchtarbeit, hierzu TRGS 401) muss davon ausgegangen werden, dass subklinische Hautschäden entstehen, die durch die Anwendung von Hautmitteln positiv beeinflusst werden können.
Es ist aber nicht nur von akademischem Interesse zu wissen, ob Hautmittel die Haut schützen oder die Regeneration der geschädigten Hornschicht fördern, denn aus dem Wirkprinzip ergeben sich unterschiedliche Konsequenzen für die Prävention:
- Wahl des Hautmittels (entsprechend der Arbeitsstoffe oder des Hautzustands),
- Zeitpunkt der Applikation (vor oder nach der hautbelastenden Tätigkeit),
- Zielgruppe (Fokussierung auf Hautgesunde oder auf Arbeitnehmer mit Minimalläsionen der Haut),
- gesundheitspädagogische Empfehlungen („Schütze Deine Haut mit Hautmitteln“, „Schütze Deine Haut durch umsichtiges Verhalten und pflege sie“).
Aus einer Vielzahl von Gründen (Förderung der Compliance, Kosten-Nutzen-Analyse, potenzielle Risiken präventiver Maßnahmen) sollte darauf geachtet werden, dass in erster Linie solche präventiven Maß-nahmen empfohlen werden, deren Wirksamkeit wissenschaftlich belegt ist. Im Sinne einer evidenzbasierten Medizin müssen auch die präventiven Instrumente daraufhin überprüft werden, ob sie das leisten, was sie vorgeben und ob deren Nutzen größer ist als deren potenzielle Risiken.
Vor diesem Hintergrund sehen die Arbeitsgemeinschaft für Berufs- und Umweltdermatologie (ABD) in der DDG und die Deutsche Gesellschaft für Arbeits- und Umweltmedizin (DGAUM) die Notwendigkeit, eine Leitlinie zu Hautschutz, Hautpflege und Hautreinigung zu erstellen. Die hier vorliegende Leitlinie basiert auf dem gegenwärtigen wissenschaftlichen Erkenntnisstand, wie er sich derzeit aus der nationalen und internationalen Literatur ergibt. Die Leitlinie stellt eine überarbeitete und erweiterte Fassung der Leitlinie „Beruf-liche Hautmittel“ dar, die 2009 von der Arbeitsgemeinschaft Berufs- und Umweltdermatologie (ABD) herausgegeben wurde [1].
Die ebenfalls für bestimmte Berufsgruppen wichtigen Hautschutz-mittel, die gegen UV-Strahlung schützen und organische und/oder anorganische UV-Filtersubstanzen enthalten, werden in der hier vor-liegenden Leitlinie nicht behandelt und waren auch in der Vorgänger-leitlinie nicht enthalten.
1 Berufliche Hautschutzmittel – Definition, Einsatz und Anwendung
1.1 Allgemein
Unter beruflichen Hautmitteln werden in dieser Leitlinie Hautschutz-, Hautpflege- und Hautreinigungsprodukte für den beruflichen Einsatz verstanden und zusammengefasst. Im engeren Sinne werden unter dem Begriff „Hautschutzmittel“ äußerlich anzuwendende Produkte verstanden, die die Haut vor allem vor Irritationen schützen sollen (Protektion) [2, 3]. Geeignete Produkte sollen im Rahmen des Konzepts zum integrativen Hautschutz (auch als 3-Säulen-Modell bezeichnet) am Arbeitsplatz vor Arbeitsbeginn und während der Arbeit angewandt werden. Zu einem sog. „3-Säulen-Modell“ oder integrativen Hautschutz werden die Hautschutzmittel durch Hautreinigungsmittel, die Schmutz und aggressive Substanzen ohne größere Hautirritation (schonend) von der Haut entfernen sollen, sowie durch Hautpflegemittel, d. h. Produkte, die zur Wiederherstellung bzw. Regeneration der Hautbarriere (Pflege) beitragen können [4–6], ergänzt.
Aus Sicht der hautschutzmittelherstellenden Industrie werden unter dem Begriff „Hautschutzmittel“ jedoch nicht nur Produkte zur Verminderung potenzieller Irritationen durch Arbeitsstoffe verstanden, sondern auch Produkte, die z. B. eine erleichterte Reinigung der Haut durch die vorherige Anwendung eines Hautschutzmittels ermöglichen oder die eine Verminderung der durch übermäßige Schweißbildung verursachten Hautquellung bewirken und sich dadurch indirekt auf den Zustand der Haut bzw. der epidermalen Barriere auswirken sollen.
Im juristischen Sinne gelten berufliche Hautmittel als Kosmetika. Wie alle kosmetischen Mittel unterliegen sie der Kosmetik-Richtlinie der Europäischen Union (EU) (s. auch Abschnitt 3.1). Darüber hinaus sind berufliche Hautmittel auch als Bestandteil der Persönlichen Schutzausrüstung (PSA) nach der PSA-Benutzer-Richtlinie der EU anerkannt. Unter persönlichen Schutzmaßnahmen versteht man das Tragen von Schutzhandschuhen, die Anwendung von Hautschutz-mitteln vor der Arbeit, die Durchführung einer adäquaten Haut-reinigung sowie die Verwendung von Hautpflegemitteln zur Unterstützung der Regeneration der Haut nach der Arbeit. Persönliche Schutzmaßnahmen kommen entsprechend der Rangfolge der Präventionsmaßnahmen zur Anwendung, nämlich dann, wenn eine Ersatzstoffprüfung durchgeführt wurde und alle technischen und organisatorischen Maßnahmen ausgeschöpft worden sind. Eine sorg-fältige Analyse der Hautbelastung am Arbeitsplatz ist Voraussetzung für die richtige Auswahl von Hautschutzmaßnahmen. Maßnahmen zur Vermeidung von Hautschäden sollten der individuellen Einzelsituation angepasst werden [6, 7], wobei der Betriebsarzt und die Sicherheitsfachkraft mit einzubeziehen sind [8].
Der überwiegende Anwendungsbereich beruflicher Hautmittel liegt in der Verhinderung subtoxisch-kumulativer Kontaktekzeme (Synonym: irritatives Kontaktekzem). Diese entstehen vor allem an Arbeitsplätzen mit repetitiver Exposition gegenüber potenziellen Irri-tanzien und Feuchtarbeit. Da es einen engen Zusammenhang zwischen Irritation und der Entstehung von Sensibilisierungen gibt, der nicht nur durch eine erleichterte Penetration von Allergenen zu erklären ist, sondern auch durch den proinflammatorischen Stimulus der Irritation [9–11], kommt der Verhinderung von irritativen Kontakt-ekzemen eine besondere Bedeutung zu.
Bei bereits bestehender Sensibilisierung ist der Nutzen von Haut-mitteln in der Prävention des allergischen Kontaktekzems kritisch zu betrachten [12].
Beim Umgang mit korrosiven, toxischen, mutagenen oder kan-zerogenen Substanzen sind jedoch neben technischen und organi-satorischen Maßnahmen chemikaliendichte Schutzhandschuhe unverzichtbar und können nicht durch Hautschutzmittel ersetzt werden [6].
Der sog. „Handschutz“ (beruflich eingesetzte Handschuhe) wird in der vorliegenden Leitlinie nur bezüglich der potenziellen okklusi-ven Wirkung angesprochen.
Insbesondere beim Umgang mit hautresorptiven Substanzen ist der Einsatz von Hautmitteln kritisch zu bewerten, sofern nicht aus-geschlossen werden kann, dass durch sie die Aufnahme dieser Substanzen in den Organismus beeinflusst wird (s. Abschnitt 3.4.).
1.2 Hautschutz- und Hautpflegemittel
Von den Herstellern wird empfohlen, Hautschutzpräparate vor jeder Exposition mit hautirritativen Noxen sowie nach jeder Arbeitspause oder auch nach einem bestimmten Zeitraum (z. B. einer halben Arbeitsschicht) aufzutragen. Vor dem erneuten Auftragen sollte die Haut gereinigt und getrocknet werden, um ein verstärktes Eindringen von auf der Haut verbliebenen Irritanzien zu verhindern [4].
Die Wirksamkeit eines beruflichen Hautschutzmittels ist in der Regel an die Gesamtformulierung und nicht an einzelne Inhaltsstoffe geknüpft. Der wissenschaftliche Erkenntnisstand erlaubt für die Formulierung beruflicher Hautschutzmittel grundsätzlich unterschiedliche galenische Systeme (z. B. W/O-, O/W-, amphiphile und multiple Emulsionen, Suspensionssalben, Hydro- und Oleogele) [2]. Durch spezielle Inhaltsstoffe kann das Wirkspektrum eines Hautschutzmittels erweitert oder die Wirksamkeit einer Formulierung verstärkt werden [3]. Beispiele für solche Zusatzstoffe in Hautschutz-mitteln sind Perfluoropolyether [13, 14], Aluminiumchlorohydrat [15] und synthetische Gerbstoffe [15, 16], von denen die beiden letztgenannten vorrangig unter der Vorstellung der Abschwächung der Hornschichtquellung durch Schweiß empfohlen werden [17, 18]. Solche Inhaltsstoffe sind deshalb nur in Hautschutzmitteln, nicht aber in Hautpflegemitteln, die nach der Arbeit angewendet werden, sinn-voll. Umgekehrt sind manche Zusätze, die typischerweise in Hautpflegemitteln verwendet werden, für den Einsatz in Hautschutzmitteln nicht unbedingt geeignet. Dies gilt z. B. für Harnstoff, dessen potenzielle Penetrationsförderung eine Anwendung vor der Tätigkeit nicht empfehlenswert macht und der deshalb nur in Mitteln, die erst nach der Tätigkeit auf die Haut aufgetragen werden, sinnvoll ist. Die als sog. Hautpflegemittel nominierten Produkte sollen zur „Förderung der Regeneration“ der Haut eingesetzt werden. Ihre Anwendung wird für den Zeitpunkt nach Arbeitsende und nach Reinigung der Haut als notwendig angesehen. Eine besondere Bedeutung bei beruflich angewandten Hautpflegemitteln – im Sinne der Leitlinie – liegt in der barriereregenerativen Wirkung; allerdings liegen dazu noch keine einheitlichen bzw. standardisierte Testproto-kolle zum Nachweis der Selbigen vor (Näheres hierzu s. Abschnitt 2.2.1).
Lange Zeit nahm man an, dass zum Schutz gegen wassermisch-bare Noxen und bei Hautbelastung durch Feuchtarbeit ausschließlich auf lipophile Formulierungen wie W/O-Emulsionen oder Oleogele zurückzugreifen sei und dass umgekehrt bei Hautkontakt zu nichtwassermischbaren Arbeitsstoffen nur hydrophile Formulierungen wie O/W-Emulsionen oder Suspensionssalben wirksam seien. Auf In-vivo-Testverfahren basierende Wirksamkeitsprüfungen haben jedoch schon vor über 20 Jahren gezeigt, dass diese vereinfachende Einteilung keine Allgemeingültigkeit besitzt [19]. Die Wirksamkeit eines Hautschutzmittels kann daher nicht aufgrund einer theoretischen Be-trachtung des jeweiligen galenischen Systems beurteilt werden.
Des Weiteren ist es nicht möglich, die irritative Potenz lediglich anhand des pH-Wertes von Hautschutz- und Hautpflegemitteln (Leave-on-Produkte) zu erkennen. Es gibt zwar Untersuchungen, die auf eine mögliche Störung der Barrierefunktion durch Leave-on-Produkte mit relativ hohen pH-Werten hinweisen [20], eine direkte Überprüfung hat jedoch gezeigt, dass Leave-on-Produkte mit relativ hohen pH-Werten selbst bei vorirritierter Haut gut vertragen wurden [21].
Eine individuelle Überprüfung der Wirksamkeit von Hautmittel durch die unter Abschnitt 2.2 genannten Methoden ist somit Voraussetzung. Zusätzlich müssen aber zur Akzeptanzerhöhung aus dermatologischer und arbeitsmedizinischer Sicht Faktoren wie das Einziehvermögen und die Kompatibilität des verwendeten Präparats mit den beruflichen Tätigkeiten (z. B. Herabsetzung der Griffigkeit und des Korrosionsschutzes eines Werkstücks in der Metallverarbeitung) in Betracht gezogen werden.
Die Diskussion, ob eine, wie in dem sog. „3-Säulen-Modell“, speziell bei der Unterscheidung von Hautschutz- und Hautpflegemitteln dargestellte Abgrenzung der Einzelkomponenten mit Anwendung vor, während und nach der Arbeit gerechtfertigt ist, hält bis dato an. Dass eine nicht nur didaktisch-begriffliche Trennung sinnvoll ist, wird inzwischen allerdings durch aktuelle Untersuchun-gen gestützt, die zeigen konnten, dass der gleichzeitige bzw. zusätzliche Einsatz zu Hautschutzpräparaten oder der alleinige Einsatz von Pflegeprodukte die belastete Haut schützen und regenerieren können [3, 22]. Andererseits stellte der präexpositionelle Hautschutz in den bisherigen Untersuchungen den wichtigsten Bestandteil aller Maßnahmen dar und ließ sich durch reine Pflegemaßnahmen nicht ersetzen [22–25] (Details hierzu s. Abschnitt 2).
Insgesamt reichen die bisher vorliegenden Daten über das wech-selnde Zusammenspiel von Hautschutz- und Hautpflegeprodukten mit der Haut und den Irritanzien am Arbeitsplatz noch nicht aus, um seriös bewerten zu können, welche explizite mechanistische Wirkung von Hautschutz- und Hautpflegemitteln im Zusammenhang mit dem Schutz, der Stabilisierung und der Regeneration der epidermalen Barriere ausgeht.
1.3 Hautschutz unter Handschuhen
Da die Arbeitsplätze mit Handschuhanwendung [26–31] zunehmend an Bedeutung gewinnen, stellt sich die Frage, welche Rolle Hautschutzpräparate in diese Bereichen spielen könnten. Wenn Haut-schutzmittel zusammen mit Handschuhen angewendet werden, ist einerseits darauf zu achten, dass deren Schutzwirkung durch das verwendete Hautschutzmittel nicht beeinträchtigt wird [3], anderer-seits ist eine potenziell negative Beeinflussung der epidermalen Barriere durch Okklusion zu berücksichtigen. Da bisher okklusive Effekte auf der Haut experimentell nur schwer nachweisbar waren, ist eine Evaluierung einer positiven Wirkung bzw. Verminderung des Okklusionseffekts für dafür vorgesehene Präparate schwierig. Kürzlich konnte im Rahmen von experimentellen In-vivo-Studien nachgewiesen werden, dass eine für eine gewisse Dauer okkludierte Haut postokklusiv empfindlicher auf Detergenzienexposition reagiert [32]. Darauf aufbauende vergleichende Untersuchungen erbrachten keine überzeugenden Belege dafür, dass Hautschutzprodukte (bisherige Untersuchungen mit Gelen), die unter Handschuhen empfohlen werden, tatsächlich zu der von den Herstellern ausgelobten Barrierestabilisierung oder zur Reduktion der Schweißproduktion durch Zusatz von Aluminiumchlorohydrat und anderen adstringierenden und schweißreduzierenden Substanzen (z. B. Gerbsäuren) führen [33]. Zur Diskussion des Einsatzes von Aluminiumchlorohydrat siehe unter Sicherheitsbewertung (Abschnitt 3.1).
2 Hautmittel in der primären und sekundären Prävention berufsbedingter Hauterkrankungen – Wirksamkeitsnachweise
2.1 Einsatz und Bedeutung am Arbeitsplatz – epidemiologische Erkenntnisse
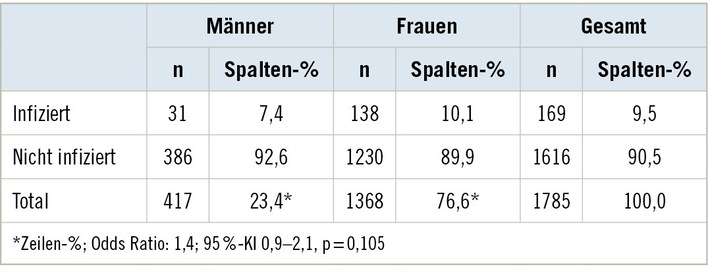
Beruflich bedingte Handekzeme weisen eine Inzidenz von 0,5–1 auf 1000 Berufstätige pro Jahr in Europa [34, 35] auf, wobei die Dunkel-ziffer um ein Vielfaches (mindestens 30- bis 50fach) höher liegt [36]. Die Prognose ist teilweise noch immer schlecht. Sowohl die sozioökonomische Last [37–39] als auch die starke Beeinflussung der Lebensqualität der Betroffenen scheint dabei erheblich, wie aktuelle Untersuchungen ergeben haben [40–43].
Berufsbedingte Hauterkrankungen stehen seit vielen Jahren an der Spitze der angezeigten Berufskrankheiten, wobei es sich dabei in über 90 % um Kontaktekzeme handelt, die fast alle an den Händen auftreten. Der Prävention (primäre, sekundäre und tertiäre) kommt somit eine hohe Bedeutung zu. 80 % der beruflichen Handekzeme treten in nur 7 Berufsgruppen/-gebieten auf. Es handelt sich hierbei um die Friseurbranche, die Metallverarbeitungsbranche, Gesundheitsberufe, bei Beschäftigten der Nahrungsmittelindustrie, im Baugewerbe, bei Malern und Reinigungsberufen [34].
In bevölkerungsbezogenen Untersuchungen bei Beschäftigten in verschiedenen Berufen liegt die 1-Jahres-Prävalenz weit über 10 % [44]. In einer prospektiven, epidemiologischen Untersuchung bei Auszubildenden in der Metallindustrie lagen die 1-Jahres-Prävalenz bei 9 % und die 3-Jahres-Prävalenz sogar bei 15 % [45], wobei in einer Nachbeobachtungszeit von 13 Jahren (Median) in sogar 30 % mindestens einmal ein Handekzem aufgetreten war [46]. Bei den-jenigen, bei denen bereits in der Ausbildung Handekzeme aufge-treten waren, persistierten die Handekzeme in 40 % nach der Aus-bildung [46].
In einer dänischen Untersuchung führten berufsbedingte Hand-ekzeme in 23 % innerhalb eines Jahres zum Verlust des Arbeitsplatzes, und in 20 % bestand längere Arbeitsunfähigkeit [47]. Die schlechte Prognose berufsbedingter Handekzeme wird auch in einer schwedischen 15-jährigen Follow-up-Studie belegt [48]: In nur 28 % war Abheilung eingetreten, 70 % berichteten über Krankheits-symptome im letzten Jahr, und 52 % hatten Hauterscheinungen mindestens während der Hälfte der Nachbeobachtungszeit von 15 Jahren.
Obwohl in den letzten Jahren die experimentellen Methoden zum Wirksamkeitsnachweis von Hautschutzmitteln ständig verbessert und um zahlreiche Methoden erweitert worden sind (s. Abschnitt 2.2.1), berücksichtigen In-vitro- und In-vivo-Methoden zum Wirksamkeitsnachweis von Hautschutzmitteln häufig nicht oder nur sehr eingeschränkt die tatsächliche Situation am Arbeitsplatz [8, 49, 50].
Unter Aspekten der evidenzbasierten Medizin gelten große ran-domisierte klinische Studien als qualitativ höchstwertigste Studien, wobei je nach Fragestellung epidemiologische Studien den gleichen Stellenwert haben oder sogar besser geeignet sein können [51]. Der Nachweis der Wirksamkeit von Hautmitteln im Rahmen epidemiologischer Studien ist aus methodischen Gründen schwierig. Die bis heute nur sehr wenigen Interventionsstudien, die zum Wirk-samkeitsnachweis von Hautmitteln in Betrieben durchgeführt wur-den, sind aufgrund ihrer kleinen Fallzahlen schwierig zu interpretie-ren [50]. Eine kontrollierte Studie zur Überprüfung eines Präventions-programms bei Feuchtarbeit wurde in verschiedenen Altersheimen in Kopenhagen durchgeführt [52, 53]. Es wurden einzelne Arbeits-plätze in verschiedenen Altersheimen zufällig einer Interventions-gruppe und einer Kontrollgruppe zugeteilt. In der Interventionsgruppe wurden ein Schulungsprogramm zur Hautschutzanwendung (richtiger Gebrauch von Handschuhen, richtige Händereinigung, richtige Anwendung von Händedesinfektions- und Hautpflegemitteln) durchgeführt und die entsprechenden Produkte zur Verfügung gestellt. Die Interventionsgruppe (n = 207) und die Kontrollgruppe (n = 168) wurden zu Beginn der Studie und fünf Monate später untersucht. Am Ende der Studie wurden in der Interventionsgruppe signifikant weniger Hautprobleme festgestellt als in der Kontrollgruppe. Außer-dem war die Interventionsgruppe bezüglich des Wissens über Hautschutzmaßnahmen und bezüglich hautbelastungsvermeidenden Arbeitens der Kontrollgruppe überlegen.
In einer anderen Interventionsstudie in einem metallverarbeiten-den Betrieb mit sehr hoher Hautbelastung konnte nach Etablierung eines Hautschutzprogramms das Auftreten arbeitsbezogener Hauterscheinungen, insbesondere Handekzeme, signifikant gesenkt wer-den [8]. Es konnte dabei ausgeschlossen werden, dass der Rück-gang der arbeitsbedingten Handekzeme durch die Änderung der Fertigungsprozesse verursacht wurde. Eine im Bereich der Mineralöl-industrie durchgeführte Pilotstudie zeigte ebenfalls, dass durch Einführung eines integrativen Hautschutzkonzepts die Häufigkeit des Auftretens von Handekzemen reduziert werden kann [54].
Klinische Studien, die die Wirksamkeit von Hautschutz- bzw. Hautpflegepräparaten belegen, prüfen in Abhängigkeit vom Untersuchungskollektiv entweder den primärpräventiven Aspekt (d. h. nur hautgesunde Beschäftigte werden eingeschlossen [15, 52, 53, 55, 56]) oder den therapeutischen Aspekt (d. h. die Beschäftigten haben bereits entweder Hautläsionen wie Erythem und Schuppung oder manifeste Hauterkrankungen wie Ekzeme und somit wird der sekundär- bzw. tertiärpräventive Aspekt von Hautschutz überprüft [57–63]).
Darüber hinaus gibt es eine Reihe von klinischen Studien, die die Akzeptanz und die korrekte Applikation von Hautschutzpräparaten untersuchen [64–66]. In anderen Untersuchungen wird der Stellenwert von Hautmitteln im Rahmen der sekundären Prävention insbesondere bei der Durchführung sog. Seminare zur sekundären Individualprävention dargestellt [67, 68]. Dabei wurde auch deutlich, dass der Erfolg eines Hautschutzprogramms nicht nur davon abhängt, dass die angebotenen Hautschutz-, Hautreinigungs- und Hautpflege-präparate aufeinander abgestimmt und entsprechend der individuel-len Arbeitsplatzbelastung ausgewählt sind, sondern auch davon, dass die Beschäftigten in geeigneter Weise über die angebotenen Hautschutzmaßnahmen informiert werden.
In einer rezenten kontrollierten Interventionsstudie wurde die Wirksamkeit des allgemein propagierten Hautschutzkonzepts unter-sucht [25]. An der Interventionsstudie nahmen 1020 freiwillige, arbeitsfähige, männliche Probanden teil. Per Randomisation wurden diese einer von insgesamt vier Maßnahmen zugeteilt. Jeder Proband wurde exakt 12 Monate nachbeobachtet. Insgesamt dreimal während der einjährigen Beobachtungsdauer wurden beide Hände mit Hilfe eines quantitativen Hautscores untersucht und ein standardisiertes Interview durchgeführt. Die Veränderungen des Hautscores nach 1 Jahr im Vergleich zum Ausgangsbefund wurden als primärer Outcome definiert. Arztbesuche und Arbeitsunfähigkeiten wegen eines Handekzems wurden als Surrogat für die Erkrankungsschwere im Beobachtungszeitraum erfasst. Nach 12 Monaten konnten 800 Probanden in die Auswertung einbezogen werden (78,4 % aller rekrutierten Probanden). Die Compliance, die randomisierte Maßnahme zu befolgen, hing von der jeweiligen Maßnahme ab und reichte von 73,7 % bis 88,7 %. Während in der Kontrollgruppe eine signifikante Verschlechterung des Hautbefunds zu verzeichnen war, war die größte und signifikante Verbesserung in der Gruppe zu beobachten, die Hautschutz- und Hautpflegemittel anwendeten. Am zweitbesten schnitt die alleinige Anwendung von Hautschutz ab.
Eine Arbeitsunfähigkeit wegen eines Handekzems innerhalb des Beobachtungszeitraums von 12 Monaten trat nur bei drei Probanden (0,4 %) auf, die tatsächlich komplett auf die Anwendung von Hautschutz- und Hautpflegepräparaten verzichteten.
Tabelle 1 fasst die wissenschaftlichen Belege für die Elemente Hautschutz und Hautpflege sowie für das Gesamtkonzept anhand klinischer Studien (Ausnahme: [69]) zusammen.
Hautschutzpräparate dienen vor allem der Prophylaxe kumulativ-toxischer Kontaktekzeme, einige aber auch der Verhütung sekundärer Hautprobleme durch das Tragen von Schutzkleidung sowie der Erleichterung der Handreinigung. Hautschutzpräparate sollen vor und während der Arbeit zum Schutz gegen spezifische Hautgefährdungen sorgfältig, d. h. auch in den Fingerzwischenräumen und an den Nagelbetten, aufgetragen werden. Die Schutzwirkung spezieller Hautschutzpräparate ist nicht gegen alle, sondern nur gegen einzelne Hautgefährdungen gerichtet. Es gibt kein Universalhautschutzmittel, sondern die Eigenschaften der Produkte müssen auf das physikochemische Profil der jeweiligen Noxe abgestimmt sein.
Beim Einsatz von Hautreinigungsmitteln ist zu beachten, dass auch bei Produkten mit vergleichbarer Reinigungswirkung gravierende Unterschiede in der Hautverträglichkeit bestehen können [81]. Daher ist die Auswahl eines geeigneten Hautreinigungsmittels be-sonders wichtig. Auswahl und Zusammensetzung der Hautreinigungs-mittel hängen grundsätzlich von der Art der Verschmutzung (einfach, grob, spezial) ab, wobei ein entsprechender Stufenplan in Abhängig-keit vom Verschmutzungsgrad beachtet werden sollte. Strikt zu vermeiden sind stark hautbelastende Reinigungsprozeduren mit technischen Reinigern, Bürsten oder Bimsstein sowie die Benutzung von Handreinigern mit stark abrasiven Zusätzen wie Sand oder Bimsmehl. Eine schonendere Hautreinigung kann mit einem erhöhten Zeitaufwand verbunden sein.
Die Hautpflege nach der Arbeit ist insbesondere dann ein wesent-licher Bestandteil der Präventionsmaßnahmen, wenn die Haut durch Wasser, Tenside, Fettlösungsmittel oder andere arbeitsbedingte Einflüsse ausgetrocknet wird.
Durch geeignete Pflegepräparate sollen der Haut in der arbeits- und damit in der belastungsfreien Zeit Lipidkomponenten, Feuchtigkeit und feuchtigkeitsbindende Substanzen zugeführt werden. So kann eventuell ein durch die Arbeitsbelastung erhöhter transepidermaler Wasserverlust als Hinweis für eine gestörte Barrierefunktion wieder normalisiert werden. Wenn es jedoch bereits zu einer stärkeren Schädigung der epidermalen Barriere gekommen ist, sind von pflegenden Maßnahmen nur noch geringe Effekte zu erwarten. Wich-tig ist es, dass dann die Wiederherstellung der Barrierefunktion mit Hilfe dermatologischer Maßnahmen möglichst vollständig erfolgt, da sonst sofort Rückfälle und Verschlimmerungen der Hauterkrankung zu erwarten sind.
2.2In-vitro- und In-vivo-Methoden zum Wirksamkeits-nachweis von beruflichen Hautmitteln
2.2.1 Wirksamkeitsnachweise von Hautschutz und Hautpflegemitteln
Goldstandard für den Wirksamkeitsnachweis beruflicher Hautschutz- und Hautpflegemittel sind Kohorten- und Interventionsstudien unter Berücksichtigung der tatsächlichen Arbeitsplatzsituation. Randomisierte, doppelblinde und kontrollierte Studien unter Einschluss eines Placebos sind dagegen unter den speziellen Arbeitsplatzbedingungen aufgrund organisatorischer und methodischer Schwierigkeiten und der benötigten Ressourcen nur schwer durchführbar [3, 50].
Die vorliegenden Interventionsstudien zielten nicht auf die Prüfung der Wirksamkeit einzelner Hautschutz- oder Hautpflegepräparate ab. Vielmehr wurde ein vollständiges Hautschutzprogramm unter Einbeziehung von Mitarbeiterschulungen, Optimierung der Arbeitsabläufe und anderer organisatorischer Maßnahmen untersucht [8, 24, 50, 60, 82]. Ergebnisse dieser Studien sind aufgrund kleiner Fallzahlen oder relativ kurzer Nachbeobachtungszeiten nur schwer zu interpre-tieren und daher nicht vergleichbar. In weite-ren Interventionsstudien wurde der Einsatz einer Kombination von präexpositionellem Hautschutz und postexpositioneller Hautpflege im Vergleich zu Verwendung nur ein-zelner Komponenten des integrativen Haut-schutzkonzepts („3-Säulen-Konzept“) über-prüft. In einer vierarmigen, randomisierten prospektiven Interventionsstudie an 1020 Metallarbeitern wurde eine Vielzahl von Betrieben mit Verwendung unterschiedlicher Hautschutz- und Hautpflegeprodukte einbezogen. In der Gesamtauswertung zeigte sich dabei eine signifikante Überlegen-heit der Kombination von Hautschutz und Hautpflege in Bezug auf Verbesserung des Hautzustandes, gefolgt von alleiniger Anwendung von Hautschutz [25] (Details hierzu unter Abschnitt 2.1). In einer ebenfalls vierarmigen Interventionsstudie an 1006 Beschäftig-ten im Baugewerbe zeigte sich die Kombination von Hautschutz und Hautpflege ebenfalls das beste Ergebnis [22]. Auch im Bereich der Sekundärprävention wurde im Rahmen einer dänischen prospektiven Interventionsstudie bei Krankenschwestern [26, 31], die bereits Handekzeme aufwiesen, eine Intervention durchgeführt (n = 255 – bei 123 erfolgte eine Intervention, 132 dienten als Kontrolle). Es konnte die Wirksamkeit eines Hautschutzprogramms mit Abnahme des Ekzemscores dokumentiert werden. Als Externum wurde vor, während und nach der Arbeit ein duftstofffreier „lipid-rich moisturizer“ eingesetzt. Eine prinzipielle und didaktische Unter-scheidung zwischen Hautschutz- und Hautpflege erfolgt in den meisten internationalen Studien bekanntlich nicht.
Als Ersatz zu Interventionsstudien kann die Wirksamkeit von einzelnen Präparaten in Modellexperimenten unter idealisierten Bedingungen geprüft werden. Dabei müssen die Prüfmethoden und das Studiendesign dem Anwendungszweck bzw. dem Wirksamkeits-anspruch des zu prüfenden Präparats angepasst werden. Während für die Wirksamkeitsprüfung beruflich verwendeter Hautpflegepräparate im Prinzip die gleichen Methoden eingesetzt werden können wie für sonstige Hautpflegemittel, die den Anspruch auf eine Stabilisierung bzw. Regeneration der Hautbarriere erheben, muss die Wirksamkeit von beruflichen Hautschutzpräparaten mit Methoden untersucht werden, die speziell für diese Produktklasse entwickelt wurden (Übersicht bei [2, 3]). Bei diesen Methoden sind prinzipiell In-vitro-, Ex-vivo- und In-vivo-Verfahren zu unterscheiden, die ein-zeln oder in Kombination eingesetzt werden [83–85]. Die Ergebnisse der verschiedenen Verfahren weisen eine unterschiedliche Wertigkeit auf, die berücksichtigt werden muss.
In-vitro- und Ex-vivo-Verfahren zum Wirksamkeitsnachweis von Hautschutzmitteln: Als In-vitro- und Ex-vivo-Verfahren zum Wirksamkeitsnachweis von Hautschutzmitteln wurden der Objektträgertest [86], Filterpapiermembrantests [84], Kammerpenetrationstests mit künstlicher Membran oder auch exzidierter Human- oder Tierhaut [87–89], Membrandiffusionstests [90], ein Mehrschichtmembranmodell [91], Absorptionsstudien an exzidierter Humanhaut [92], dreidimensionale Humanhautmodelle [93–100] sowie das Modell des isolierten perfundierten Kuheuters [101–103] beschrieben.
Studien, die auf der Bindung von Farbstoffmolekülen an der Haut nach vorheriger Auftragung von Hautschutzmitteln basieren, werden in vivo [104] oder an exzidierter Haut durchgeführt [16, 105–107]. Diese Verfahren können zwar Aufschluss über das Penetrationsverhalten geben, nicht jedoch über die zu erwartende Veränderung bezüglich einer Abschwächung des Irritationsverhaltens.
Insgesamt können die mit In-vitro-Methoden erhaltenen Test-ergebnisse nach derzeitiger Einschätzung nur orientierenden Charakter haben. Die Ergebnisse dieser Methoden können nur Teilaspekte einer möglichen Schutzwirkung aufzeigen, da physiologische Effekte in vivo wesentlich komplexer sind. Zudem sind die Methoden bislang nicht mit den In-vivo-Methoden korreliert worden und ihre Aussagefähigkeit zur Beurteilung der Wirksamkeit von Hautschutzmitteln ist somit sehr begrenzt. Dies gilt auch für die Ex-vivo-Modelle (hornschichtausbildende Keratinozytenkultu-ren, dreidimensionale Humanhautmodelle, perfundiertes Kuheuter-Modell), bei denen biochemische, immunologische und/oder morphologische Parameter mit untersucht werden. Diese können nur indirekt Aufschluss über die zu erwartende Wirksamkeit geben. Es können hier dermale Komponenten einer entzündlichen Reaktion wie die dermale Entzündungsreaktion mit Weitstellung der Gefäße und Einwanderung von Entzündungszellen nicht simuliert werden. Zudem handelt es sich hierbei ausschließlich um Verfahren mit meist kurzzeitiger/einmaliger Noxen-Exposition. Die erzielten Resultate sind daher nicht dazu geeignet, Rückschlüsse auf eine mögliche Schutzwirkung bei kumulativer Irritanzien-Expositionen zu ziehen.
Ungeachtet von ersten Anzeichen für eine Korrelation mit In-vivo-Daten [100–102] wurden diese Verfahren bislang ebenfalls noch nicht validiert und die Bedeutung für eine Schutzwirkung vor kumulativer Irritationswirkung in vivo ist gegenwärtig nicht belegt. Folglich sollte als Ersatz zu Interventionsstudien die Wirksamkeit von einzelnen Präparaten in Modellexperimenten unter idealisierten Bedingungen geprüft werden. Dabei müssen die Prüfmethoden und das Studiendesign dem Anwendungszweck bzw. dem Wirksamkeits-anspruch des zu prüfenden Präparates angepasst werden.
Zusammenfassend sollten Wirksamkeitsnachweise vorzugsweise durch In-vivo-Verfahren (z. B. repetitives Irritationsmodell) überprüft werden, falls Kohorten- und Interventionsstudien nicht durchführbar sind.
In-vivo-Verfahren zum Wirksamkeitsnachweis von Hautschutzmitteln: Wegen der ungeklärten bzw. eingeschränkten Aussagefähigkeit der Er-gebnisse von In-vitro- und Ex-vivo-Methoden sollte die Wirksamkeits-prüfung von Hautschutzmitteln durch Untersuchungen mit geeigneten In-vivo-Methoden entsprechend dem jeweiligen Stand der wissenschaftlichen Erkenntnis ergänzt werden. Dies gilt vor allem für die-jenigen Hautschutzmittel, die den Anspruch erheben, vor hautirritie-renden Arbeitsstoffen zu schützen. Für die Wirksamkeitsprüfung dieser Hautschutzmittel wurden spezielle Irritationsmodelle entwickelt. Aufgrund der Vielfalt der beruflichen Noxen und der Tat-sache, dass viele dieser Noxen aus ethischen und oft auch aus metho-dischen Gründen nicht in solche Modelluntersuchungen einbezogen werden können, wurden bereits in der Vergangenheit meist Standard-irritanzien (Natriumlaurylsulfat, Natronlauge, Milchsäure und Toluol) eingesetzt, die annäherungsweise als repräsentativ für Gruppen von Noxen mit unterschiedlichen Eigenschaften galten. Forschungs-stand ist, dass die unterschiedlichen Noxen aufgrund ihrer physikochemischen Charakteristika nicht nur zu unterschiedlichen Penetrationswegen oder Bindungen (Depotbildung) innerhalb der epidermalen Barriere der Haut führen, sondern auch zu unterschiedlichen Antworten der Haut auf das eindringende Agens [108–115].
Bei der Methodenauswahl ist repetitiven Irritationsmodellen auf-grund ihrer stärkeren Praxisnähe Vorrang vor Modellen mit nur einmaliger Applikation einzuräumen. Bei den repetitiven Modellen werden die zu prüfenden Produkte und die Irritanzien mehrfach über einen definierten Zeitraum entweder okklusiv [19, 115–119] oder offen im Rahmen von standardisierten Unterarmwaschungen [120, 121] appliziert.
In den vergangenen Jahren wurden repetitive Irritationstests vie-lerorts bereits als Standard etabliert, jedoch mit unterschiedlichen Protokollen. Es konnte gezeigt werden, dass bei geeigneten Testkonzentrationen und Applikationszeiten schon eine einwöchige repetitive Applikation von verdünnten Irritanzien ausreicht, um die Wirksamkeit von Hautschutzmitteln vergleichend untersuchen zu können [119, 122], was in einer verblindeten Multicenterstudie der Arbeitsgemeinschaft für Berufs- und Umweltdermatologie (ABD) bestätigt wurde. In dieser Studie wurde die Schutzwirkung mehrerer Standardrezepturen gegen Natriumlaurylsulfat und Toluol bei fünftägiger wiederholter Applikation im Bereich der Unterarme untersucht. Dabei zeigten sich hinsichtlich der irritationsabschwächenden Wir-kung Unterschiede zwischen den geprüften Formulierungen, die im gegenseitigen Vergleich in allen sechs teilnehmenden Zentren gleicher-maßen belegt und reproduziert werden konnten [118].
Zur Erfassung der irritativen Effekte werden neben der visuellen Beurteilung in praktisch allen Untersuchungen auch nichtinvasive bio-physikalische (hautphysiologische) Messverfahren eingesetzt. Dabei handelt es sich z. T. um experimentelle Methoden wie die Fourrier-transformierte Infrarot- (ATR-FTIR-)Spektroskopie [123] und die Laser-Scan-Mikroskopie [124] sowie die inzwischen breit eingesetz-ten Bioengineering-Techniken, die große Bedeutung in der Beurtei-lung von Barriereveränderungen und zur Quantifizierung von Entzündungsreaktionen am Hautorgan erlangt haben [125, 126]. Diese Verfahren basieren auf publizierten internationalen Guidelines [127–132] und sind zur standardisierten Prüfung der Wirksamkeit von Hautschutzmitteln geeignet, soweit sie relevante, reproduzierbare und valide Ergebnisse liefern [131, 133–135].
Die bislang in repetitiven Irritationstests geprüften Hautschutz-mittel waren meist nur gegen bestimmte Irritanzien oder ein Spektrum von Irritanzien mit ähnlichen physikochemischen Eigenschaften wirksam. Dies unterstreicht das Konzept des diversifizierten Haut-schutzes und zeigt, dass eine generelle Schutzauslobung proble-matisch ist. Die Aussagekraft der Ergebnisse von modellhaften Irritationstests ist zudem dadurch eingeschränkt, dass es am Arbeitsplatz oft zu komplexen Expositionen gegenüber sowohl hydrophilen als auch lipophilen Berufsstoffen kommen kann, die einzeln und/oder in Kombination hautschädigend einwirken können [3, 136, 137]. In solchen Fällen können Hautschutzmittel nützlich sein, die speziell für Arbeitsplätze mit komplexer oder wechselnder Schadstoffbelastung entwickelt wurden [3, 138].
Vor dem Hintergrund einer zuvor nicht erfolgten Methodenstandardisierung wurde 2013 im Rahmen eines Verbund-Forschungs-projekts von universitären Zentren die Entwicklung eines standardisierten Testverfahrens für Testungen gegen hydrophile Irritanzien in einer multizentrischen Studie abgeschlossen. In dieser Studie konnte die Transferfähigkeit der Methoden und die Reproduzierbarkeit von Ergebnissen in den Zentren belegt werden ( www.dguv.de/Projektdatenbank/0275/3111319v1.pdf – letzter Zugriff 20. 12. 2014). Das Irritationsmodell erlaubt eine gleichzeitige Prüfung mehrerer Hautschutzprodukte gegenüber 3 Kategorien wässriger Irritanzien, die in der Arbeitswelt eine besondere Bedeutung in der Entwicklung irritativer Kontaktekzeme zu haben scheinen. Hierbei wird ein 4-tägiges humanes in-vivo-repetitives Irritationsmodell an der Rückenhaut, in dem ein „Wirkindex“ anhand von Messungen des transepidermalen Wasserverlusts kalkuliert [127] wird, durch-geführt. Ein Vergleich zwischen Produkten und den bekannten Wirksamkeiten der Hautschutzreferenzmuster wird dadurch ermöglicht und so ein Qualitätsmaßstab etabliert. Die im Modell ap-plizierte Dosis wurde mit 3 mg/cm2 – nach neueren Erkenntnissen zur Auftragsmenge von Hautschutzprodukten unter Arbeitsbedingungen angenähert – und lag damit niedriger [139] als in der Mehrzahl der bisher publizierten experimentellen Studien zur Wirksamkeit von Hautschutzprodukten [19, 117, 118, 124]. Durch Schaffung von einheitlichen In-vivo-Prüfstandards sollten damit die Voraussetzungen einer Produktvergleichbarkeit und verbesser-ten Markttransparenz für Anwender von Hautschutzprodukten geschaffen werden.
Hautschutzmittel sollen nach Darstellung einiger Herstellern auch die Hautreinigung erleichtern. Eine solche Wirkung kann die Intensität und Häufigkeit aggressiver Hautreinigungsprozeduren vermindern helfen. Allerdings existieren bisher keine wissenschaftlichen Studien, die eine solche Wirkung bestätigen. Es ist wünschenswert, dass auch diese Auslobung künftig in geeigneten experimentellen Modellen positiv belegt wird.
Invasive In-vivo-Methoden am Menschen, wie das Verfahren der Mikrodialyse [140, 141] eignen sich noch nicht für vergleichende Wirksamkeitsprüfungen von Hautschutzmitteln. Mit diesen Methoden können jedoch Veränderungen der Penetration von Substanzen durch Hauschutzmittel sowie Veränderungen von Entzündungsparametern zwischen intakter und künstlich vorgeschädigter Hautbarriere untersucht werden, die zum Verständnis der Wirkmechanismen der Interaktion zwischen Noxen und Schutzprodukten beitragen (s. hier-zu auch Abschnitt 3.4).
In-vivo-Verfahren zum Wirksamkeitsnachweis von Hautpflegemitteln: Hautpflegemittel können neben einer Glättung der Hautoberfläche und einem subjektiven Pflegegefühl auch eine Erhöhung des Lipid- und des Wassergehalts der Haut bewirken. Derartige Effekte sollten gemäß der Leitlinie „Dermokosmetika zur Reinigung und Pflege trockener Haut“ der Gesellschaft für Dermopharmazie [142] mit biophysikalischen Prüfverfahren wie der Messung der Hautrauigkeit, des Feuchtigkeitsgehalts, des transepidermalen Wasserverlusts bzw. des Fettgehalts objektiviert werden.
Zur Prävention und Regeneration des irritativen Kontaktekzems liegen Studienergebnisse mit adäquatem Versuchsansatz vor [143]. Neben der Überprüfung der Wirksamkeit im Rahmen von Bioengine-ering-Studien an hautgesunden Probanden [144–147] wurden auch eine Vielzahl an Studien mit einem mehr praxisnahen Ansatz publiziert. Diese überprüften eher die Wirksamkeit von Pflegepräparaten auf verschiedene akute und kumulative Irritationsstimuli unter den Bedingungen einer täglichen Exposition [55, 148–154].
Neben einer barriereregenerativen Wirkung konnte auch eine protektive Wirkung für ein Hautpflegepräparat festgestellt werden [155]. Ob eine regelmäßige Pflege im Sinne der Prävention vor weiteren Irritationen wirklich schützt, wurde zunächst kontrovers diskutiert [73]. Kürzlich konnte gezeigt werden, dass nach einer Langzeit-anwendung (7 Wochen) und einer darauffolgenden Irritation mit Natriumlaurylsulfat in Abhängigkeit von der Rezeptur der Pflegemittel für einige eine Verminderung des irritativen Effekts eintrat [156].
2.2.2 Wirksamkeitsnachweise von Hautreinigungsmitteln
Eine adäquate berufliche Hautreinigung ist von Bedeutung für die Prävention beruflicher Hautkrankheiten. Die Hautreinigung ist dann als angemessen zu bezeichnen, wenn sie Irritanzien und Allergene effektiv und gleichzeitig hautschonend von der Hautoberfläche ent-fernt. Sowohl eine suboptimale Entfernung von Anhaftungen, als auch eine übermäßige Reinigungsprozedur können ihrerseits Haut-krankheiten, insbesondere das irritative Kontaktekzem, begünstigen. Bei der Produktauswahl für Hautreinigungsmittel sollte auf einen Nachweis der Wirksamkeit und der Hautverträglichkeit geachtet werden. Die Auswahl geeigneter Hautreinigungsmittel setzt aller-dings für den Anwender eine nachvollziehbare Produktprüfung voraus. Die Nachweisverfahren zur Wirksamkeit und zur Verträglichkeit sollten aus den Produktinformationen zu ersehen sein (s. hierzu auch Abschnitt 4, Dokumentation).
Die vielfältigen im beruflichen Umfeld vorkommenden Verschmut-zungen wurden zurückliegend wie folgt kategorisiert: wasserlös-liche Verschmutzungen (hydrophile Partikel, Farben auf Wasserbasis, Kühlwasser, Reiniger, Kleister, sämtliche Proteinverschmutzungen wie Körperflüssigkeiten und menschliche Sekrete), Öl- und Fettverschmutzungen einschließlich hydrophober Partikel, Pigment-verschmutzungen, kalkgebundene Verschmutzungen und Kalkablagerungen sowie mikrobielle Verschmutzungen. Für diese z. T. sehr unterschiedlichen Verschmutzungskategorien gab es in der Vergangenheit nur ansatzweise standardisierte Modelle zur Bewertung ihrer Wirksamkeit. Eine rationale Produktauswahl anhand von Daten aus kontrollierten Untersuchungen zur Reinigungswirkung war daher nur sehr eingeschränkt möglich.
In der Vergangenheit wurden zur vergleichenden Reinigungs-kraft von tensidhaltigen Hautreinigungsmitteln zunächst vorwiegend Untersuchungen mit Modellschmutzformulierungen auf der Basis von Farbpigmenten durchgeführt, bei denen sowohl klinische Be-urteilungsparameter als auch biophysikalische Messverfahren zum Einsatz kamen [157, 158]. Ferner wurden verschiedene kontrollierte Handwaschtests mit praxisnahen Modellverschmutzungen zur Prü-fung der Reinigungswirkung von reibe- und lösemittelhaltigen Haut-reinigungsmitteln beschrieben [84, 159, 160]. Zurückliegende Ansätze zu einer Standardisierung von Reinigungsmodellen bezogen sich in erster Linie auf den Waschvorgang, wobei Untersuchungen mit verschiedenen Materialien wie Schaumstoffrollern [157, 161], mit einem Bürstenmodell [136] sowie manuelle Waschtests vorgenommen wurden, die überwiegend am volaren Unterarm durchgeführt wurden. In den meisten dieser Untersuchungen wurden jedoch keine Handelspräparate, sondern einzelne Tenside, in erster Linie Natriumlaurylsulfat, getestet. Die Untersuchungen erstreckten sich zumeist über einen Zeitraum von 3, 5 oder 7 Tagen und waren damit insgesamt heterogen.
Die bisher dargestellten Modelle wiesen keine einheitlichen Prüf-kriterien auf. Daher fehlte eine geeignete Grundlage für Empfehlun-gen und für die Auswahl beruflicher Hautreinigungsmittel für Anwender. Im Rahmen einer Multicenterstudie bzw. Verbund-Forschungsprojektes wurden erstmals transferfähige Testverfahren für die Untersuchung der Wirksamkeit und Sicherheit beruflicher Haut-reinigungsmittel entwickelt ( www.dguv.de/medien/ifa/de/pro/pro1/ff-fp0276/AbschlussberichtFINAL02.pdf – letzter Zugriff am 21. 10. 2014). Das Projekt zielte auf eine Standardisierung und Normierung von Hautreinigungsmittel-Eigenschaften bei bestmögli-cher Adaptation an reale, berufliche Expositionsverhältnisse ab. Zunächst mussten arbeitsplatzbezogene Verschmutzungssituationen klassifiziert und dann repräsentative Modellschmutze entwickelt werden [162], gefolgt von korrespondierenden Modellhandreinigern und eines eigens für das Projekt konzipierten Hautwaschappara-tes [163, 164]. Es wurde dann monozentrisch eine reproduzierbare Methode zur Bestimmung der Reinigungswirkung dieser Standardreiniger bei den ebenfalls standardisierten Modellverschmutzungen erarbeitet, die dann auch multizentrisch evaluiert wurden [165, 166]. Die Ergebnisse der Wirksamkeits- und Sicherheitstestung konnten dadurch erstmals zueinander in Bezug gesetzt werden. Die Testverfahren eignen sich künftig für eine standardisierte Prüfung be-ruflicher Hautreinigungsmittel im Vergleich zu den entwickelten Modellhandreinigern und sollen zu einer besseren Produkttransparenz beitragen.
3 Berufliche Hautmittel – Sicherheitsbewertung und unerwünschte Wirkungen
3.1 Sicherheitsbewertung in der Kosmetologie
Berufliche Hautmittel im Sinne dieser Leitlinie sind in Deutschland rechtlich als Kosmetika reguliert. Kosmetika sind nach der Verordnung (EG) Nr. 1223/2009 des Europäischen Parlaments und des Rates vom 30. November 2009 definiert als „Stoffe oder Gemische, die dazu bestimmt sind, äußerlich mit den Teilen des menschlichen Körpers (Haut, Behaarungssystem, Nägel, Lippen und äußere intime Regionen) oder mit den Zähnen und den Schleimhäuten der Mundhöhle in Berührung zu kommen, und zwar zu dem ausschließlichen oder überwiegenden Zweck, diese zu reinigen, zu parfümieren, ihr Aussehen zu verändern, sie zu schützen, sie in gutem Zustand zu halten oder den Körpergeruch zu beeinflussen“ [167]. Von der Bundesrepublik Deutschland wurde die europäische Kosmetik-Gesetzgebung im Lebensmittel-, Bedarfsgegenstände- und Futtermittelgesetzbuch vom 01. 09. 2005, zuletzt geändert durch Art. 1 V vom 28. 05. 2014, umgesetzt.
Anders als Arzneimittel werden Kosmetika nicht in einem Zulassungsverfahren geprüft, sondern sie können vom Hersteller frei in den Verkehr gebracht werden, soweit die gesetzlichen Rahmenbedingungen eingehalten werden. Diese werden ganz wesentlich bestimmt von Artikel 3 der Verordnung (EG) Nr. 1223/2009, der fordert, dass die „auf dem Markt bereitgestellten kosmetischen Mittel bei normaler oder vernünftigerweise vorhersehbarer Verwendung für die menschliche Gesundheit sicher sein müssen“ [167].
Um die Sicherheit der kosmetischen Produkte zu gewährleisten und deren Überwachung zu ermöglichen, stellt die verantwortliche Person vor dem Inverkehrbringen eines kosmetischen Mittels sicher, dass das kosmetische Mittel eine Sicherheitsbewertung auf Grundlage der maßgeblichen Informationen durchlaufen hat und ein Sicher-heitsbericht für das kosmetische Mittel erstellt worden ist.
Von der verantwortlichen Person ist nach Artikel 11 eine Produkt-informationsdatei zu führen, die folgende Informationen enthält: vom Hersteller den zuständigen Behörden zu Kontrollzwecken fol-gende Informationen (sog. Produkt-Dossier) leicht zugänglich zu machen:
- eine Beschreibung des kosmetischen Mittels, die es ermöglicht, die Produktionsinformationsdatei eindeutig dem kosmetischen Mittel zuzuordnen;
- den Sicherheitsbericht für das kosmetische Mittel;
- eine Beschreibung der Herstellungsmethode und eine Erklärung zur Einhaltung der guten Herstellungspraxis;
- wenn dies aufgrund der Beschaffenheit des kosmetischen Mittels oder seiner Wirkung gerechtfertigt ist, den Nachweis der für das kosmetische Mittel angepriesenen Wirkung;
- Daten über jegliche vom Hersteller, Vertreiber oder Zulieferer im Zusammenhang mit der Entwicklung oder der Sicherheitsbewertung des kosmetischen Mittels oder seiner Bestandteile durchgeführten Tierversuche, einschließlich aller Tierversuche zur Erfüllung der Rechtsvorschriften von Drittländern.
Die Bewertung der Sicherheit des Fertigerzeugnisses für die mensch-liche Gesundheit ist mittlerweile detailliert vorgeschrieben; der Bericht hat zu enthalten:
- quantitative und qualitative Zusammensetzung des Erzeugnisses,
- physikalische/chemische Eigenschaften und Stabilität des kosme-tischen Mittels,
- mikrobiologische Qualität,
- Verunreinigungen, Spuren, Informationen zum Verpackungsmaterial,
- normaler und vernünftigerweise vorhersehbarer Gebrauch,
- Exposition gegenüber dem kosmetischen Mittel,
- Exposition gegenüber den Stoffen,
- toxikologische Profile der Stoffe,
- unerwünschte Wirkungen und ernste unerwünschte Wirkungen,
- Informationen über das kosmetische Mittel,
- Schlussfolgerungen aus der Bewertung,
- Warnhinweise auf dem Etikett und Gebrauchsanweisungen,
- Begründung,
- Qualifikation des Bewerters.
Diese Vorschrift hat weitreichende Konsequenzen für die Sicherheits-bewertung von beruflichen Hautmitteln. Diese Mittel werden nämlich nicht nur von Personen mit gesunder und wenig empfindlicher Haut angewandt, sondern auch von Personen mit besonders empfindli-cher und nicht selten vorgeschädigter oder gar manifest erkrankter Haut. Selbst wenn der Hersteller die Anwendung auf vorgeschädig-ter oder erkrankter Haut durch einen Warnhinweis ausdrücklich aus-schließen sollte, ist eben diese Anwendung vernünftigerweise vorhersehbar; es ist daher der Beweis zu erbringen, dass das Hautmittel auch unter diesen Bedingungen sicher ist. Unter regulatorischen Aspekten ist zu hinterfragen, ob für die Anwendung von Hautmitteln auf vorgeschädigter oder erkrankter Haut mit der Intention einer kon-kreten Krankheitsprävention diese nicht sogar als Medizinprodukte zugelassen sein sollten.
Vorgaben zur Sicherheitsbewertung von kosmetischen Inhaltsstoffen hat das Scientific Committee on Consumer Safety (SCCS), das im Auftrag der EU-Kommission tätig ist, vorgelegt; diese werden regelmäßig aktualisiert [168] ( ec.europa.eu/health/scientific_committees/consumer_safety/docs/sccs_s_004.pdf ).
Im Allgemeinen kann nach Ansicht des SCCS die Sicherheits-bewertung eines kosmetischen Fertigprodukts auf Basis der Kenntnisse der Toxizität seiner Bestandteile durchgeführt werden. In besonderen Situationen kann nach Ansicht des SCCS jedoch ein Test des fertigen Produkts wissenschaftlich und ethisch erforderlich sein zur Bestätigung der „Kompatibilität“ des Kosmetikums und der Erfüllung der Erwartungen an das Produkt. Eine prädiktive Testung sensibilisierender Kosmetikbestandteile am Menschen sollte nach Auffassung des SCCS aus ethischen Gründen nicht vorgenommen werden [169].
In besonderen Fällen sind jedoch für die Sicherheitsbewertung zusätzliche Kenntnisse über das Endprodukt erforderlich. Als Beispiele werden vom SCCS genannt: Kosmetika für spezifische Konsumentengruppen (etwa Babys, Personen mit empfindlicher Haut) und das Vorhandensein von Bestandteilen, die die Hautpenetration und/oder die Hautirritation fördern können.
Diese Kriterien treffen zweifelsfrei für berufliche Hautmittel zu, so dass für diese eine besondere Sicherheitsbewertung für das Endprodukt zu fordern ist. Eine Bewertung allein aufgrund der Inhaltsstoffe ist nicht ausreichend. Im Rahmen dieser Bewertung sind die Hautpenetration und die Hautirritation bei typischer Belastung an Arbeitsplätzen und die Verwendung der Produkte durch Personen mit empfindlicher oder vorgeschädigter Haut zu überprüfen. Die Vorgängerinstitution des SCCS, das Scientfic Committee on Consumer and Non-Food Products (SCCNFP), hat für den Nachweis der Sicher-heit bezüglich Irritation durch Kosmetika detaillierte Empfehlungen gegeben [169].
Eine Sicherheitsbewertung für Aluminiumchlorohydrat-haltige (5 %) Hautschutzcremes wurde in einer aktuellen Stellungnahme (Stellungnahme Nr. 007/2014 des BfR vom 26. Februar 2014 [170]) durchgeführt. Das Bundesinstitut für Risikobewertung (BfR) hat sich dafür ausgesprochen, neben der weitaus überwiegend über die Nahrung erfolgenden Aufnahme von Aluminium auch die aus Kosmetika zu begrenzen, obgleich ein kausaler Zusammenhang von er-höhter Aluminiumaufnahme und dem Auftreten von Brustkrebs bzw. der Alzheimer-Krankheit bisher wissenschaftlich nicht belegt ist [170]. Es bezog sich dabei insbesondere auf die perkutane Aufnahme von Aluminium aus Antitranspiranzien, verwies jedoch auch auf Hautschutzmittel. Die Berechnungen zur Hautpenetration bzw. perkutanen Aufnahme von Aluminium wurde aufgrund einer singu-lären In-vitro-Franz-Kammer-Diffusionsuntersuchung mit Antitrans-piranzien (Penetrationsrate = 5,9 %) durchgeführt [171]. In einer In-vivo-Untersuchung mit Biomonitoring an freiwilligen Probanden wurde jedoch dagegen eine um Faktor 12 geringere Penetrationsrate (Penetrationsrate 0,014 %) gemessen [172], so dass hier noch Klärungsbedarf besteht. Untersuchungen über die perkutane Pene-tration von Aluminiumsalzen aus Hautschutzmitteln liegen bis dato nicht vor.
Ein freiwilliger Verwendungshinweis („Nicht auf verletzter Haut“) wird diskutiert.
3.2 Sensibilisierungen durch Inhaltsstoffe beruflicher Hautmittel
In der Literatur finden sich überwiegend Einzelfallbeobachtungen zu Sensibilisierungen durch Hautmittel und nur eine jüngere große Übersicht, die auf Daten des Informationsverbunds Dermatologischer Kliniken (IVDK) beruht [173]. Problematisch ist, dass Hautmittel nicht selten (erst) auf befallener Haut angewendet werden [174]; die theoretischen Risiken für die Induktion von Sensibilisierungen durch Hautmittel sind dadurch erhöht.
In der Praxis besteht die Schwierigkeit häufig darin, die Exposi-tion auf Hautmittel von anderen Expositionen des täglichen Lebens abzugrenzen. Ein weiterer Grund, warum verlässliche epidemiologische Daten zu dem Thema bisher fehlen, ist die Tatsache, dass es keine systematischen Analysen von Produkttestungen bei Exponierten gibt. Diese wären auch sehr aufwändig; bei Verdacht auf eine Sensibilisierung sind in der Regel neben nativen Produkttestungen Aufschlüsselungstestungen der Inhaltsstoffe erforderlich. Hierbei können die gesetzlich vorgeschriebenen INCI-Deklarationen hilfreich sein, nicht immer sind sie jedoch für Testungen ausreichend spezifisch (z. B. Duftstoffe außerhalb der Liste der 26 seit März 2005 deklarationspflichtigen Substanzen).
Die angesprochene Analyse des IVDK [173] hat das Dilemma zu lösen versucht, indem Sensibilisierungshäufigkeiten in einem Kollektiv von 670 Patienten mit aktuellem berufsbedingtem Handekzem aus Risikoberufen und anamnestischem Verdacht auf Auslösung durch Hautmittel Vergleichsgruppen mit andersartigen Anamneseprofilen gegenübergestellt wurden (Gesamtkollektiv: 88 504; folgende Berufe, bei denen regelhaft beruflicher Kontakt zu diversen Externa unabhängig von Hautmitteln im eigentlichen Sinne besteht, waren vorher ausgeschlossen worden: Friseure, Kosmetiker, Altenpfleger, med. Bademeister). Dabei fanden sich im Zielkollektiv signifikante Risikoerhöhungen für Duftstoffe (Duftstoff-Mix, Eichenmoos absolue, Isoeugenol, Perubalsam), bestimmte Konservierungsmittel (Methyldibromoglutaronitril, Chlormethylisothiazolinon/Methyl-isothiazolinon) und Propolis. Bei Salbengrundlagen wie Wollwachsalkoholen und Amerchol L 101 war keine nennenswerte Risikosteigerung zu beobachten.
Die Autoren empfahlen, bei beruflichen Hautmitteln auf eine auch an allergologischen Gesichtspunkten orientierte Auswahl der Inhaltsstoffe zu achten. Eine kürzliche Marktanalyse von 64 Hautschutz-, 99 Hautreinigungs- und 30 Hautpflegepräparaten von 9 großen Herstellern mit ca. 60 % Marktanteil in Deutschland [175] kam zu dem Ergebnis, dass tatsächlich sowohl bei der Konservierung (überwiegend Parabene und Phenoxyethanol), als auch bei den Grundlagen (besonders Cetylstearylalkohol) insbesondere auf Substanzen zurückgegriffen wurde, die trotz häufigen Einsatzes eher selten Sensibilisierungen hervorrufen. Erstaunt hat allerdings, dass das Konservierungsmittel Bronopol relativ weit verbreitet war; diese Substanz wird angesichts steigender Sensibilisierungsquoten für den Einsatz in Hautmitteln von den Autoren infrage gestellt. Durch den in letzter Zeit beobachteten deutlichen Anstieg der Sensibilisierungen gegen Chlormethylisothisazinolon/Methylisothiazolinon (CMI/MI) [176] ist die Verwendung dieser Substanzen in Hautmitteln nicht empfehlenswert. Dies gilt auch für den alleinigen Einsatz des gemeinhin als weniger allergen eingestuften MI, weil es bei Verwendung in der gegenwärtig zulässigen Höchstkonzentration bei alleiniger Anwendung wahrscheinlich sogar die Hauptursache für den starken Anstieg der Testreaktionen auf das Gemisch CMI/MI ist. Der SCCS (Wissenschaftlicher Ausschuss für Verbrauchersicherheit) – als unabhängiger Ausschuss der Europäischen Kommission – empfiehlt in seiner aktuellen Stellungnahme von 2014, dass MI nicht mehr in Leave-on-Produkten wie Hautschutz/pflege eingesetzt werden sollte.
71 % der Produkte waren aus Gründen der Anwenderakzeptanz parfümiert. Die Datenlage erlaubt hier das Postulat, dass bei der Aus-wahl durch die Hersteller strikt auf die Meidung von Duftstoffen mit hohem Sensibilisierungspotenzial bzw. hohen Sensibilisierungsraten in der Bevölkerung (Hydroxyisohexyl 3-cyclohexencarboxaldehyd [z. B. Lyral®], Baummoos, Eichenmoos absolue, Hydroxycitronellal, Isoeugenol, Zimtaldehyd, Farnesol; [177] geachtet werden muss.
Leider ergibt sich dadurch, dass neuerdings 26 Duftstoffe in der EU deklarationspflichtig geworden sind, nicht zwingend eine Verbesserung im Verbraucherschutz. Die Hersteller könnten auf bis-her nicht namentlich deklarationspflichtige Duftstoffe ausweichen, deren allergologische Risiken noch weitgehend unbekannt sind und die bisher in Testbatterien nicht erfasst werden [177, 178]. Dies könnte auch für die Formulierung von beruflichen Hautmitteln zukünftig ein Problem darstellen. Wünschenswert wäre hier, dass Hersteller, die auf eine Parfümierung nicht verzichten wollen, aus den 26 deklarationspflichtigen Duftstoffen diejenigen mit den geringsten Sensibilisierungsraten auswählen (Übersicht bei [178]) sowie bei Verwendung von Duftstoffen diese auch auf freiwilliger Basis zu benennen. Insbesondere bei vorgeschädigter Haut sollte der Einsatz von Duftstoffen in Hautschutzmitteln nach Möglichkeit unterbleiben.
3.3 Mögliche irritative Effekte durch berufliche Hautmittel
3.3.1 Hautschutz- und Hautpflegemittel
Humanexperimentelle Untersuchungen haben gezeigt, dass zum Zwecke der Abschwächung von Irritationen eingesetzte Hautschutz-mittel im ungünstigsten Fall oder im Einzelfall auch zu einer Verstärkung der Irritation führen können [117]. Dabei ist es denkbar, dass dies an einer irritativen Wirkung des Hautschutzmittels selbst liegen könnte – in Abhängigkeit von der Zusammensetzung – oder, dass über den Weg einer Penetrationsverstärkung oder verstärk-ten Bindung der Noxe innerhalb der Haut diese Phänomene auftreten.
Im Tiermodell konnte z. B. gezeigt werden, dass die Verwendung eines Hautschutzprodukts die Irritation durch Kühlschmiermittel verstärken kann [179]. Auch gegenüber Toluol wurde in einer Untersuchung die Verstärkung der Irritation durch eines der Prüfpräparate festgestellt [122]. In einer randomisierten doppelblinden Studie mit repetitiven Irritationstest an Probanden wurden ebenfalls eine Irritationsverstärkung bei 2 von 6 untersuchten Hautschutzprodukten gegenüber dem lipohilen Irritans n-Octan und bei einem Hautschutzprodukt gegenüber Cumol festgestellt [180], so dass die Anwendung von Hautschutzprodukten bei Umgang mit Lösungsmitteln problematisch scheint. In In-vitro-Diffusionszellenuntersuchungen konnte eine verstärkte Penetration durch Hautschutz im Zusammenhang mit Lösungsmittel nachgewiesen. Die Diffusions-zelle als In-vitro-Methode wird von der Wissenschaft und Kontroll-behörden zur Quantifizierung der Hautpenetration akzeptiert. Diffusionszellstudien ergaben Hinweise darauf, dass die Penetration von hydrophilen und lipophilen Lösungsmitteln durch die mit Hautschutzcremes vorbehandelte Humanhaut nicht reduziert [92, 181], sondern gefördert wurde [181–185]. Theoretisch könnte die beobachtete o. g. verstärkte Irritation auch durch eine erhöhte Penetra-tion erfolgt sein.
Auf die Bedeutung des pH-Wertes von Hautschutz- und Hautpflegemitteln wurde bereits an anderer Stelle eingegangen (s. Abschnitt 1).
Es gibt ebenfalls Hinweise dafür, dass die Anwendung von sog. „Moisturizern“ zu einer erhöhten Empfindlichkeit der epidermalen Barriere gegen Irritanzien führen kann [72, 73, 186–189]. Da eine klare Abgrenzung zwischen beruflich eingesetzten Hautpflegemitteln und „Moisturizern“ zurzeit nicht existiert, müssen auch diese Befunde in Betracht gezogen werden. Es fehlen auf diesem Gebiet Studien, die die Penetrationsmodulation von Berufsstoffen bzw. beruflich relevan-ten Irritanzien im Zusammenspiel mit zuvor aufgebrachten „Moisturizern“ untersuchen. Für einzelne Modellirritanzien, wie Natrium-laurylsulfat, liegen solche Studien bereits vor [72, 73, 186, 187].
3.3.2 Hautreinigungsmittel
Die Entfernung von Schmutzpartikeln führt nahezu zwangsläufig auch zu einer Alteration von epidermalen Funktionen und u. U. auch zu irritativen Reaktionen [190]. Die irritative Wirkung ist davon abhängig, wie intensiv (mechanisch) bzw. wie lange das Reinigungsmittel auf die Haut einwirken muss, um die Haut in erwünschter Weise zu reinigen. Die Reinigungswirkung steht umgekehrt proportional in Beziehung zur Verträglichkeit – ist die Reinigungswirkung unzureichend, können irritative Effekte auch dadurch verstärkt werden, dass der Anwender solange wäscht, bis die Haut aus seiner Sicht sauber ist.
Die Studienlage zum Irritationspotenzial von Hautreinigungsmitteln ist uneinheitlich. Es wurden vereinzelt standardisierte Testmodelle verwendet [161, 191] oder Einteilungskriterien bezüglich der irritativen Wirkung von Hautreinigungsmitteln erstellt. Diese wurden nur teilweise für beruflich verwendete Hautreiniger erhoben [81, 192] und ansonsten zumeist für Mittel, die im Privatbereich oder zur hygienischen Handreinigung im Gesundheitssektor verwendet werden [193, 194]. Ein prädiktives In-vitro-Verfahren (Corneosurfametrie [195], das zur vergleichenden Einschätzung des Irritationspotenzials von Reinigungsprodukten entwickelt wurde [196], hat sich bisher noch nicht in breitem Umfang durchgesetzt. Für In-vivo-Untersuchungen werden standardisiere Waschtests [157, 158, 161, 191], ein Pflastertest [191] sowie ein Gebrauchstest eingesetzt [191]. Im Rahmen der bereits erwähnten Multicenterstudie wurde versucht, der Koppelung der beiden Parameter Rechnung zu tragen [166] (s. Abschnitt 2.2.2).
Nach bisherigem Kenntnisstand ist die irritative Potenz aus chemischer Sicht vor allen Dingen vom eingesetzten Detergenztyp (an-ionisch, kationisch, amphoter, nonionisch) bzw. deren kombinierten Einsatz [197–199] abhängig. Für einige Einzelsubstanzen, die in Hautreinigungsmitteln eingesetzt werden, wurden Sicherheits-einschätzungen vorgenommen [200–203].
Welche Rolle im Verhältnis dazu der pH-Wert für die Hautverträglichkeit von Hautreinigungsmitteln spielt, ist nicht bekannt. Aus früheren Studien geht hervor, dass ein alkalischer pH-Wert zu einer stärkeren Hautschädigung über eine stärkere Hornschichtquellung führen soll als ein neutraler oder saurer pH-Wert [20, 197, 204–207].
Die Irritabilität des Reinigungsvorgangs mit einem Hautreiniger ist somit eine Funktion aus der Verträglichkeit der Inhaltsstoffe, speziell der gewählten Detergenzien und Abrasiva, (vielleicht) des pH-Werts, der Dauer und mechanischen Intensität des Reinigungsvorgangs als solchem und möglicher anderer unbekannter (z. B. konstitutioneller) Faktoren.
3.4 Beeinflussung der Penetration von Fremdstoffen durch Hautschutzmittel
Das intakte Stratum corneum bildet die eigentliche Barriere gegen eine dermale Penetration von chemischen Stoffen. Erst wenn das Stratum corneum durchdrungen wurde, kann ein Stoff resorbiert werden [89]. Ansonsten können vor allem kleine Moleküle auch über die Haarfollikel in die Haut gelangen [208]. Das Prinzip der transfollikulären Penetration wird derzeit insbesondere im Zusam-menhang mit der Applikation von Nanopartikeln intensiv untersucht.
Zur Prüfung der Wirksamkeit von Hautschutzmitteln werden zahlreiche Methoden eingesetzt (s. Kap. 2.2). Humanstudien mit ex-ponierten Arbeitnehmern im Feld oder Probanden im Labor sind dabei generell aussagekräftiger als Tierversuche. In-vitro-Versuche mit Humanhaut scheinen geeigneter als solche mit Tierhaut [89, 209–212]. Versuche mit Keratinozytenkulturen oder anderen Membranen lassen angesichts der Komplexität der epidermalen Bar-riere kaum Aussagen zur Penetration von Fremdstoffen durch die menschliche Haut zu.
Eine Interventionsstudie an Arbeitsplätzen mit Biomonitoring-Untersuchungen (Nachweis von Fremdstoffen oder deren Metabolite) zeigte, dass die Arbeitnehmer, wenn sie hydrophile Hautschutzcremes vor der Exposition gegenüber polyzyklischen aromatischen Kohlenwasserstoffen (PAH) angewendet hatten, höhere Belastungen aufwiesen als an Arbeitstagen ohne Anwendung von Hautschutz [213]. Bei Arbeitnehmern in der Gummiindustrie, die gegenüber kan-zerogenen aromatischen Aminen exponiert waren, wurde ebenfalls eine positive Assoziation der inneren Belastung und der Häufigkeit der Anwendung von Hautschutzmitteln vor und während der Arbeit gefunden [184]. Die Applikation von Hautpflegemitteln nach der Arbeit reduzierte demgegenüber die innere Belastung.
In experimentellen Studien mit freiwilligen Probanden lassen sich Störfaktoren dieser Art im Allgemeinen besser kontrollieren als in Feldstudien. Bei Untersuchungen mittels Mikrodialyse wurde keine Änderung der Penetration von Butoxyethanol durch die gesunde Haut gefunden [140, 184, 214]. Dieses Ergebnis steht in Übereinstimmung mit Kammerversuchen anderer Autoren [181]. Nach quantitativer Re-duzierung des Stratum corneum mittels „tape stripping“ wurde die Penetration von Butoxyethanol allerdings signifikant verzögert [140, 214].
Zur Beeinflussung der Resorption von hochmolekularen Aller-genen aus Latexhandschuhen finden sich zwei widersprüchliche Publikationen: In einem Expositionsversuch bei Probanden mit ge-sicherter Latexallergie zeigte sich nach Applikation einer Hautcreme häufiger eine Quaddelbildung als ohne Hautschutz [215]. In einem zweiten Experiment mit einem anderen Hautschutzmittel (wohl auch mit anderen Latexhandschuhen) fanden sich dagegen weniger aller-gische Reaktionen [216]. Die Widersprüchlichkeit der Ergebnisse wird in der zweiten Arbeit jedoch nicht diskutiert, und es bleibt unklar, ob die Probanden der zweiten Studie teilweise dieselben Testpersonen waren wie in der ersten Studie.
Die Diffusionszelle als In-vitro-Methode wird von der Wissenschaft und Kontrollbehörden zur Quantifizierung der Hautpenetration akzeptiert. Diffusionszellstudien ergaben Hinweise darauf, dass die Penetration von hydrophilen und lipophilen Lösungsmitteln durch die mit Hautschutzcremes vorbehandelte Humanhaut nicht reduziert [92, 181], sondern in der Regel gefördert wird [181–185].
Eine Penetrationsbeschleunigung von Schwefelkohlenstoff durch die an entsprechenden Arbeitsplätzen eingesetzten Hautmittel wurde auch mittels Mikrodialyseuntersuchungen mit exzidierter Human-haut in vitro nachgewiesen [217]. Das häufig postulierte Wirksamkeits-prinzip, wonach W/O-Emulsionen vor der dermalen Aufnahme von wässrigen und O/W-Emulsionen vor der Aufnahme von fettlöslichen Gefahrstoffen schützen, konnte in Diffusionszellexperimenten an Humanhaut nicht bestätigt werden [182–184]. Diese Untersuchungs-ergebnisse bestätigen die Empfehlungen seriöser Hautschutzmittelanbieter, wonach Hautschutzmittel nur zum Schutz der Haut und nicht zum Schutz vor der perkutanen Aufnahme systemtoxischer Arbeitsstoffe verwendet werden sollten.
Kritisch zu diskutieren sind ältere Studien an Labortieren [218]. Diese zeigten eine Penetrationsverminderung von Gefahrstoffen nach vorheriger Applikation von z. T. silikonhaltigen Hautschutzcremes. Silikonhaltige Hautschutzcremes sind jedoch für den beruflichen Bereich nicht geeignet, da Silikonverbindungen aufgrund ihrer bekann-ten Trennwirkung zu Störungen der betrieblichen Arbeitsabläufe führen können.
Studien mit Stoffen, die das Stratum corneum kaum zu durchdringen vermögen [104] oder bei denen die Hautpenetration nicht quan-tifiziert wurde [105], sind zur Beurteilung der Penetrationsbarriere durch Hautschutzcremes ebenfalls wenig aussagekräftig. Studien, bei denen als Untersuchungsmaterial durch Erhitzen gewonnenes Stratum corneum und Epidermis eingesetzt wurde [219], sind in ihrer Übertragbarkeit eingeschränkt, da durch dieses Verfahren die Hautbarriere unphysiologisch alteriert wird.
Uneinheitliche Ergebnisse finden sich in Diffusionszellstudien mit Kampfstoffen. Für militärische Zwecke werden modifizierte Haut-cremes, denen Filmbildner und/oder Gegenmittel in hoher Konzentration zugesetzt wurden, angewendet [219, 220]. Auch bei diesen Präparaten ist aber unter arbeitsplatzrelevanten Expositionsbedingungen eine erhebliche Penetrationsförderung zu beobachten [219]. In ihrer Zusammensetzung sind diese Hautcremes mit denen, die für den Arbeitsschutz vertrieben werden, nicht vergleichbar.
Die Ursachen und Mechanismen der Penetrationsförderung bzw. der Penetrationshemmung durch Hautschutzmittel sind noch nicht geklärt. Für die Penetrationsförderung von Gefahrstoffen durch Haut-schutzmittel werden Zusatzstoffe wie Emulgatoren verantwortlich gemacht [182–184, 221], die auch in transdermalen therapeutischen Systemen (TTS) eingesetzt werden, um genügend Wirkstoff durch die Haut zu schleusen [222]. Eine Diffusionszellstudie mit Inhaltsstoffen von Sonnenschutzcremes [223] bestätigt diese Annahme. Ob eine Hemmung der Penetration durch eine zusätzliche physikochemische Barriere erklärt werden kann, erscheint fraglich. Eine Beschleunigung der Regeneration des Stratum corneum hingegen könnte eine Penetrationshemmung erklären.
Zusammenfassend kann von einer generellen Reduzierung der perkutanen Aufnahme von Fremdstoffen durch die Applikation von Hautschutzmitteln vor der Exposition nicht ausgegangen werden. Die Gefahr einer möglichen Penetrationsbeschleunigung von Fremd-stoffen durch Hautschutzmittel ist bei deren Einsatz und Auswahl zu berücksichtigen. Soweit Schutzmaßnahmen gegen haut- und/oder systemtoxische Arbeitsstoffe angezeigt sind, sollten diese nicht durch die Verwendung von Hautschutzmitteln, sondern durch organisatorische und technische Veränderungen der Arbeitsabläufe oder das Tragen geeigneter Schutzkleidung realisiert werden. Von der Deutschen Gesellschaft für Arbeitsmedizin liegt eine überarbeitete Fassung eine Leitlinie zur Hautresorption vor, deren Aussagen deckungsgleich sind (AWMF-Leitlinie: Toxische Gefährdung durch Hautresorption www.awmf.org/leitlinien/detail/ll/002-037.html ).
4 Dokumentation
Informationen, die zur Beurteilung der Qualität eines beruflichen Hautmittels notwendig sind, sollen vom Hersteller bzw. Inverkehrbringer des Produkts dokumentiert und den Fachkreisen zugänglich gemacht werden. Diese Dokumentation soll mindestens Angaben zu folgenden Punkten umfassen, die zum Großteil auf bestehen-den gesetzlichen Basisanforderungen der Kosmetik-Verordnung be-ruhen:
- Beschreibung des galenischen Systems
- Angaben zur Haltbarkeit und mikrobiologischen Stabilität (Min-desthaltbarkeit und Haltbarkeit nach dem Öffnen)
- Benennung der Methodik des Wirksamkeitsnachweises in Form einer zusammenfassenden Darstellung unter Nennung der Referenzen und Produktzuordnung (bei Hautschutzmitteln z. B. Schutzwirkung gegen bestimmte hautschädigende Arbeitsstoffe bzw. Arbeitsstoffgruppen und/oder Erleichterung der Hautreini-gung)
- Zusammenfassung der Ergebnisse der durchgeführten Verträglichkeitsuntersuchungen unter Nennung der Methodik und der Prüfinstitution [75]. Anwenderinformationen wie
- die konkrete Nennung des Haupteinsatzgebietes und ggf. weiterer Einsatzgebiete,
- die Nennung von Nichteinsatzgebieten bei vorhersehbarem Fehlgebrauch,
- Angaben zur Anwendbarkeit im Gesicht,
- Angaben zur Anwendbarkeit unter okklusiven Bedingungen wie dem Tragen von Schutzhandschuhen,
- Angaben zur Anwendbarkeit auf erkrankter Haut,
- Angabe der Inhaltsstoffe nach INCI (International Nomenclature of Cosmetic Ingredients) auf der Verpackung zum Schutz des Allergikers und
- Hinweise zur Art und Häufigkeit der Anwendung während bzw. nach einer Arbeitsschicht.
5 Ausblicke
Folgende Problembereiche sollten in den nächsten Jahren mit Priorität durch entsprechende Studien angegangen werden:
- Zur Hautpflege: fehlende Unterscheidung von Hautschutz- und Hautpflegemitteln sowie der Abgrenzung der Einzelkomponen-ten, die die bisher ausgelobte Anwendung nach der Arbeit recht-fertigen.
- Überprüfung, ob die als Okklusionseffekte propagierten Hautveränderungen durch Hautschutzmaßnahmen entsprechend ver-bessert werden könnten. Hierzu müssen weitere standardisierte und evaluierte Verfahren entwickelt werden.
- Überprüfung des durch die Hersteller verwendeten Claims (Aus-lobung) einer erleichterten Hautreinigung durch Hautschutzmittel in standardisierten In-vivo-Verfahren, die zu entwickeln sind.
Literatur
[1] Fartasch M, Diepgen T, Drexler H et al.: Berufliche Hautmittel: S1-Leitlinie der Arbeitsgemeinschaft für Berufs- und Umweltdermatologie (ABD) in der Deutschen Dermatologischen Gesellschaft (DDG). Arbeitsmed Sozialmed Umweltmed 2009; 44: 53–67.
[2] Wigger-Alberti W, Diepgen T, Elsner P et al.: Berufliche Hautschutzmittel. Gemeinsame Leitlinie der Arbeitsgemeinschaft für Berufs- und Umweltdermatologie (ABD) in der Deutschen Dermatologischen Gesellschaft (DDG) und der Gesellschaft für Dermopharmazie e.V. (GD). Dermatol Beruf Umwelt 2003; 51: 15–21.
[3] Wigger-Alberti W: Möglichkeiten und Grenzen von Hautschutzmitteln. Dermatol Beruf Umwelt 2005; 53: 158–166.
[4] Kresken J, Klotz A: Occupational skin-protection products – a review. Int Arch Occup Environ Health 2003; 76: 355–358.
[5] Wigger-Alberti W, Elsner P: Preventive measures in contact dermatitis. Clin Dermatol 1997; 15: 661–665.
[6] Schliemann-Willers S, Elsner P: Beruflicher Hautschutz. J Dtsch Dermatol Ges 2005; 3: 120–133; quiz 134–136.
[7] Voß H, Gediga G, Gediga K et al.: Secondary prevention of occupational dermatoses: first systematic evaluation of optimized dermatologist‘s pro-cedure and hierarchical multi-step intervention. J Dtsch Dermatol Ges 2013; 11: 662–671.
[8] Diepgen TL, Schmidt A, Kresken J: Prävention berufsbedingter Handekzeme durch Hautschutzmaßnahmen – Ergebnisse einer betrieblichen Interventions-studie. Arbeitsmed Sozialmed Präventivmed 2004; 39: 307–314.
[9] Bonneville M, Chavagnac C, Vocanson M et al.: Skin contact irritation con-ditions the development and severity of allergic contact dermatitis. J Invest Dermatol 2007; 127: 1430–1435.
[10] Callard RE, Harper JI: The skin barrier, atopic dermatitis and allergy: a role for Langerhans cells? Trends Immunol 2007; 28: 294–298.
[11] Fartasch M: Entstehung und Verstärkung der allergischen Kontaktreaktionen durch Irritanzien. Allergologie 2012; 35: 237–241.
[12] Schliemann S, Wigger-Alberti W, Elsner P: Allergenblockade durch Haut-schutzpräparate: Möglichkeiten und Grenzen. Schweiz Med Wochenschr 1999; 129: 996–1001.
[13] Elsner P, Wigger-Alberti W, Pantini G: Perfluoropolyethers in the prevention of irritant contact dermatitis. Dermatology (Basel) 1998; 197: 141–145.
[14] Schliemann S. Limitations of skin protection. Curr. Probl. Dermatol. 2007; 34: 171–7; DOI: 10.1159/0000100000.
[15] Berndt U, Wigger-Alberti W, Gabard B et al.: Vergleich einer Hautschutzcreme und ihrer Grundlage bezüglich Wirksamkeit gegen das berufsbedingte irritative Handekzem bei Krankenschwester. Dermatol Beruf Umwelt 2001; 49: 77–80.
[16] Tronnier H: Methodische Ansätze zur Prüfung von Hautschutzmitteln. Dermatosen 1993; 41: 100–107.
[17] Mitchell G: Zur Vermeidung von Hautproblemen bei Handschuhträgern im Gesundheitsdienst. Arbeitsmed Sozialmed Präventivmed 1989; 24: 182–183.
[18] Zhai H, Schmidt R, Levin C et al.: Prevention and therapeutical effects of a model emulsion on glove-induced irritation and dry skin in man. Dermatol Beruf Umwelt 2001; 50: 134–138.
[19] Frosch PJ, Kurte A: Efficacy of skin barrier creams (IV). The repetitive irritation test (RIT) with a set of 4 standard irritants. Contact Derm 1994; 31: 161–168.
[20] Schmid-Wendtner M, Korting HC: pH and skin care. Berlin: ABW Wissenschaftsverlag, 2007.
[21] Buraczewska I, Lodén M: Treatment of surfactant-damaged skin in humans with creams of different pH values. Pharmacology 2005; 73: 1–7.
[22] Winker R, Salameh B, Stolkovich S et al.: Effectiveness of skin protection creams in the prevention of occupational dermatitis: results of a randomized, controlled trial. Int Arch Occup Environ Health 2009; 82: 653–662.
[23] Antonov D, Kleesz P, Elsner P et al.: Impact of glove occlusion on cumulative skin irritation with or without hand cleanser-comparison in an ex-perimental repeated irritation model. Contact Derm 2013; 68: 293–299.
[24] Berndt U, Gabard B, Schliemann-Willers S et al.: Integrated skin protection from work place irritants: a new model for efficacy assessment. Exogenous Dermatol 2002; 1: 45–48.
[25] Kutting B, Baumeister T, Weistenhofer W et al.: Effectiveness of skin protec-tion measures in prevention of occupational hand eczema: results of a pro-spective randomized controlled trial over a follow-up period of 1 year. Br J Dermatol 2010; 162: 362–370.
[26] Ibler KS, Jemec, G, Diepgen TL et al.: Skin care education and individual counselling versus treatment as usual in healthcare workers with hand eczema: randomised clinical trial. BMJ 2012; 345: e7822.
[27] Jungbauer F: Wet work in relationship to occupational dermatitis. Groningen, NL: University Library, 2004.
[28] Jungbauer FH, Van d Groothoff JW et al.: Irritant hand dermatitis: severity of disease, occupational exposure to skin irritants and preventive measures 5 years after initial diagnosis. Contact Derm 2004; 50: 245–251.
[29] Jungbauer FH, Steenstra FB, Groothoff JW et al.: Characteristics of wet work in nurses. Int Arch Occup Environ Health 2005; 78: 248–251.
[30] Meding B, Lindahl G, Alderling M et al.: Is skin exposure to water mainly occupational or nonoccupational? A population-based study. Br J Dermatol 2013; 168: 1281–126.
[31] Ibler KS, Jemec, G, Flyvholm M et al.: Hand eczema: prevalence and risk factors of hand eczema in a population of 2274 healthcare workers. Contact Derm 2012; 67: 200–207.
[32] Fartasch M, Taeger D, Broding HC et al.: Evidence of increased skin irrita-tion after wet work: impact of water exposure and occlusion. Contact Derm 2012; 67: 217–228.
[33] Fartasch M, Taeger D, Broding H et al.: Hautschutz unter Handschuhen – welche Effekte lassen sich experimentell nachweisen? 2011; 46: 162.
[34] Diepgen TL: Occupational skin diseases. J Dtsch Dermatol Ges 2012; 10: 297–313; quiz 314–315.
[35] Dickel H, Bruckner T, Bernhard-Klimt C et al.: Surveillance scheme for occupational skin disease in the Saarland, FRG. First report from BKH-S. Contact Derm 2002; 46: 197–206.
[36] Diepgen TL, Schmidt A: Werden Inzidenz und Prävalenz berufsbedingter Hauterkrankungen unterschätzt? Arbeitsmed Sozialmed Umweltmed 2002; 37: 477–480.
[37] Augustin M, Kuessner D, Purwins S et al.: Cost-of-illness of patients with chronic hand eczema in routine care: results from a multicentre study in Germany. Br J Dermatol 2011; 165: 845–851.
[38] Diepgen TL, Purwins S, Posthumus J et al.: Cost-of-illness analysis of pa-tients with chronic hand eczema in routine care in Germany: focus on the impact of occupational disease. Acta Derm Venereol 2013; 93: 538–543.
[39] Diepgen TL, Scheidt R, Weisshaar E et al.: Cost of illness from occupational hand eczema in Germany. Contact Derm 2013; 69: 99–106.
[40] Bathe A, Diepgen TL, Matterne U: Subjective illness perceptions in indivi-duals with occupational skin disease: a qualitative investigation. Work 2012; 43: 159–169.
[41] Boehm D, Schmid-Ott G, Finkeldey F et al.: Anxiety, depression and im-paired health-related quality of life in patients with occupational hand eczema. Contact Derm 2012; 67: 184–192.
[42] Böhm D, Stock Gissendanner S, Finkeldey F et al.: Severe occupational hand eczema, job stress and cumulative sickness absence. Occup Med (Lond) 2014; 64: 509–515.
[43] Ofenloch RF, Weisshaar E, Dumke A et al.: The Quality of Life in Hand Eczema Questionnaire (QOLHEQ): validation of the German version of a new disease-specific measure of quality of life for patients with hand eczema. Br J Dermatol 2014; 171: 304–312.
[44] Diepgen TL, Agner T, Aberer W et al.: Management of chronic hand eczema. Contact Derm 2007; 57: 203–210.
[45] Funke U, Fartasch M, Diepgen TL: Incidence of work-related hand eczema during apprenticeship: first results of a prospective cohort study in the car industry. Contact Derm 2001; 44: 166–172.
[46] Apfelbacher CJ, Radulescu M, Diepgen TL et al.: Occurrence and prognosis of hand eczema in the car industry: results from the PACO follow-up study (PACO II). Contact Derm 2008; 58: 322–329.
[47] Cvetkovski RS, Rothman KJ, Olsen J et al.: Relation between diagnoses on severity, sick leave and loss of job among patients with occupational hand eczema. Br J Dermatol 2005; 152: 93–98.
[48] Meding B, Wrangsjö K, Järvholm B: Fifteen-year follow-up of hand eczema: persistence and consequences. Br J Dermatol 2005; 152: 975–980.
[49] Kütting B, Drexler H: Effectiveness of skin protection creams as a preventive measure in occupational dermatitis: a critical update according to criteria of evidence-based medicine. Int Arch Occup Environ Health 2003; 76: 253–259.
[50] Coenraads P, Diepgen TL: Problems with trials and intervention studies on barrier creams and emollients at the workplace. Int Arch Occup Environ Health 2003; 76: 362–366.
[51] Diepgen TL, Williams HC: Evidenzbasierte Dermatologie und die Cochrane Skin Group. Hautarzt 2005; 56: 251–256.
[52] Held E, Wolff C, Gyntelberg F et al.: Prevention of work-related skin problems in student auxiliary nurses: an intervention study. Contact Derm 2001; 44: 297–303.
[53] Held E, Mygind K, Wolff C et al.: Prevention of work related skin problems: an intervention study in wet work employees. Occup Environ Med 2002; 59: 556–561.
[54] Speiser-Rankine N, Unterberger W, Taibl R et al.: Development and imple-mentation of process-oriented skin safety standards for the mineral oil in-dustry: A pilot study. 8th SPE International Conference on Health, Safety and Environmental in Oil and Gas Exploration and Production 2006; 2: 853–863.
[55] Hannuksela A, Kinnunen T: Moisturizers prevent irritant dermatitis. Acta Derm Venereol 1992; 72: 42–44.
[56] Perrenoud D, Gallezot D, van Melle G: The efficacy of a protective cream in a real-world apprentice hairdresser environment. Contact Derm 2001; 45: 134–138.
[57] Fowler JF: Efficacy of a skin-protective foam in the treatment of chronic hand dermatitis. Am J Contact Derm 2000; 11: 165–169.
[58] Fowler JF: A skin moisturizing cream containing Quaternium-18-Bentonite effectively improves chronic hand dermatitis. J Cutan Med Surg 2001; 5: 201–205.
[59] Berndt U, Hinnen U, Iliev D et al.: Hand eczema in metalworker trainees – an analysis of risk factors. Contact Derm 2000; 43: 327–332.
[60] Goh CL, Gan SL.: Efficacies of a barrier cream and an afterwork emollient cream against cutting fluid dermatitis in metalworkers: a prospective study. Contact Derm 1994; 31: 176–180.
[61] Goh CL, Gan SL: The incidence of cutting fluid dermatitis among metalworkers in a metal fabrication factory: a prospective study. Contact Derm 1994; 31: 111–115.
[62] Hachem J, Paepe K de, Vanpee E et al.: The effect of two moisturisers on skin barrier damage in allergic contact dermatitis. Eur J Dermatol 2002; 12: 136–138.
[63] McCormick RD, Buchman TL, Maki DG: Double-blind, randomized trial of scheduled use of a novel barrier cream and an oil-containing lotion for protecting the hands of health care workers. Am J Infect Control 2000; 28: 302–310.
[64] Wigger-Alberti W, Maraffio B, Wernli M et al.: Training workers at risk for occupational contact dermatitis in the application of protective creams: efficacy of a fluorescence technique. Dermatology (Basel) 1997; 195: 129–133.
[65] Bauer A, Kelterer D, Bartsch R et al. Skin protection in bakers‘ apprentices. Contact Derm. 2002; 46: 81–5.
[66] Weisshaar E, Kirschner F, Zimmermann E et al.: Sebamed Hand Repair Balsam bei Patienten mit chronischem Handekzem: Ergebnisse einer An-wendungsbeobachtung. Dermatol Beruf Umwelt 2007; 55: 60–66.
[67] Weisshaar E, Radulescu M, Soder S et al.: Secondary individual prevention of occupational skin diseases in health care workers, cleaners and kitchen employees: aims, experiences and descriptive results. Int Arch Occup En-viron Health 2007; 80: 477–484.
[68] Weisshaar E, Radulescu M, Bock M et al.: Educational and dermatological aspects of secondary individual prevention in healthcare workers. Contact Derm 2006; 54: 254–260.
[69] Mathias CG: Prevention of occupational contact dermatitis. J Am Acad Dermatol 1990; 23: 742–748.
[70] Berndt U, Wigger-Alberti W, Gabard B et al.: Efficacy of a barrier cream and its vehicle as protective measures against occupational irritant contact dermatitis. Contact Derm 2000; 42: 77–80.
[71] Frosch PJ, Peiler D, Grunert V et al.: Wirksamkeit von Hautschutzprodukten im Vergleich zu Hautpflegeprodukten bei Zahntechnikern – eine kontrollierte Feldstudie. J Dtsch Dermatol Ges 2003; 1: 547–557.
[72] Agner T, Held E, West W et al.: Evaluation of an experimental patch test model for the detection of irritant skin reactions to moisturisers. Skin Res Technol 2000; 6: 250–254.
[73] Held E, Sveinsdóttir S, Agner T.: Effect of long-term use of moisturizer on skin hydration, barrier function and susceptibility to irritants. Acta Derm Venereol 1999; 79: 49–51.
[74] Zachariae C, Held E, Johansen JD et al.: Effect of a moisturizer on skin susceptibility to NiCl2. Acta Derm Venereol 2003; 83: 93–97.
[75] Duval C, Lindberg M, Boman A et al.: Differences among moisturizers in affecting skin susceptibility to hexyl nicotinate, measured as time to increase skin blood flow. Skin Res Technol 2003; 9: 59–63.
[76] Soma Y, Kashima M, Imaizumi A et al.: Moisturizing effects of topical nicotinamide on atopic dry skin. Int. J. Dermatol. 2005; 44: 197–202.
[77] Lodén M, Andersson A, Anderson C et al.: A double-blind study comparing the effect of glycerin and urea on dry, eczematous skin in atopic patients. Acta Derm Venereol 2002; 82: 45–47.
[78] Lodén M, Andersson AC, Lindberg M: Improvement in skin barrier function in patients with atopic dermatitis after treatment with a moisturizing cream (Canoderm). Br J Dermatol 1999; 140: 264–267.
[79] Bikowski J: The use of therapeutic moisturizers in various dermatologic dis-orders. Cutis 2001; 68: 3–11.
[80] Kütting B, Weistenhöfer W, Baumeister T et al.: Current acceptance and implementation of preventive strategies for occupational hand eczema in 1355 metalworkers in Germany. Br J Dermatol 2009; 161: 390–396.
[81] Klotz A, Veeger M, Röcher W: Skin cleansers for occupational use: testing the skin compatibility of different formulations. Int Arch Occup Environ Health 2003; 76: 367–373.
[82] Perrenoud D, Gogniat T, Olmstedt W: Importance of education with appro-priate material for the prevention of occpational dermatitis. Dermatol Beruf Umwelt 2001; 49: 88–90.
[83] Lachapelle JM: Efficacy of protective creams and/or gels. Curr Probl Der-matol 1996; 25: 182–192.
[84] Tronnier H, Kresken J, Jackwerth B et al.: Haut und Beruf – Strategien zur Verhütung berufsbedingter Hauterkrankungen. Berlin: Grosse, 1989.
[85] Wigger-Alberti W, Elsner P: Barrier creams and emollients. In: Kanerva L, Elsner P, Wahlberg J, Maibach H (Hrsg.): Handbook of Occupational Der-matology. Berlin: Springer, 2000, S. 490–496.
[86] Suskind RR: Industrial and laboratory evaluation of a silicone protective cream. AMA Arch Ind Hyg Occup Med 1954; 9: 101–112.
[87] Ursin C, Hansen CM, Van Dyk, JW et al.: Permeability of commercial sol-vents through living human skin. Am Ind Hyg Assoc J 1995; 56: 651–660.
[88] Gehring W, Dördelmann C, Gloor M: Effektivitätsnachweis von Hautschutzpräparaten. Allergologie 1994; 17: 97–101.
[89] Diembeck W, Beck H, Benech-Kieffer F et al.: Test guidelines for in vitro assessment of dermal absorption and percutaneous penetration of cosmetic ingredients. European Cosmetic, Toiletry and Perfumery Association. Food Chem Toxicol 1999; 37: 191–205.
[90] Tronnier H: Über Hautschutzsalben. 1. Mitteilung: Untersuchungen über die Diffusion von Schadstoffen durch Hautschutzsalben. Berufsdermatosen 1964; 12: 241–281.
[91] Neubert R, Wohlrab W: In vitro methods for the biopharmaceutical evalua-tion of topical formulations. Acta Pharm Technol 1990; 36: 197–206.
[92] Lodén M: The effect of 4 barrier creams on the absorption of water, benzene, and formaldehyde into excised human skin. Contact Derm 1986; 14: 292–296.
[93] Fraissinette AD de, Picarles V, Chibout S et al.: Predictivity of an in vitro model for acute and chronic skin irritation (SkinEthic) applied to the testing of topical vehicles. Cell Biol Toxicol 1999; 15: 121–135.
[94] Gysler A, Königsmann U, Schäfer-Korting M: Dreidimensionale Huatmodelle zur Erfassung der perkutanen Resorption. Altex 1999; 16: 67–72.
[95] Hermann M: Nutzung von 3D-Hautmodellen zur Beurteilung der Wirksam-keit von Hautpflegeprodukten. Krefeld, 2002.
[96] Ponec M, Gibbs S, Pilgram G et al.: Barrier function in reconstructed epider-mis and its resemblance to native human skin. Skin Pharmacol. Appl Skin Physiol 2001; 14 (Suppl 1): 63–71.
[97] Van de Sandt, JR., Roguet C, Cohen D et al.: The use of human keratinocytes and human skin models for predicting skin irritation. The report and re-commendation of ECVAM (Europäisches Zentrum für die Validierung von Alternativmethoden). 38th workshop „Alternatives to lacoratory animals“ 1999; 27: 723–743.
[98] Zur Mühlen A, Klotz A, Weimans S et al.: Using skin models to assess the effects of a protection cream on skin barrier function. Skin Pharmacol Physiol 2004; 17: 167–175.
[99] Zur Mühlen A, Klotz A, Veeger M et al.: Untersuchung des biochemischen Wirkmechanismus einer Hautpflegeformulierung unter Nutzung eines 3D-Hautmodells. Arbeitsmed Sozialmed Umweltmed 2005; 40: 392–397.
[100] Zur Mühlen A, Klotz A, Allef P et al.: Using skin models to assess the effects of a pre-work cream. Methodological aspects and perspective of the industry. Curr Probl Dermatol 2007; 34: 19–32.
[101] Klotz A, Zur Mühlen A, Thörner B et al.: Testing the efficacy of skin protec-tion products in-vivo and in-vitro. SÖFW-Journal 2003; 129: 10–16.
[102] Pittermann W, Holtmann W., Kietzmann M: Prävention gegen lipophile Noxen durch Hautschutzprodukte. Arbeitsmed Sozialmed Umweltmed 2003; 38: 435–442.
[103] Pittermann W, Jackwerth B, Schmitt M: The isolated perfused bovine udder skin model: A new in vitro model for the assessment of skin penetration and irritation. In Vitro Toxicology 1997; 10: 17–21.
[104] Teichmann A, Jacobi U, Waibler E et al.: An in vivo model to evaluate the efficacy of barrier creams on the level of skin penetration of chemicals. Con-tact Derm 2006; 54: 5–13.
[105] Treffel P, Gabard B, Juch R: Evaluation of Barrier Creams – An In-Vitro Technique on Human Skin. Acta Derm.Venereol 1994; 74: 7–11.
[106] Marks R, Dykes PJ, Hamami I: Two novel techniques for the evaluation of barrier creams. Br J Dermatol 1989; 120: 655–660.
[107] Olivarius FD, Hansen AB, Karlsmark T et al.: Water protective effect of barrier creams and moisturizing creams: A new in vivo test method. Contact Dermatitis 1996; 35: 219–225.
[108] Wilmer JL, Burleson FG, Kayama F et al.: Cytokine induction in human epidermal keratinocytes exposed to contact irritants and its relation to chemical-induced inflammation in mouse skin. J Invest Dermatol 1994; 102: 915–922.
[109] Willis CM, Stephens CJ, Wilkinson JD: Epidermal damage induced by irri-tants in man: a light and electron microscopic study. J Invest Dermatol 1989; 93: 695–699.
[110] Willis CM, Stephens CJ, Wilkinson JD: Selective expression of immune-associated surface antigens by keratinocytes in irritant contact dermatitis. J Invest Dermatol 1991; 96: 505–511.
[111] Willis CM, Stephens CJ, Wilkinson JD: Differential effects of structurally unrelated chemical irritants on the density of proliferating keratinocytes in 48 h patch test reactions. J Invest Dermatol 1992; 99: 449–453.
[112] Willis CM, Stephens CJ, Wilkinson JD: Differential patterns of epidermal leukocyte infiltration in patch test reactions to structurally unrelated chemi-cal irritants. J Invest Dermatol 1993; 101: 364–370.
[113] Fartasch M: Human barrier formation and reaction to irritation. In: Elsner P, Maibach H (Hrsg.): Irritant dermatitis. New clinical and experimental aspects. Basel: Karger, 1995: S. 95–103.
[114] Fartasch M: Ultrastructure of the epidermal barrier after irritation. Microsc Res Tech 1997; 37: 193–199.
[115] Fartasch M, Schnetz E, Diepgen TL: Characterization of detergent-induced barrier alterations – effect of barrier cream on irritation. J Investig Dermatol Symp Proc 1998; 3: 121–127.
[116] Fartasch M, Schnetz E, Ennen J et al.: Charakterisierung der Barriere-veränderungen durch repetitive Irritationseffekte der Barriercreme. H+G 1999; 9: 463–468.
[117] Frosch PJ, Schulze-Dirks A, Hoffmann M et al.: Efficacy of skin barrier creams (II). Ineffectiveness of a popular „skin protector“ against various irritants in the repetitive irritation test in the guinea pig. Contact Derm 1993; 29: 74–77.
[118] Schnetz E, Diepgen TL, Elsner P et al.: Multicentre study for the development of an in vivo model to evaluate the influence of topical formulations on irritation. Contact Derm 2000; 42: 336–343.
[119] Wigger-Alberti W, Caduff L, Burg G et al.: Experimentally induced chronic irritant contact dermatitis to evaluate the efficacy of protective creams in vivo. J Am Acad Dermatol 1999; 40: 590–596.
[120] Gehring W, Gloor M, Kleesz P: Predictive washing test for evaluation of individual eczema risk. Contact Derm 1998; 39: 8–13.
[121] Grunewald AM, Gloor M, Gehring W et al.: Damage to the skin by repetitive washing. Contact Derm 1995; 32: 225–232.
[122] Wigger-Alberti W, Rougier A, Richard A et al.: Efficacy of protective creams in a modified repeated irritation test. Methodological aspects. Acta Derm Venereol 1998; 78: 270–273.
[123] Curdy C, Naik A, Kalia YN et al.: Non-invasive assessment of the effect of formulation excipients on stratum corneum barrier function in vivo. Int J Pharm 2004; 271: 251–256.
[124] Rieger T, Teichmann A, Richter H et al.: Evaluation of barrier creams – intro-duction and comparison of 3 in vivo methods. Contact Derm 2007; 56: 347–354.
[125] Gabard B, Schliemann-Willers S: Effizienter Hautschutz durch neue Haut-schutzpräparate. SÖFW-Journal 2002; 128: 2–7.
[126] Fartasch M, Hüner A, Tepe A et al.: Hautphysiologische Untersuchungsmethoden in der Berufsdermatologie. Allergologie 1993; 16: 25–34.
[127] Tupker RA, Willis C, Berardesca E et al.: Guidelines on sodium lauryl sulfate (SLS) exposure tests. A report from the Standardization Group of the Euro-pean Society of Contact Dermatitis. Contact Derm 1997; 37: 53–69.
[128] Rogiers V: EEMCO guidance for the assessment of transepidermal water loss in cosmetic sciences. Skin Pharmacol. Appl Skin Physiol 2001; 14: 117–128.
[129] Pinnagoda J, Tupker RA, Agner T et al.: Guidelines for transepidermal water loss (TEWL) measurement. A report from the Standardization Group of the European Society of Contact Dermatitis. Contact Derm 1990; 22: 164–178.
[130] Parra JL, Paye M: EEMCO guidance for the in vivo assessment of skin sur-face pH. Skin Pharmacol. Appl Skin Physiol 2003; 16: 188–202.
[131] Berardesca E, Lévêque J, Masson P: EEMCO guidance for the measurement of skin microcirculation. Skin Pharmacol. Appl Skin Physiol 2002; 15: 442–456.
[132] Berardesca E: EEMCO guidance for the assessment of stratum corneum hydration: electrical methods. Skin Res Technol 1997; 3: 126–132.
[133] Aramaki J, Effendy I, Happle R et al.: Which bioengineering assay is appro-priate for irritant patch testing with sodium lauryl sulfate? Contact Derm 2001; 45: 286–290.
[134] Fluhr JW, Kuss O, Diepgen T et al.: Testing for irritation with a multi-factorial approach: comparison of eight non-invasive measuring techniques on five different irritation types. Br J Dermatol 2001; 145: 696–703.
[135] Shah JH, Zhai H, Maibach HI: Comparative evaporimetry in man. Skin Res Technol 2005; 11: 205–208.
[136] Fluhr JW, Akengin A, Bornkessel A et al.: Additive impairment of the barrier function by mechanical irritation, occlusion and sodium lauryl sulphate in vivo. Br J Dermatol 2005; 153: 125–131.
[137] Kappes UP, Göritz N, Wigger-Alberti W et al.: Tandem application of sodium lauryl sulfate and n-propanol does not lead to enhancement of cumulative skin irritation. Acta Derm Venereol. 2001; 81: 403–405.
[138] Wigger-Alberti W, Spoo J, Schliemann-Willers S et al.: The tandem repeated irritation test: a new method to assess prevention of irritant combination damage to the skin. Acta Derm. Venereol 2002; 82: 94–97.
[139] Schliemann S, Petri M, Elsner P: How much skin protection cream is actually applied in the workplace? Determination of dose per skin surface area in nurses. Contact Dermatitis 2012; 67: 229–233.
[140] Fartasch M, Deters A, Schnetz E: Veränderung der Penetration durch Externa (Hautschutz): In-vivo-Erkenntnisse durch die Mikrodialyse. Dermatol Beruf Umwelt 2006; 54: 80.
[141] Schnetz E, Fartasch M: Microdialysis for the evaluation of penetration through the human skin barrier – a promising tool for future research? Eur J Pharm Sci 2001; 12: 165–174.
[142] Kresken J, Daniels R, Arens-Corell M: Leitlinie der GD Gesellschaft für Dermopharmazie e.V.: Dermokosmetika zur Reinigung und Pflege trockener Haut, 2009.
[143] Zhai H, Willard P, Maibach HI: Evaluating skin-protective materials against contact irritants and allergens. An in vivo screening human model. Contact Derm 1998; 38: 155–158.
[144] Blichmann CW, Serup J, Winther A: Effects of single application of a moistu-rizer: evaporation of emulsion water, skin surface temperature, electrical conductance, electrical capacitance, and skin surface (emulsion) lipids. Acta Derm Venereol 1989; 69: 327–330.
[145] Grove GL: The effect of moisturizers on skin surface hydration as measured invivo by electrical-conductivity. Curr Ther Res Clin Exp 1991; 50: 712–719.
[146] Korstanje C, Ligtvoet FPT, van Hemert KHF: Differential effects of dermato-logical cream bases with respect to skin surface moisturizing capacity: a study design in volunteers. J Dermatol Treatment 1992; 2: 137–139.
[147] Serup J, Winther A, Blichmann CW: Effects of repeated application of a moisturizer. Acta Derm Venereol 1989; 69: 457–459.
[148] Treffel P, Gabard B: Stratum corneum dynamic function measurements after moisturizer or irritant application. Arch Dermatol Res 1995; 287: 474–479.
[149] Mortz CG, Andersen KE, Halkier-Sørensen L: The efficacy of different moisturizers on barrier recovery in hairless mice evaluated by non-invasive bioengineering methods. A model to select the potentially most effective product. Contact Derm 1997; 36: 297–301.
[150] Lodén M, Andersson AC: Effect of topically applied lipids on surfactant-irritated skin. Br J Dermatol 1996; 134: 215–220.
[151] Lodén M: Barrier recovery and influence of irritant stimuli in skin treated with a moisturizing cream. Contact Derm. 1997; 36: 256–260.
[152] Halkier-Sørensen L, Thestrup-Pedersen K: The efficacy of a moisturizer (Locobase) among cleaners and kitchen assistants during everyday exposure to water and detergents. Contact Derm 1993; 29: 266–271.
[153] Gabard B, Elsner P, Treffel P: Barrier function of the skin in a repetitive irritation model and influence of 2 different treatments. Skin Res Technol 1996; 2: 78–82.
[154] El Gammal C, Pagnoni A, Kligman AM et al.: A model to assess the efficacy of moisturizers--the quantification of soap-induced xerosis by image analysis of adhesive-coated discs (D-Squames). Clin Exp Dermatol 1996; 21: 338–343.
[155] Ramsing DW, Agner T: Preventive and therapeutic effects of a moisturizer. An experimental study of human skin. Acta Derm Venereol 1997; 77: 335–337.
[156] Buraczewska I, Berne B, Lindberg M et al.: Changes in skin barrier function following long-term treatment with moisturizers, a randomized controlled trial. Br J Dermatol 2007; 156: 492–498.
[157] Gehring W, Geier J, Gloor M: Untersuchungen über die austrocknende Wirkung verschiedener Tenside. Dermatol Monatsschr 1991; 177: 257–264.
[158] Gloor M, Wasik B, Gehring W et al.: Cleansing, dehydrating, barrier-damag-ing and irritating hyperaemising effect of four detergent brands: comparative studies using standardised washing models. Skin Res Technol 2004; 10: 1–9.
[159] Klotz A, Thörner B: Skin cleansers for removing heavy-duty contamination: Testing efficacy and compatibility. SÖFW-Journal 2002; 128: 14–21.
[160] Klotz A, Veeger M: Hautreinigungsmittel bei starken Verschmutzungen. Pharm Ztg 2000; 145: 47–51.
[161] Bornkessel A, Flach M, Arens-Corell M et al.: Functional assessment of a washing emulsion for sensitive skin: mild impairment of stratum corneum hydration, pH, barrier function, lipid content, integrity and cohesion in a controlled washing test. Skin Res Technol 2005; 11: 53–60.
[162] Elsner P, Seyfarth F, Sonsmann F et al.: Standardized dirts for testing the efficacy of workplace cleaning products: validation of their workplace rele-vance. Contact Derm 2013; 69: 245–250.
[163] Sonsmann FK, Strunk M, Gediga K et al.: Standardization of skin cleansing in vivo: part I. Development of an Automated Cleansing Device (ACiD). Skin Res Technol 2014; 20: 228–238.
[164] Sonsmann FK, Strunk M, Gediga K et al.: Standardization of skin cleansing in vivo: part II. Validation of a newly developed Automated Cleansing Device (ACiD). Skin Res Technol 2014; 20: 239–245.
[165] Elsner P, Seyfarth F, Sonsmann F et al.: Development of a standardized pro-cedure for testing the efficacy of workplace cleansers. Contact Derm. 2014; 70: 35–43.
[166] Elsner P, Seyfarth F, Antonov D et al.: Development of a standardized testing procedure for assessing the irritation potential of occupational skin cleansers. Contact Derm 2014; 70: 151–157.
[167] Europäisches Parlament: Verordnung (EG) Nr. 1223/2009 des Europäischen Parlaments und des Rates vom 30. November 2009 über kosmetische Mittel (Neufassung), 2009.
[168] SCCS: The SCCS’S notes of guidance for the testing of cosmetic ingredients and their safety evaluation: 7th Revision, SCCS/1416/11, Brussels, 2010.
[169] SCCNFP. Guidelines on the use of human volunteers in the testing of poten-tially cutaneous irritant cosmetic ingredients or mixtures of ingredients. Brussels, 1998.
[170] Bundesinstitut für Risikobewertung: Aluminiumhaltige Antitranspirantien tragen zur Aufnahme von Aluminium bei. Stellungnahme Nr. 007/2014 des BfR vom 26.02.2014.
[171] Pineau A, Guillard O, Favreau F et al.: In vitro study of percutaneous ab-sorption of aluminum from antiperspirants through human skin in the Franz diffusion cell. J Inorg Biochem 2012; 110: 21–26.
[172] Flarend R, Bin T, Elmore D et al.: A preliminary study of the dermal ab-sorption of aluminium from antiperspirants using aluminium-26. Food Chem Toxicol 2001; 39: 163–168.
[173] Uter W, Geier J, Lessmann H et al.: Inhaltsstoffe von Hautschutz- und Pflegemitteln aus allergologischer Sicht. Analyse von IVDK-Daten und Literaturübersicht. Dermatol Beruf Umwelt 2005; 53: 172–182.
[174] Wulfhorst B, Bock M, Skudlik C et al.: Worker education and teaching Programs: The German experience. In: Frosch P, Menne T, Lepoittevin J (Hrsg.): Textbook of contact dermatitis. Berlin: Springer, 2006, S. 855–861.
[175] Lange M, Geier J: Inhaltsstoffe von Hautschutz-, Hautreinigungs- und Hautpflegepräparaten. Eine allergologisch kommentierte Marktübersicht. Dermatol Beruf Umwelt 2005; 53: 167–171.
[176] Geier J, Lessmann H, Schnuch A et al.: Recent increase in allergic reactions to methylchloroisothiazolinone/methylisothiazolinone: is methylisothiazolinone the culprit? Contact Dermatitis 2012; 67: 334–341.
[177] Schnuch A, Geier J, Uter W et al.: Majantol – a new important fragrance allergen. Contact Derm 2007; 57: 48–50.
[178] Schnuch A, Uter W, Geier J et al.: Sensitization to 26 fragrances to be la-belled according to current European regulation. Results of the IVDK and review of the literature. Contact Derm 2007; 57: 1–10.
[179] Goh CL: Cutting oil dermatitis on guinea pig skin (I). Cutting oil dermatitis and barrier cream. Contact Derm 1991; 24: 16–21.
[180] Schliemann S, Kleesz P, Elsner P: Protective creams fail to prevent solvent-induced cumulative skin irritation – results of a randomized double-blind study. Contact Dermatitis 2013; 69: 363–371.
[181] Korinth G, Wellner T, Luersen L et al.: Beschleunigung der dermalen Pene-tration von Kühlschmierstoffen und kanzerogenen Arbeitsstoffen durch Hautschutzcremes. Arbeitsmed Sozialmed Umweltmed 2006; 41: 106.
[182] Korinth G, Geh S, Schaller KH et al.: In vitro evaluation of the efficacy of skin barrier creams and protective gloves on percutaneous absorption of industrial solvents. Int Arch Occup Environ Health 2003; 76: 382–386.
[183] Korinth G, Luersen L, Schaller KH et al.: Enhancement of percutaneous penetration of aniline and o-toluidine in vitro using skin barrier creams. Toxicol In Vitro 2008; 22: 812–818.
[184] Korinth G, Weiss T, Penkert S et al.: Percutaneous absorption of aromatic amines in rubber industry workers: impact of impaired skin and skin barrier creams. Occup Environ Med 2007; 64: 366–372.
[185] van der Bijl P, Gareis A, Lee H et al.: Effects of two barrier creams on the diffusion of benzo[a]pyrene across human skin. SADJ. 2002; 57: 49–52.
[186] Held E, Lund H, Agner T: Effect of different moisturizers on SLS-irritated human skin. Contact Derm 2001; 44: 229–234.
[187] Held E, Agner T: Effect of moisturizers on skin susceptibility to irritants. Acta Derm Venereol 2001; 81: 104–107.
[188] Lodén M: The clinical benefit of moisturizers. J Eur Acad Dermatol Venereol 2005; 19: 672–688; quiz 686–687.
[189] Löffler H, Effendy I: Hautschutz- oder Regenerationscreme? Der Halbseitenversuch in der Bewertung eines hautpflegenden Externums. Z Hautkr 2002; 77: 234–238.
[190] Simion FA, Rhein LD, Morrison BMJ et al.: Self-perceived sensory responses to soap and synthetic detergent bars correlate with clinical signs of irritation. J Am Acad Dermatol 1995; 32: 205–211.
[191] Spoo J, Wigger-Alberti W, Berndt U et al.: Skin cleansers: three test protocols for the assessment of irritancy ranking. Acta Derm Venereol 2002; 82: 13–17.
[192] Wigger-Alberti W, Fischer T, Greif C et al.: Effects of various grit-containing cleansers on skin barrier function. Contact Derm 1999; 41: 136–140.
[193] Billhimer WL, Berge CA, Englehart JS et al.: A modified cup scrub method for assessing the antibacterial substantivity of personal cleansing products. J Cosmet Sci 2001; 52: 369–375.
[194] Grove GL, Zerweck CR, Heilman JM et al.: Methods for evaluating changes in skin condition due to the effects of antimicrobial hand cleansers: two studies comparing a new waterless chlorhexidine gluconate/ethanol-emollient anti-septic preparation with a conventional water-applied product. Am J Infect Control 2001; 29: 361–369.
[195] Gabard B, Chatelain E, Bieli E et al.: Surfactant irritation: in vitro corneo-surfametry and in vivo bioengineering. Skin Res Technol 2001; 7: 49–55.
[196] Piérard GE, Goffin V, Piérard-Franchimont C: Corneosurfametry: a predic-tive assessment of the interaction of personal-care cleansing products with human stratum corneum. Dermatology (Basel) 1994; 189: 152–156.
[197] Ananthapadmanabhan KP, Moore DJ, Subramanyan K et al.: Cleansing without compromise: the impact of cleansers on the skin barrier and the technology of mild cleansing. Dermatol Ther 2004; 17 (Suppl. 1): 16–25.
[198] Corazza M, Lauriola MM, Bianchi A et al.: Irritant and sensitizing potential of eight surfactants commonly used in skin cleansers: an evaluation of 105 patients. Dermatitis 2010; 21: 262–268.
[199] Corazza M, Lauriola MM, Zappaterra M et al.: Surfactants, skin cleansing protagonists. J Eur Acad Dermatol Venereol 2010; 24: 1–6.
[200] Johnson WJ: Final report on the safety assessment of PEG-25 propylene gly-col stearate, PEG-75 propylene glycol stearate, PEG-120 propylene glycol stearate, PEG-10 propylene glycol, PEG-8 propylene glycol cocoate, and PEG-55 propylene glycol oleate. Int J Toxicol 2001; 20 (Suppl. 4): 13–26.
[201] Johnson WJ: Final report on the safety assessment of octoxynol-1, octoxynol-3, octoxynol-5, octoxynol-6, octoxynol-7, octoxynol-8, octoxynol-9, octoxynol-10, octoxynol-11, octoxynol-12, octoxynol-13, octoxynol-16, octoxynol-20, octoxy-nol-25, octoxynol-30, octoxynol-33, octoxynol-40, octoxynol-70, octoxynol-9 carboxylic acid, octoxynol-20 carboxylic acid, potassium octoxynol-12 phosphate, sodium octoxynol-2 ethane sulfonate, sodium octoxynol-2 sulfate, sodium octo-xynol-6 sulfate, and sodium octoxynol-9 sulfate. Int J Toxicol 2004; 23 (Suppl. 1): 59–111.
[202] Final report of the amended safety assessment of PEG-5, -10, -16, -25, -30, and -40 soy sterol. Int J Toxicol 2004; 23 (Suppl. 2): 23–47.
[203] Amended final report on the safety assessment of Oryza Sativa (rice) Bran Oil, Oryza Sativa (rice) Germ Oil, Rice Bran Acid,Oryza Sativa (rice) Bran Wax, Hydrogenated Rice Bran Wax, Oryza Sativa (rice)Bran Extract, Oryza Sativa (rice) Extract, Oryza Sativa (rice) Germ Powder, Oryza Sativa (rice) Starch, Oryza Sativa (rice) Bran, Hydrolyzed Rice Bran Extract, Hydrolyzed Rice Bran Protein, Hydrolyzed Rice Extract, and Hydrolyzed Rice Protein. Int J Toxicol 2006; 25 (Suppl. 2): 91–120.
[204] Baranda L, González-Amaro R, Torres-Alvarez B et al.: Correlation between pH and irritant effect of cleansers marketed for dry skin. Int J Dermatol 2002; 41: 494–499.
[205] Korting HC, Hubner K, Greiner K et al.: Differences in the skin surface pH and bacterial microflora due to the long-term application of synthetic detergent preparations of pH 5.5 and pH 7.0. Results of a crossover trial in healthy volunteers. Acta DermVenereol 1990; 70: 429–431.
[206] Korting HC, Ponce-Poschl E, Klovekorn W et al.: The influence of the regular use of a soap or an acidic syndet bar on pre-acne. Infection 1995; 23: 89–93.
[207] Park KS, Kim YS, Cho YH et al.: Effects of alkalinity of household dish-washing liquids on hand skin. Contact Dermatitis 2001; 45: 95–98.
[208] Lademann J, Otberg N, Jacobi U et al.: Follicular penetration and targeting. J Invest Dermatol Symp Proc 2005; 10: 301–303.
[209] Williams FM: In vitro studies – how good are they at replacing in vivo studies for measurement of skin absorption? Environ Toxicol Pharmacol 2006; 21: 199–203.
[210] Howes D, Guy R, Hadgraft J et al.: Methods for assessing percutaneous absorption. The report and recommendations of ECVAM workshop. ATLA 1996; 24: 81–106.
[211] EPA: EPA (Environmental Protection Agency) risk assessment forum: Guidlines for exposure assessment [FRL-4129-5], Washington, DC, 1992.
[212] OECD: OECD guidline for the testing of chemicals: Skin Absorption: in vitro methods, OECD environmental health and safety publications, Paris, 2004.
[213] Adams A, Gündel J, Strunk P et al.: Zur Effektivität primärpräventiver Maß-nahmen bei beruflicher PAH-Exposition. Arbeitsmed Sozialmed Umweltmed 1999; 34: 97–100.
[214] Fartasch M, Deters A, Schnetz E et al.: Cutaneous penetration: its modulation by skin care products. Contact Dermatitis 2006; 55.
[215] Baur X, Chen Z, Allmers H et al.: Results of wearing test with two different latex gloves with and without the use of skin-protection cream. Allergy 1998; 53: 441–444.
[216] Allmers H: Wearing test with 2 different types of latex gloves with and without the use of a skin protection cream. Contact Dermatitis 2001; 44: 30–33.
[217] Korinth G, Göen T, Kruse C et al.: Die Effektivität des persönlichen Körper-schutzes zur Reduktion der inneren Belastung durch Schwefelkohlenstoff in der Viskoseindustrie. In: Schäcke G, Lüth P: Arbeitsmedizin im Wandel – Bewährte Strategien und Herausforderungen. Fulda: Rindt-Druck, 2000, S. 275–279.
[218] Boman A, Mellstrom G: Percutaneous absorption of 3 organic solvents in the guinea pig. (III). Effect of barrier creams. Contact Dermatitis 1989; 21: 134–140.
[219] Chilcott RP, Jenner J, Hotchkiss SA et al.: Evaluation of barrier creams against sulphur mustard. I. In vitro studies using human skin. Skin Pharma-col Appl Skin Physiol 2002; 15: 225–235.
[220] Chilcott RP, Dalton CH, Hill I et al.: Evaluation of a barrier cream against the chemical warfare agent VX using the domestic white pig. Basic Clin Pharmacol Toxicol 2005; 97: 35–38.
[221] Fischer T, Rystedt I: Skin protection against ionized cobalt and sodium lauryl sulphate with barrier creams. Contact Dermatitis 1983; 9: 125–130.
[222] Wellner T, Göen T, Drexler H: Systemische Therapie durch dermale Applika-tion: Transdermale Therapeutische Systeme. Dermatol Beruf Umwelt 2006; 54: 13–18.
[223] Pont AR, Charron AR, Brand RM: Active ingredients in sunscreens act as topical penetration enhancers for the herbicide 2,4-dichlorophenoxyacetic acid. Toxicol Appl Pharmacol. 2004; 195: 348–354.
Erstellungsdatum: 23. 10. 2014
Nächste Überprüfung geplant: Oktober 2017
Für die Verfasser (Koordinatorin)
Prof. Dr. med. Manigé Fartasch
Abteilung für klinische & experimentelle Berufsdermatologie
Institut für Prävention und Arbeitsmedizin der Deutschen Gesetzlichen Unfallversicherung (IPA), Institut der Ruhr-Universität Bochum
Bürkle-de-la-Camp-Platz 1
44789 Bochum
fartasch@ipa.ruhr-uni-bochum.de
Verfahren zur Konsensbildung
Die Empfehlungen der Leitlinie wurde von den Autoren im Rahmen eines in-formellen Verfahrens konsentiert. Dieser Entwurf wurde unter der Website der ABD abderma.org/ für Anmerkungen und Anregungen durch weitere Experten veröffentlicht.
Die finale Fassung der Leitlinie wurde am 15. Oktober 2014 von den Autoren konsentiert. Die Arbeit wurde koordiniert von Prof. Dr. med. Manigé Fartasch, Bochum.
Lang- und Kurzversion der Leitlinie finden sich unter www.awmf.org, die Kurzversion wurde zudem im Journal der Deutschen Dermatologischen Gesellschaft publiziert (JDDG 2015; 13: 594–607).