Für den Versand und Transport medizinisch-diagnostischer Proben und bio-logischer Materialien über öffentliche Verkehrswege gilt das Gefahrgutrecht. Dem liegt die Annahme zugrunde, dass Erreger aufgrund einer möglichen Infektiosität am Ort ihres Freiwerdens auf zufällig anwesende Personen (oder Tiere) übertragen wer-den und Krankheiten auslösen und somit eine individuelle oder allgemeine Gefährdung darstellen können. Im Folgenden wer-den die Begriffe „Transport“ und „Versand“ außerhalb von Gebäuden der medizinischen Versorgung oder Forschung synonym verwandt.
Von besonderer Bedeutung für den Trans-port von Proben über öffentliche Straßen ist die jeweils gültige Fassung des Europäischen Übereinkommens über die internationale Be-förderung gefährlicher Güter auf der Straße (ADR, Accord Européen Relatif au Transport International des Marchandises Dangereuses par Route). Diese wird auf Basis der jeweils gültigen UN-Empfehlungen alle zwei Jahre novelliert und mittels der Gefahrgutverordnung Straße, Eisenbahn und Binnenschifffahrt (GGVSEB) meist unverändert in deutsches Recht überführt. Das zugrunde lie-gende Gesetz für die Beförderung gefährlicher Güter mit Eisenbahn-, Magnetschwebe-bahn-, Straßen-, Wasser- und Luftfahrzeugen in der Bundesrepublik Deutschland ist das Gefahrgutbeförderungsgesetz (GGBefG). Die Beförderung im Sinne dieses Gesetzes umfasst nicht nur den Vorgang der Ortsveränderung, sondern auch Vorbereitungs- und Abschlusshandlungen wie das Verpacken und Auspacken der Güter und das Be- und Entladen. Beim Probentransport auf dem Luft-weg sind ebenfalls die Vorschriften für die Beförderung gefährlicher Güter des Internationalen Verbandes der Luftfahrtgesellschaften (IATA-DGR) zu beachten. Für den innerdeutschen Postversand gelten die jeweils aktuellen Regelungen der Deutschen Post AG.
Einteilung und gefahrgutrechtliche Klassifizierung der Proben
Patientenproben
Patientenproben wie z. B. Blut-, Urin-, Stuhl-, Nervenwasser- (Liquor) oder Gewebeproben und Abstriche werden meist in Arztpraxen, Krankenhäusern oder anderen medizinischen Einrichtungen entnommen und zur Analytik in entsprechende Laboratorien versandt.
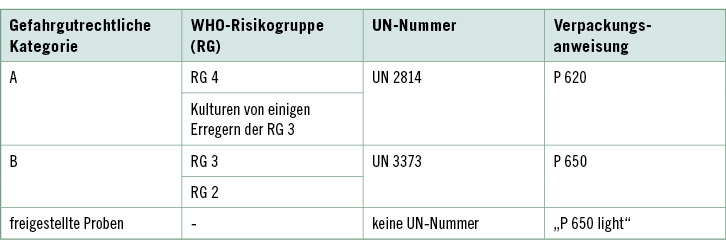
Entscheidend für die Wahl der richtigen Verpackung ist die Einstufung der Probe in die korrekte gefahrgutrechtliche Kategorie, woraus sich sowohl die anzugebende UN-Nummer als auch alle beim Transport einzuhaltenden Vorschriften ableiten. Einen Überblick hierüber gibt Tabelle 1.
Die Pathogenität und Virulenz des in den Proben vorhandenen Erregers entscheiden über seine Zuordnung in die Gefahrgut-kategorie A oder B.
Infektionen mit Erregern der Kategorie A können schwere oder lebensbedrohliche Erkrankungen oder dauernde Behinderungen bei ansonsten gesunden Patienten verursachen. Der Transport solcher Proben kommt in Deutschland selten vor. Allerdings fallen einige bakterielle Erreger der Kategorie B nach kultureller Anreicherung ebenfalls in die Kategorie A ( Tabelle 2).
Zur Kategorie B gehören Proben, in denen weniger gefährliche Erreger vorhanden sind oder vermutet werden. Sie umfasst alle für diagnostische oder klinische Zwecke verschickten ansteckungsgefährlichen Stoffe, die den Kriterien für eine Aufnahme in die Kategorie A nicht entsprechen ( Tabelle 3).
Freigestellte medizinische Proben
Patientenproben, bei denen lediglich eine minimale Wahrscheinlichkeit besteht, dass sie Krankheitserreger enthalten, dürfen als „FREIGESTELLTE MEDIZINISCHE PROBE“ verschickt werden, sofern dabei bestimmte Grundanforderungen an die Verpackung er-füllt sind.
Beispiele für Proben, die in Form einer „FREIGESTELLTEN MEDIZINISCHEN PROBE“ befördert werden dürfen, sind:
- Proben zur Kontrolle von Stoffwechselfunktionen, wie z. B. Cholesterin-, Blutzucker- und Hormonwerte,
- Proben zum Nachweis erregerspezifi-scher Antikörper bei fehlendem Infektionsverdacht,
- Proben zur Kontrolle von Organfunktionen bei Patienten ohne ansteckende Krankheiten,
- Proben zur therapeutischen Arzneimittelkontrolle,
- Schwangerschaftstests,
- Biopsien bei Tumorverdacht.
Sonstige freigestellte Stoffe
- Proben, die keine ansteckungsgefährlichen Stoffe enthalten, oder Stoffe, bei denen es unwahrscheinlich ist, dass sie bei Menschen oder Tieren Krankheiten hervorrufen,
- Proben mit Mikroorganismen, die für Menschen und Tiere nicht pathogen sind,
- Proben, in denen jegliche vorhandenen Krankheitserreger so neutralisiert oder inaktiviert wurden, dass sie kein Gesundheitsrisiko mehr darstellen,
- getrocknetes Blut, das durch Aufbringen eines Bluttropfens auf eine absorbierende Fläche gewonnen wird, oder Proben für Vorsorgeuntersuchungen (Screening-Tests) auf im Stuhl enthaltenes Blut sowie Blut oder Blutbestandteile, die für Zwecke der Transfusion oder der Zubereitung von Blutprodukten für die Verwendung bei der Transfusion oder der Transplantation gesammelt wurden.
Verpackung, Kennzeichnung und Versand
Verantwortlich für die Einhaltung der gefahrgutrechtlichen Versandbestimmungen einschließlich korrekter Deklaration und Verpackung medizinischer Untersuchungsmaterialien ist der Absender (einsendende Ärzte, Laborleiter). In den letzten Jahren wurden die Versandvorschriften wiederholt geändert. Die hier dargestellten Bestimmungen entsprechen dem Stand bei Drucklegung (Oktober 2014).
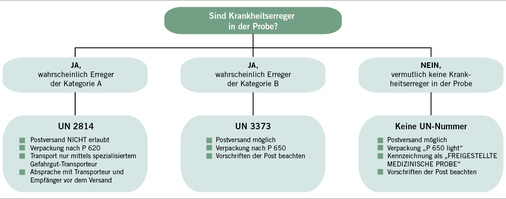
Die Wahl der richtigen Kategorie für den Versand ist in Abb. 1 dargestellt.
Versand von freigestellten medizinischen Proben
Patientenproben, bei denen nur eine minimale Wahrscheinlichkeit besteht, dass sie Krankheitserreger enthalten, unterliegen nicht den Vorschriften des ADR. Sie können ohne Angabe einer UN-Nummer versendet werden, vorausgesetzt die Probe wird in einer Verpackung befördert, die jegliches Freiwerden verhindert; die Verpackung muss mit dem Ausdruck „FREIGESTELLTE MEDI-ZINISCHE PROBE“ gekennzeichnet werden. Da die Verpackung bis auf einige Erleichterungen der P 650 entspricht, wird sie oft auch als „P 650 light“ bezeichnet.
Die Verpackung entspricht den geltenden Vorschriften, wenn sie folgende Bedingungen erfüllt:
- a)Die Verpackung besteht aus drei Bestandteilen:
- einem wasserdichten Primärgefäß/wasserdichten Primärgefäßen,
- einer wasserdichten Sekundärverpackung und
- ausreichend fester Außenverpackung (kistenförmige Verpackung aus Pappe oder Versandhülle aus reißfestem Pa-pier oder Kunststofffolie; mindestens eine Oberfläche muss eine Mindestabmessung von 100 × 100 mm aufweisen).
- b)Bei flüssigen Stoffen: ausreichend absorbierendes Material zwischen Primär-gefäß(en) und Sekundärverpackung, um die gesamte Flüssigkeit aufnehmen zu können.
- c)Mehrere zerbrechliche Primärgefäße in einer Sekundärverpackung dürfen sich nicht gegenseitig berühren und müssen durch Einwickeln oder andere Maßnahmen getrennt werden.
Bestehen auch nur geringe Zweifel, dass eine Probe die Bedingungen für den Versand als freigestellte medizinische Probe erfüllt, ist immer eine Klassifikation als UN 3373 und der Versand mit einer Verpackung nach P 650 zu empfehlen.
Versand von Proben unter UN 3373
Verpackungen der Kategorie P 650 entsprechen prinzipiell in ihrem Aufbau denen für freigestellte Patientenproben (Dreifachverpackung), müssen jedoch einige zusätzli-che Bedingungen erfüllen. So muss die Verpackung genügend widerstandsfähig sein, um Stößen und Belastungen, die unter normalen Beförderungsbedingungen auftreten, standhalten zu können und ein Austreten des Inhalts zu verhindern. Das vollständige Versandstück muss in der Lage sein, eine Fallprüfung aus einer Höhe von 1,2 m erfolg-reich zu bestehen. Entsprechendes Verpa-ckungsmaterial ist in guter Qualität, zum Teil auch bauartgeprüft, zu erwerben.
Die Verpackung muss aus mindestens drei Bestandteilen bestehen:
- Primärgefäß (z. B. Probenröhrchen mit Schraubkappen),
- Sekundärverpackung (nach außen hin dicht verschlossen),
- Außenverpackung (mindestens eine der Oberflächen der Außenverpackung muss als Mindestabmessung 100 × 100 mm auf-weisen).
Die Primärgefäße sind so in die Sekundärverpackungen zu verpacken, dass ein Zubruchgehen, Durchstoßen oder Austreten von Inhalt in die Sekundärverpackung verhindert wird. Mehrere zerbrechliche Primärgefäße in einer Sekundärverpackung dür-fen sich nicht gegenseitig berühren und müs-sen durch Einwickeln oder andere Maßnahmen getrennt werden.
Bei flüssigen Stoffen muss ausreichend absorbierendes Material zwischen Primär-gefäß(en) und Sekundärverpackung ein-gelegt werden, um die gesamte Flüssigkeit aufnehmen zu können. Sowohl die Primär-gefäße als auch die Sekundärverpackung müssen flüssigkeitsdicht sein. Das Primärgefäß oder die Sekundärverpackung muss in der Lage sein, einem Innendruck von 95 kPa (0,95 bar) ohne Verlust von Füllgut standzuhalten. Wenn Zweifel darüber bestehen, ob während der Beförderung Restflüssigkeit im Primärgefäß vorhanden sein kann, muss eine für flüssige Stoffe geeignete Verpackung mit absorbierendem Material verwendet werden.
Die Sekundärverpackungen sind mit geeignetem Polstermaterial in die Außenverpackungen einzusetzen. Die Sekundärverpackung oder die Außenverpackung muss starr sein (im Luftverkehr immer die Außenverpackung).
Auf der Außenverpackung muss für die Beförderung das in Abb. 2 abgebildete Kennzeichen auf der äußeren Oberfläche auf einem kontrastierenden Hintergrund deut-lich sichtbar und lesbar aufgebracht sein.
Das Kennzeichen muss die Form eines auf die Spitze gestellten Quadrats (Raute) mit einer Mindestabmessung von 50 × 50 mm haben. Die Linie muss mindestens 2 mm breit sein und die Buchstaben und Ziffern müssen eine Zeichenhöhe von mindestens 6 mm haben.
Direkt neben dem rautenförmigen Kenn-zeichen muss auf der Außenverpackung die offizielle Benennung für die Beförderung „BIOLOGISCHER STOFF, KATEGORIE B“ mit einer Buchstabenhöhe von mindestens 6 mm angegeben werden.
Muss die Probe gekühlt verschickt wer-den, ist das dazu benötigte Kühlmittel (Kühl-akku, Eis oder Trockeneis) in den Raum zwi-schen Sekundär- und Außenverpackung zu füllen. Innenhalterungen für die Fixierung des Kühlmittels müssen vorhanden sein, damit die Sekundärverpackung infolge von (Kondens-)Wasserbildung oder dem Verdampfen des Trockeneises sicher in ihrer ursprünglichen Lage verbleibt. Das Primär-gefäß und die Sekundärverpackung dürfen durch die Temperatur des verwendeten Kühl-mittels sowie durch die Temperaturen und Drücke, die bei einem Ausfall der Kühlung entstehen können, in ihrer Funktionsfähigkeit nicht beeinträchtigt werden.
Bei Verwendung von Eis muss die Außenverpackung oder Umverpackung flüssig-keitsdicht sein.
Wird Trockeneis (festes Kohlendioxid) verwendet, muss das entstehende Kohlendioxidgas beim Verdampfen des Trockeneises aus der Verpackung entweichen können, um einen Druckaufbau zu verhindern. Das Versandstück (die Außenverpackung oder die Umverpackung) ist mit der Aufschrift „KOHLENDIOXID, FEST, ALS KÜHL-MITTEL“ oder „TROCKENEIS, ALS KÜHL-MITTEL“ zu versehen (wenn Versandstücke in eine Umverpackung eingesetzt werden, müssen die vorgeschriebenen Versandstück-Kennzeichnungen entweder deutlich sichtbar sein oder auf der Außenseite der Umverpackung wiedergegeben werden). Gemäß Abschnitt 5.5.3 des ADR „Sondervorschriften für Versandstücke, Fahrzeuge und Container mit Stoffen, die bei der Verwendung zu Kühl- oder Konditionierungszwecken eine Erstickungsgefahr darstellen können (wie Trockeneis [UN 1845], Stickstoff, tief-gekühlt, flüssig [UN 1977] oder Argon, tief-gekühlt, flüssig [UN 1951])“ obliegt es den mit der Handhabung und Beförderung be-fassten Beteiligten, das Risiko der Erstickungsgefahr durch das entstehende Kohlendioxid zu beurteilen. Entsprechend müs-sen diese Personen ausreichend unterwiesen sein. Versandstücke, die Trockeneis enthalten, müssen in gut belüfteten Fahrzeugen befördert werden und sollten im Laderaum (NICHT im Fahrgastraum!) verstaut werden. Dem Verlader bzw. Fahrer/Kurier ist ein Dokument (z. B. Lieferschein, Rechnung, Frachtbrief) zu übergeben, das die Angabe „UN 1845 KOHLENDIOXID, FEST, ALS KÜHLMITTEL“ oder „UN 1845 TROCKEN-EIS, ALS KÜHLMITTEL“ enthält. In Abhän-gigkeit von der Gefährdungsbeurteilung kann weiter eine Kennzeichnung jedes Zugangs des Fahrzeuges (z. B. Türen) mit einem Warn-kennzeichen gemäß Absatz 5.5.3.6.2 des ADR vor den im Fahrzeug befindlichen ge-fährlichen Kühlmitteln notwendig sein. Für weitere Details sei an dieser Stelle auf die Angaben in dem ADR selbst verwiesen.
Versand von Proben unter UN 2814
Verpackungen der Kategorie P 620 haben ebenfalls den Aufbau einer Dreifach-Verpackung. Die Unterschiede zur P 650 beinhalten eine wesentlich stabilere Konstruktion und größere Mindestabmessungen (starre Außenverpackung von mindestens 100 mm in jeder Dimension), erhöhte Prüfungsanforderungen und eine amtliche Bauartzulassung. So muss die Verpackung z. B. eine Fallprüfung aus einer Höhe von 9 m erfolgreich bestehen können. Auch müssen unabhängig von der vorgesehenen Versand-temperatur das Primärgefäß oder die Sekundärverpackung einem Innendruck, der einem Druckunterschied von mindestens 95 kPa entspricht, und Temperaturen von –40 °C bis +55 °C ohne Undichtheiten stand-halten können. Geeignete Verpackungen werden in der Regel von den Laboratorien oder Transporteuren zur Verfügung gestellt. Ein Beispiel einer Verpackung der Kategorie P 620 zum Versand der Proben unter UN 2814 ist in Abb. 3 dargestellt. Transport und Verpackung sollten mit dem Empfänger und dem Transporteur besprochen und abgestimmt werden (Ort, Zeitpunkt, Probenart, Größe, Menge), weshalb die Anweisungen hier nicht im Detail beschrieben werden.
Wo sind die wichtigsten Vorschriften in der jeweils aktuellen Version zu finden?
Aufgrund der etwa alle zwei Jahre erfolgenden Aktualisierung der Vorschriften zum Probentransport ist es empfehlenswert, in entsprechenden Zeitintervallen die Versand-vorschriften auf Änderungen zu überprüfen.
Die Verpackungsvorschriften für den Ver-sand auf der Straße finden sich auf der Inter-netseite des Bundesministeriums für Verkehr und digitale Infrastruktur ( www.bmvi.de ) unter dem Titel „Europäisches Übereinkommen über die internationale Beförderung gefährlicher Stoffe auf der Straße“ (ADR, Accord Européen Relatif au Transport Inter-national des Marchandises Dangereuses par Route). In der aktuellen, ab dem 1. Januar 2013 geltenden Fassung, finden sich die Re-gelungen für den Versand an den folgenden Stellen: P 650 (Kapitel 4.1.4.1., Seite 4.1–98f), P 620 (Kapitel 4.1.4.1., Seite 4.1–96) sowie für den Versand von freigestellten medizinischen Proben (Punkt 2.2.62.1.5.6, Seite 2–98f). Zum 1. Januar 2015 traten Änderungen zum ADR in Kraft. Diese sind in der 24. ADR-Änderungsverordnung vom 6. Oktober 2014 enthalten (s. „Weitere Infos“).
Die Regelungen für den Postversand fin-den sich auf der Internetseite der Deutschen Post AG – DHL unter dem Titel „Regelungen für die Beförderung von gefährlichen Stoffen und Gegenständen“:
- Teil 1A: Brief national, Briefsendungen, www.deutschepost.de (aktuelle Fassung gültig ab dem 01. 07. 2013)
- Teil 1B: Brief national, briefähnliche Sen-dungen, www.deutschepost.de (aktuelle Fassung gültig ab dem 01. 07. 2013)
- Teil 2: DHL Paket national, www.dhl.de (aktuelle Fassung gültig ab 01. 07. 2013).
- Teil 3: DHL Express national, www.dhl.de (aktuelle Fassung gültig ab Mai 2013).
Literatur und Quellen
Thurm V, Schoeller A, Mauff G, Just HM, Tschäpe H: Versand von medizinischem Untersuchungsmaterial – Neue Bestimmungen ab 2007. Dtsch Arztebl 2007; 104(46).
Thurm V, Heinemann A: Versand von medizinischem Untersuchungsmaterial: Sicher und vorschriften-konform. Dtsch Arztebl 2010; 107(49).
Heinemann A: Patientenproben richtig versenden. Gefahrgutrechtliche Hinweise – aktualisierte Fassung nach ADR 2013. BGWthemen 03/2013, Berufsgenossenschaft für Gesundheitsdienst und Wohlfahrtspflege (BGW): www.bgw-online.de/DE/Medien-Service/Medien-Center/Medientypen/bgw-themen/TP-DPHuM-Patientenproben-Humanmedizin.html (abgerufen am 26. 10. 2014).
Biostoffverordnung (BioStoffV, Verordnung über Sicherheit und Gesundheitsschutz bei Tätigkeiten
mit Biologischen Arbeitsstoffen) vom 15. Juli 2013 (BGBl. I S. 2514): www.gesetze-im-internet.de/biostoffv_2013 (abgerufen am 26. 10. 2014).
Technische Regeln für Biologische Arbeitsstoffe, Schutzmaßnahmen für Tätigkeiten mit biologischen Arbeitsstoffen in Laboratorien (TRBA 100), Aus-gabe: Oktober 2013, GMBl. Nr. 51/52 vom 17. Oktober 2013, S. 1010–1042, 1. Änderung: GMBl. 2014 Nr. 38 vom 30. Juni 2014, S. 814: www.baua.de/de/Themen-von-A-Z/Biologische-Arbeitsstoffe/TRBA/TRBA_content.html (abgerufen am 26. 10. 2014.)
Technische Regeln für Biologische Arbeitsstoffe, Biologische Arbeitsstoffe im Gesundheitswesen und in der Wohlfahrtspflege (TRBA 250), Ausgabe März 2014, GMBl. 2014 Nr. 10/11 vom 27. März 2014, S. 206, 1. Änderung: GMBl. Nr. 25 vom 22. 05. 2014, S. 535; www.baua.de/de/Themen-von-A-Z/Biologische-Arbeitsstoffe/TRBA/TRBA_content.html (abgerufen am 26. 10. 2014).
Gesetz zur Verhütung und Bekämpfung von Infek-tionskrankheiten beim Menschen (Infektionsschutzgesetz – IfSG) vom 20. Juli 2000, zuletzt geändert durch Art. 2 Abs. 36 und Art. 4 Abs. 21 des Gesetzes vom 7. August 2013 (BGBl. I S. 3154), www.gesetze-im-internet.de/ifsg (abgerufen am 26. 10. 2014).
Verordnung über die Bestellung von Gefahrgutbeauftragten in Unternehmen (Gefahrgutbeauftragten-verordnung – GbV) vom 25. Februar 2011 (BGBl. I S. 341), geändert durch Art. 3 der Verordnung vom 19. Dezember 2012 (BGBl. I S. 2715), www.gesetze-im-internet.de/gbv_2011 (abgerufen am 26. 10. 2014).
Weitere Infos
Europäisches Übereinkommen über die internationale Beförderung gefährlicher Stoffe auf der Straße (ADR), Neufassung vom 03. 06. 2013, BGBl. 2013 II S. 648 mit Anlageband und 24. ADR-Änderungsverordnung vom 06. 10. 2014 (BGBl. 2014 II S. 722 mit Anlageband)
www.bmvi.de//SharedDocs/DE/Artikel/UI/Gefahrgut/gefahrgut-recht-vorschriften-strasse.html
Gefahrgutverordnung Straße, Eisenbahn und Binnenschifffahrt (GGVSEB) vom 17. 06. 2009, (BGBl. I S. 1389), in der Fassung der Bekanntmachung vom 22. 01. 2013 (BGBl. I S. 110)
www.gesetze-im-internet.de/ggvseb
Guidance on regulations for the Transport of Infectious Substances 2013–2014, WHO 2012
Für die Autoren
Priv.-Doz. Dr. med. M. Imöhl
Institut für Medizinische Mikro-biologie, Uniklinik RWTH Aachen
Pauwelsstraße 30
52074 Aachen