Sportliches Training und entzündlich rheumatische Erkrankungen – ein Widerspruch?
Während Trainingsprogramme im Therapiekonzept der Spondylarthritis, insbesondere dem Morbus Bechterew, seit langem einen festen Platz im Therapiekonzept einnehmen, bestehen bei allen anderen entzündlich rheumatischen Erkrankungen Bedenken, durch vermehrte körperliche Betätigung Krankheitsschübe auszulösen oder zu vermehrten knöchernen De-struktionen zu führen. Dieser Artikel soll anhand einer Literaturrecherche eine Übersicht über den Stellenwert der Trainingstherapie in der Behandlung Rheumatoider Arthritis, den Spondylarthritisformen sowie auch den Kollagenosen und der Myositis geben, mit einem Blick auf die Komorbiditäten dieser rheumatischen Entzündungen. Bei vielen anderen chronischen Erkrankungen – wie z. B. kardiovaskulären Erkrankungen, dem Diabetes mellitus, der Osteoporose etc. ist der Stellenwert körperlicher Aktivität seit langem evident und in breitem Maße auch in der praktischen Therapie umgesetzt. Zunehmend gibt es Evidenz, wie wichtig sportliche Aktivität auch in der Rheumatherapie ist. So ist die vorliegende Arbeit vor allem auch als Aufruf zu sehen, dass Bewegung für Rheumakranke – unter Beachtung der objektiven Kontraindikationen – sinnvoll ist.
Schlüsselwörter: Trainingstherapie – entzündlich rheumatische Erkrankungen – Rheumatherapie
Sports training and inflammatory rheumatic diseases – a contradiction?
While training programs occupy a permanent place in the therapy concept of spondylarthritis – in particular of Bechterew's disease – for a long time, there are concerns with respect to all other inflammatory rheumatic diseases that increased physical activity might lead to exacerbations of the disease or increased bone destruction. This article shall – on the basis of literature research – provide an overview of the importance of exercise therapy in the treatment of rheumatoid arthritis, all types of spondylarthritis as well as connective tissue disease (CTD) and myositis, with a view to the comorbid conditions of these rheumatic inflammations. In many other chronic diseases such as cardiovascular diseases, diabetes mellitus, osteoporosis, etc., the importance of physical activity has been evident for a long time and implemented widely in practical therapy. Increasingly, there is also evidence for the importance of physical activity in the treatment of rheumatism. Thus, the present work can be seen above all as a call that movement for people suffering from rheumatism makes sense – under consideration of the objective contraindications.
Keywords: training therapy – inflammatory rheumatic diseases – rheumatoid therapy
Rheumatoide Arthritis
Die Rheumatoide Arthritis ist eine chronische systemische Autoimmunerkrankung, die etwa 0,5–1 % der Bevölkerung in Mittel-europa betrifft, Frauen wesentlich häufiger. In den letzten Jahren gab es wesentliche Fortschritte in der Diagnostik und Therapie der Erkrankung. Die Etablierung der Diagnosekriterien von EULAR (European League Against Rheumatism) und ACR (American College of Rheumatology; Aletaha et al. 2010) führen zu einer rascheren Diagnosestellung. Therapeutisch entwickelten sich intensive Therapiealgorithmen mit Einleitung einer konsequenten immunsuppressiven Therapie mit DMARDs (Disease Modifying Antirheumatic Drugs) wie Methotrexat, sowie bei Nichterreichen einer klinischen Remission Kombinationstherapien oder die Zugabe von Biologika (Schneider et al. 2011). Damit konnte insgesamt eine wesentliche Verbesserung für die Patienten erreicht werden, die Krankheitsaktivi-tät nimmt ab, insbesondere die radiologische Progression kann teilweise gestoppt werden. Allerdings ist der Langzeitverlauf der Erkrankung weiterhin gekennzeichnet durch eine erhöhte Morbidität und Mortalität, sowie eine wesentliche Reduktion der Lebensqualität. Hautpursache sind eine erhöhte kardiovaskuläre Mortalität, die Entwicklung einer rheumatoiden Kachexie und der allgemeine Verlust an Kraft und Beweglichkeit. Diese Punkte konnten auch in den zahlreichen Studien zur Therapie mit Biologika nicht endgültig geklärt werden. Sie stehen weiterhin im Mittelpunkt der Langzeitbetreuung von Patienten mit Rheumatoider Arthritis, besonders in einem fortgeschrittenen Krankheitsverlauf und höherem Lebens-alter.
Rheumatoide Arthritis und kardiovaskuläre Erkrankungen
Patienten mit Rheumatoider Arthritis haben ein wesentlich erhöhtes Risiko für kardiovaskuläre Erkrankungen, wobei diese unabhängig von den klassischen kardiovaskulären Risikofaktoren zu sein scheinen. In einer 8-jährigen Beobachtungsstudie mit 236 Patienten zeigte sich eine 3,96fach erhöhte Inzidenz vaskulärer Ereignisse gegenüber einer Vergleichsgruppe. Auch nach Bereinigung der klassischen Risikofaktoren war noch eine 3,17fache Erhöhung festzustellen (Rincon et al. 2001). Das relative Risiko für Herzinfarkt ist im Vergleich zur Normalbevölkerung knapp doppelt so hoch (Solomon et al. 2003). Auch treten diese Ereignisse eine Dekade früher auf und häufiger wird eine Mehrgefäßerkrankung diagnostiziert (Maradit-Kremers et al. 2005).
Als Ursache wird derzeit eine auch in Phasen klinischer Remis-sion dokumentierte Erhöhung proinflammatorischer Zytokine wie Tumor-Nekrose-Faktor alpha (TNF), Interleukin 6, Interleukin 1 und in weiterer Folge C-reaktives Protein – einem etablierten kardio-vaskulären Risikofaktor – angenommen. Der primäre Entzündungsort in der Pathogenese der Rheumatoiden Arthritis ist die Synovia, allerdings werden diese Zytokine auch systemisch freigesetzt und beeinflussen so entfernte Organe, wie Fettgewebe und Muskel (Sat-tar et al. 2003). Eine basale Hyperinsulinämie und erhöhte Insulin-resistenz ist bei Patienten mit Rheumatoider Arthritis auch bei bestehender Euglykämie beschrieben (Paolisso et al. 1991). Paradoxerweise kann diese Insulinresistenz durch die Gabe von Steroiden positiv beeinflusst werden (Hällgren u. Beerne 1983). Zusätzlich führen die Zytokine zu einer verstärkten Lipolyse in Adipozyten mit erhöhter Freisetzung freier Fettsäuren. In weiterer Folge zeigen sich erhöhte Triglyzeride sowie ein insgesamt reduziertes Gesamtcholesterin bei allerdings erhöhtem LDL (Rincon et al. 2001).
Neben diesen krankheitsspezifischen Mechanismen findet sich ein vermehrtes Auftreten der klassischen kardiovaskulären Risikofaktoren und vor allem eine durch Inaktivität bedingte, um 30 % ein-geschränkte kardiorespiratorische Fitness im Vergleich zur Normalbevölkerung dokumentiert (Franklin u. Mc Cullough 2009). Nicht unterzubewerten sind letztendlich die Nebenwirkungen der eingesetzten Medikamente in der verstärkten Atherosklerosentwicklung, insbesondere der oft langfristigen Cortisonbehandlungen, die trotz bestehender Alternativen leider nach wie vor immer wieder erfolgen.
Hinsichtlich der sportlichen Belastung bei gleichzeitig bestehenden kardiovaskulären Vorerkrankungen gelten die im Herzsport üblichen Regeln, wobei im Einzelfall abgewogen werden muss, ob die rheumatische Erkrankung oder die kardiovaskuläre Situation leistungslimitierend sind. In jedem Fall sollte bei kardiovaskulären Schädigungen auf eine korrekte Atemtechnik und das Vermeiden von Pressatmung geachtet werden.
Rheumatoide Kachexie
Klassische Kachexie ist charakterisiert durch ein komplexes metabolisches Syndrom, assoziiert mit einer Grunderkrankung und dem Verlust von Muskelmasse mit oder ohne dem Verlust von Fett sowie einem BMI unter 18,5 kg/m2. Die Sonderform der Rheumatoiden Kachexie zeigt ebenfalls eine deutlich erniedrigte Muskelmasse, bei allerdings gleichzeitig erhöhter Fettmasse und damit einem meist sogar gering erhöhten BMI von über 25 kg/m2. Neben der verminderten körperlichen Aktivität liegt bei vielen Patienten mit Rheumatoider Arthritis die Ursache des Muskelabbaus in den proinflammatorischen Zytokinen, insbesondere dem Tumor-Nekrose-Faktor alpha (früher mit dem Namen Cachexin bedacht; Morley et al. 2006). TNF führt dabei einerseits direkt zum Abbau von Muskel-protein, andererseits kommt es zu einer verminderten Sensitivität des Skelettmuskels gegenüber anabolen Stimuli. Es finden sich erniedrigte Spiegel anaboler Hormone (z. B. Testosteron) und von Wachstumsfaktoren wie dem Insulin-like Growth Faktor 1 (Lang u. Frost 2002).
In logischer Konsequenz wurden mehrfach Studien mit TNF-Blockern zur Therapie der Kachexie bei unterschiedlichen Krankheits-bildern wie Tumorkachexie und chronische Herzinsuffizienz durchgeführt, ebenso in der Behandlung der frühen Rheumatoiden Arthri-tis (Marcora et al. 2006). Dabei wurde Etanercept mit Methotrexat verglichen (über 24 Wochen) in Hinblick auf Körperzusammensetzung, Funktion, Entzündungsaktivität und die Spiegel von zirkulierendem Insulin-like Growth Faktor. In der Summe konnten in den beiden Therapiegruppen keine wesentlichen Unterschiede gefunden werden. Möglicherweise war der Therapiezeitraum zu kurz, eventuell sind in dieser Indikation direkte TNF-Rezeptorblocker wirksamer. Entsprechende Phase-III-Studien werden erwartet, aber endgültige Resultate, die belegen, dass eine Biologikatherapie die Mechanismen der Rheumatoiden Kachexie stoppen können, fehlen noch.
Eine weitere mögliche Ursache im Verlust der Muskelmasse sind exogene Faktoren, wie die Therapie mit Glukokortikoiden und das Auftreten einer Cortisonmyopathie. Ebenfalls in Zusammenhang zu erwähnen ist die durch ähnliche Mechanismen ausgelöste gleichzeitige Reduktion der Knochenmasse, die Osteoporose, einer ebenfalls sehr häufigen Komplikation entzündlich rheumatischer Erkrankungen.
Im Hinblick auf Bewegung und Training muss betont werden, dass der kachexiebedingte Verlust an Muskelmasse, die wegen des Körperfettanteils nicht in jedem Falle auffällig ist, hinsichtlich der Belastbarkeit unbedingt berücksichtigt werden muss.
Direkte Einflüsse auf Knorpel und Bänder
Die primäre Funktion des hyalinen Knorpels ist es, den Knochen vor Läsionen zu schützen und Reibungskräfte zu vermindern. Es ist bekannt, dass Phasen der Kompression und Dekompression, wie sie in rhythmischen belastungsabhängigen Trainingseinheiten erreicht werden können, zu einer besseren Nährstoffzufuhr und somit langfristig zum Schutz des Knorpels beitragen. Länger dauernde Immobilisierung führen zu einer verminderten Versorgung und zur Abnahme der Elastizität (Arokoski et al. 2000).
Auch an den Gelenkbändern, die zur Stabilisierung des Gelenks notwendig sind, konnte gezeigt werden, dass regelmäßiges Training zu einer Festigung des Bandapparats führt und schon kurze Immobilisationsphasen diese schwächen (Benjamin u. Ralphs 1997). Bei Patienten mit Rheumatoider Arthritis findet sich häufig eine entzündliche Mitbeteiligung der Sehnenscheiden, so dass diese ähnlich einem Alterungsprozess an Elastizität und Rissfestigkeit verlieren, ein Prozess, der durch regelmäßiges Training gestoppt werden kann (Buchanan u. Marsh 2002).
Die häufigste Frage: Verschlechtert körperliche Aktivität die Erkrankung?
Die Vorteile einer regelmäßigen Trainingstherapie bei Patienten mit Rheumatoider Arthritis sind seit langem bekannt, wie auch in einem Review von Van Den Ende 1998 dargestellt. Insgesamt sind die Studien allerdings meist klein und methodisch aufgrund vieler einzelner Messparameter verwirrend. Über viele Jahre wurde jedwede Trainingstherapie bei entzündlich rheumatischer Erkrankung als kontraindiziert angesehen, da eine Verschlechterung der Entzündungsaktivität befürchtet wurde. Auch viele Patienten äußern diese Bedenken gegenüber einer Trainingstherapie und meiden sportliche Aktivität (Law et al. 2010). Die Evidenz mehrerer Studien spricht gegen eine Aktivierung der Entzündung. In der RAPIT-Studie von De Jong et al. (2003) wurde eine Patientengruppe mit zweimal wöchentlichem Trainingsprogramm mit aerobem Ausdauertraining, Muskelkräftigung mittels Widerstandstraining und Dehnungsübungen mit einer konventionellen Patientengruppe verglichen. 309 Patienten mit stabiler Erkrankung wurden mit dem primären Studienendpunkt der radiologischen Progression im Larsson-Score über 2 Jahre beobachtet. Bei einer Gesamtprogression von 0,8 versus 1,3 Punkte zeigte sich in der Interventionsgruppe sogar eine statistisch signifikante Verbesserung (p = 0,0045) Auch im sekundären Studien-endpunkt der klinischen Krankheitsaktivität, gemessen mit dem DAS-4-Score – zusammengesetzt aus der Anzahl der geschwollenen und druckschmerzhaften Gelenke, der Blutsenkungsgeschwindigkeit und einen VAS-Score (visuelle Analog-Skala) durch den Patienten – zeigte sich in der Interventionsgruppe keine Verschlechterung gegenüber der Vergleichsgruppe, bei gleichzeitig statistisch signifikanter Besserung der körperlichen Fitness (De Jong et al. 2004). Es fand sich keine vermehrte Gelenksschädigung, weder bei den großen Gelenken noch bei den kleinen Gelenken von Finger und Fuß im Langzeitverlauf über Jahre (De Jong et al. 2009).
Welcher Sport kann bei Rheumatoider Arthritis empfohlen werden?
Wie auch in der Präventivmedizin ergeben sich zwei Zielrichtungen: das aerobe Ausdauertraining zur Verbesserung der kardiovaskulären Risikofaktoren und der allgemeinen Leistungsfähigkeit sowie das gezielte Krafttraining zum Ausgleich lokaler Funktionseinschränkungen und zur Prävention der Rheumatoiden Kachexie. Natürlich muss das Trainingsprogramm auf die individuellen Bedürfnisse des Patienten abgestimmt werden, eine Überlastung bereits geschädigter Gelenke sollte vermieden werden.
Das aerobe Training im Sinne von Laufen, Wandern, Nordic Walking, Radfahren, Tanzen oder auch Schwimmen sollte an 3 bis 5 Tagen pro Woche über 30–60 Minuten mit 60–80 % der maximalen Herzfrequenz durchgeführt werden. Dadurch ist eine Verbesserung der aeroben Kapazität, eine Abnahme aktiver Gelenksentzündung durch Modulation des Immunsystems, eine Erhöhung des Insulin-like-Growth-Factor-Spiegels nachgewiesen (Lemmey et al. 2009). Für den Patienten bedeutet dies einerseits eine Verminderung von Schmerzen und damit auch eine gleichzeitige Verbesserung der Lebensqualität bei Abnahme der chronischen Müdigkeit (Stavropoulos-Kalinoglou et al. 2013; Baillet et al. 2010).
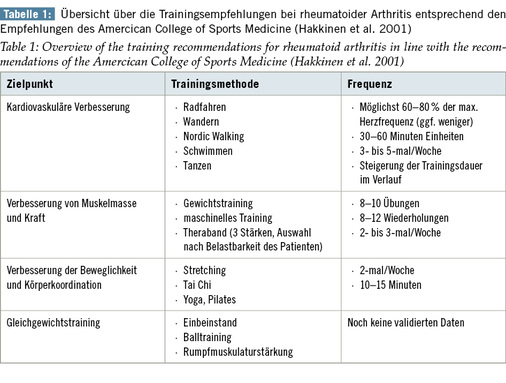
Neben diesem allgemeinen Ausdauertraining sollte speziell auf den Patienten abgestimmt ein progressives Widerstandstraining – oft in Form eines maschinell unterstützten Trainings beim Physiotherapeuten oder auch im Fitnessstudio – erfolgen. Ziel ist hierbei die Verbesserung funktioneller Schwächen durch Muskelaufbau so z. B. der Handkraft (Hakkinen et al. 2001). Neben der Verbesserung der Kraft zeigte sich ein Rückgang der systemischen Inflammation, der Morgensteifigkeit und eine Anhebung des allgemeinen Wohlbefindens (Linde et al. 2009). Das optimale Trainingsprogramm beinhaltet beide Übungsstrategien, abgestimmt auf die individuellen Bedürfnisse des Patienten sowie auch die vor Ort vorhandenen Möglichkeiten. Idealerweise wird eine professionelle Überwachung z. B. durch Sportmediziner und Physiotherapeuten angeboten. Welches das minimal zu empfehlende Bewegungsausmaß darstellt, ist bisher nicht bewiesen, aber auch eine einmal wöchentlich durchgeführte Trainingseinheit (z. B. in Form einer Turngruppe) führt bereits zu einer Verbesserung des HAQ-Scores (= Health Assessement Score, ein validierter Fragebogen zur Erfassung von Behinderungen bei chronisch entzündlichen rheumatischen Erkrankungen) und dem allgemeinen Gesundheitsstatus ( Tabelle 1) (Durstine et al. 2003).
Morbus Bechterew
Die ankylosierende Spondylitis ist der Hauptvertreter der Spondylathropathien, die in den ASAS-Klassifikationskriterien definiert werden (Rudwaleit et al. 2009). Neben dem Nachweis einer Sakroileiitis in Röntgen oder MRT, sowie der Assoziation mit HLA B 27, stellt der entzündliche Rückenschmerz ein typisches Zeichen dar. Diese Schmerzen treten vor allem nachts im Liegen auf und bessern sich nach dem Aufstehen und bei Bewegung. Somit stellt die Bewegungstherapie seit langem einen wesentlichen Bestandteil aller Behandlungskonzepte dar (Dagfinrud et al. 2009). Es gibt jedoch überraschend wenige kontrollierte Studien, die diese empirischen Konzepte langfristig überprüft haben. Die meisten Empfehlungen teilen sich in allgemeine Verhaltensweisen, ein regelmäßiges Heimtrainingsprogramm sowie Gruppentraining auf (s. Übersicht 1).
Viele ältere Studien über die Wirksamkeit der Heimtrainingsprogramme konnten zuletzt auch nach neueren Kriterien beurteilt, wiederum bestätigt werden (Aytekin et al. 2012). Idealerweise wird hierbei an 3–5 Tagen der Woche ein Programm durchgeführt, bestehend aus Atemübungen, Dehnungsübungen für Wirbelsäule und Hüften, Gleichgewichtsübungen zur Stärkung der paravertebralen autochthonen Muskulatur sowie aus einem Ausdauertraining im Sinne von Radfahren und Wandern. Wünschenswert ist eine einmal wöchentliche Gruppentherapie unter der Anleitung eines Therapeuten, um falsch eingelernte Bewegungsmuster zu korrigieren und eventuell neu aufgetretenen Problemen (z. B. muskuläre Dysbalancen nach vermehrter Arbeitsbelastung) gezielt entgegen wirken zu können (Dagfinrud et al. 2011). Die Vorteile dieser Konzepte sind bekannt, das Problem liegt jedoch in der notwendigen lebenslangen Adhärenz.
Eine etablierte Therapieoption – und von vielen Patienten sehr geschätzt – sind regelmäßige (z. B. einmal jährliche) intensive mehrwöchige Rehabilitationsaufenthalte in entsprechenden Zentren, wodurch eine Stabilisierung über Monate erreicht werden kann. Die Kosteneffektivität dieser Rehabilitationen ist ein stetiger Diskussionspunkt mit den Versicherungsgesellschaften. Vielversprechend erscheint der relativ neue Therapieansatz in der Kombination der Bewegungstherapie mit einer verbesserten Entzündungskontrolle durch TNF-Blocker (Masiero et al. 2011). Als besonderer Vorteil dieser Kombination wirkt sich aus, dass die Bereitschaft zur Bewegung bei vermindertem Entzündungsschmerz zunimmt.
Autoimmun inflammatorische Muskelerkrankungen
Diese seltenen Erkrankungen – Dermatomyositis, Polymyositis, Einschlusskörperchenmyositis – sind gekennzeichnet durch symmetrische Muskelschwäche, eingeschränkter Ausdauer und Schmerzen unter Belastung. Im Langzeitverlauf kommt es durch die entzündliche Infiltration des Muskels zu lokalen metabolischen Störungen. Als eine der pathophysiologischen Ursachen zeigte sich in Muskelbiopsien eine Hochregulation von Interleukin 1 als Entzündungsmediator, eine verminderte Dichte an Gewebskapillaren sowie erniedrigte Spiegel an Adenosintriphosphat und Phosphokreatin, in Summe einem hypoxämischen Status des Muskelgewebes entsprechend. Durch dosiertes aerobes Ausdauertraining werden die Leistungsfähigkeit und damit die Lebensqualität verbessert sowie gleichzeitig ein Schutz gegen Muskelatrophie erreicht. In keiner Studie zeigte sich dabei eine Verschlechterung der entzündlichen Aktivität im Muskel oder die Notwendigkeit zur Steigerung der Immunsuppression, bei gleichzeitiger Verbesserung der Muskelkraft, der aeroben Leistungsfähigkeit und damit auch der täglichen Aktivität. Unklar ist weiterhin, welche Trainingsform zu bevorzugen ist (Alexanderson u. Lundberg 2012; Munters et al. 2013).
Sytemischer Lupus erythematodes (SLE)
SLE ist eine Autoimmunerkrankung, in deren Verlauf es zu multiplen Organbeteiligungen kommen kann. Ähnlich der Rheumatoiden Arthritis ist eine frühzeitige und verstärkte Atherosklerose festzustellen, unabhängig von den klassischen Risikofaktoren. Das Ausmaß des Fortschreitens der Atherosklerose steht in Assoziation mit der Krankheitsdauer und der Höhe des Homocysteinspiegels (Von Feldt et al. 2006). Ein weiterer typischer Aspekt im Verlauf der Erkrankung ist ein chronisches Müdigkeitssyndrom – Fatigue – wodurch im Extremfall selbst Aktivitäten des täglichen Lebens (ADL, "activities of daily life") nicht mehr selbstständig durchgeführt werden können. Regelmäßig wird bei SLE-Patienten eine eingeschränkte Leistungsfähigkeit und verminderte körperliche Aktivität festgestellt (Eriksson et al. 2012). Beide Punkte, kardiovaskuläres Risiko und Fatigue, konnten bei anderen Krankheitsbildern gezielt durch eine Trainingstherapie verbessert werden, die Daten in der Therapie des SLE sind hierzu jedoch begrenzt (Strombeck u. Jacobsson 2007).
Im Rahmen der Fatigue-Symptomatik kommt es häufig zu einem sozialen Rückzug, der Weg zur physikalischen Therapie ist zu beschwerlich und aufwändig. Einen möglichen Ansatz für ein Heimtrainingsprogramm zeigte eine kürzlich publizierte Studie: den Einsatz einer interaktiven Spielkonsole an einen Fernseher gebunden. 15 Patientinnen wurden angehalten, über 10 Wochen jeweils dreimal wöchentlich ein Wii Fit Programm durchzuführen. Nintendo Wii ist eine fernsehgebundene Spielkonsole, die durch Bewegungssensoren den Spieler in das Spiel mit einbindet. Der Vorteil ist die leichte Verfügbarkeit und die regelmäßige Motivation der Patienten durch die computergestützte Animation. Somit war eine auffallend gute Compliance zu erreichen. Die Interventionsgruppe zeigte nach 10 Wochen einen signifikant erniedrigten Fatigue-Score, eine Reduktion des Gewichts und Bauchumfanges und eine Reduktion in den Depressions-Scores (Yuen et al. 2011).
Zusammenfassung
Es hat in den letzten Jahren große Fortschritte in der Behandlung ent-zündlich rheumatischer Erkrankungen gegeben. Im Mittelpunkt der meisten Studien steht dabei meist die Reduktion der Krankheitsaktivität, gemessen an klinischen und laborabhängigen Scores. Im Langzeitverlauf der Patienten noch unbeantwortet sind die Fragen der Begleiterkrankungen, die zu einer erhöhten Morbidität und Mortalität führen.
Es bestehen mehrere Gründe für eine Reduktion der körperlichen Aktivität bei chronisch entzündlichen Rheumaerkrankungen: Schmerzen, die Angst, durch Belastung eine Gelenksschädigung und Entzündungsaktivierung zu verursachen, sowie häufig ein Erschöpfungssyndrom, Punkte, die insgesamt zu einem vermehrten sozialen Rückzug führen.
All diese Faktoren werden durch sportliche Betätigung günstig beeinflusst. Es gibt keine Hinweise für eine Aggravierung der Entzündungsaktivität in einer Vielzahl von Studien bei den vorgestellten Formen entzündlicher rheumatischer Erkrankungen. Eine Tatsache, die unseren Patienten bewusst gemacht werden muss. Schon bei Diagnosestellung sollte die Bewegungstherapie mit dem Patienten angesprochen werden und im Verlauf ein individuelles Programm abhängig von Alter, vorbestehenden Behinderungen und den lokalen Möglichkeiten entwickelt werden. Je höher die aktuelle Entzündungsaktivität ist, desto geringer sollte die Belastung sein, aber Bewegung ist trotzdem immer möglich. Jede Patientenvisite sollte dazu genützt werden, den Patienten zu vermehrter körperlicher Aktivität zu motivieren.
Literatur
Aletaha D, Neogi T, Silman AJ et al.: Rheumatoid arthritis classification criteria: An American College of Rheumatology/European League Against Rheumatism collaborative initiative. Arthritis Rheum 2010; 62: 2569–2581.
Alexanderson H, Lundberg IE: Exercise as a therapeutic modality in patients with idiopathic inflammatory myopathies. Curr Opin Rheumatol 2012; 24: 201–207.
Arokoski JPA, Jurvelin JS, Vatainen U, Helminen HJ: Normal and pathological adaptations of articular cartilage to joint loading. Scan J Med Sci Sports 2000; 10: 186–198.
Aytekin E, Caglar NS, Ozgonenel L et al. Home-based exercise therapy in patients with ankylosing spondylitis: effects on pain, mobility, disease activity, quality of life, and respiratory functions. Clin Rheumatol 2012; 31: 91–97.
Baillet A, Zeboulon N, Gossec L, Combescure C, Bodin LA, Juvin R, Dougados M, Gaudin P: Efficacy of cardiorespiratory aerobic exercise in rheumatoid arthritis: meta-analysis of randomized controlled trials. Arthritis Care Res (Hoboken) 2010; 62: 984–992.
Benjamin M, Ralphs JR: Tendons and ligaments – an overview. Histol Histopathol 1997; 12: 1135–1144.
Buchanan CI, MarshRL: Effects of exercise on the biomechanical, biochemical and structural properties of tendons. Comp Biochem Physiol 2002; 133: 1101–1107.
Dagfinrud H, Halvorsen S, Vollestad NK et al.: Exercise programs in trials for patients with ankylosing spondylitis: do they really have the potential for effective-ness? Arthritis Care Res 2011; 63: 597–603.
Dagfinrud H, Kvien TK, Hagen KB: Physiotherapy interventions for ankylosing spondylitis. Cochrane Database Syst Rev 2009; 23: CD002822.
De Jong Z, Munneke M, Kroon HM et al.: Long-term follow-up of a high intensity exercise program in patients with rheumatoid arthritis. Clin Rheumatol 2009; 28: 663–671.
De Jong Z, Munneke M, Zwinderman AH et al.: Is a longterm highintensity exercise program effective and safe in patients with rheumatoid arthritis? Results of a ran-domized controlled trial. Arthritis Rheum 2003; 48: 2415–2424.
De Jong Z, Munneke M, Zwinderman AH et al.: Long term high intensity exercise and damage of small joints in rheumatoid arthritis. Ann Rheum Dis 2004; 63: 1399–1405.
Durstine J, Moore GE, Lainter P, Roberts SO: ACSM’s exercise managment for persons with chronic diseases and disabilities. 3rd edn. Champaign, Ill, USA: Human Kinetics, 2003, pp. 316.
Eriksson K, Svenungsson E, Karreskog H et al. Physical activity in patients with systemic lupus erythematosus and matched controls. Scand J Rheumatol 2012; 41: 290–297.
Franklin BA, McCullough PA: Cardiorespiratory fitness: an independent and ad-ditive marker of risk stratification and health outcomes. Mayo Clinic Proceedings 2009; 84: 776–779.
Hakkinen A, Sokka T, Kotaniemi A, Hannonen P: A randomized two-year study of the effects of dynamic strength training on muscle strength, disease activity, func-tional capacity, and bone mineral density in early rheumatoid arthritis. Arthritis Rheum 2001; 44: 515–522.
Hällgren R, Beerne C: Glucose intolerance in patients with chronic inflammatory diseases is normalized by glucocorticoids. Acta Med Scand 1983; 213: 351–355.
Lang CH, Frost RA: Role of growth hormone, insulin like growth factor-I and insulin like growth factor binding proteins in the catabolic response to injury and infection. Curr Opin Clin Nutr Metab Care 2002; 5: 271–279.
Law RJ, Breslin A, Oliver EJ, Mawn L, Markland DA et al.: Perceptionsof the effects of exercise on joint health in rheumatoid arthritis patients. Rheumatology 2010; 49: 2444–2451.
Lemmey AB, Marcora SM, Chester K, Wilson S, Casanova F, Maddison PF: Effects of high-intensity resistance training in patients with rheumatoid arthritis: a rando-mized controlled trial. Arthritis Rheum 2009; 61: 1726–1734.
Munters LA, Dastmalchi M, Katz A et al.: Improved exercise performance and increased aerobic capacity after endurance training of patients with stable poly-myositis and dermatomyositis. Arthritis Res Ther 2013, 15: R83.
Linde L, Sorensen J, Ostergaard M et al.: What factors influence the health status of patients with rheumatoid arthritis measured by the SF-12v2 health survey and the health assessment questionnaire? J Rheum 2009; 36: 2183–2189.
Maradit-Kremers H, Crowson CS, Nicola PJ et al.: Increased unrecognized coro-nary heart disease and sudden deaths in rheumatoid arthritis: a population-based cohort study. Arthritis Rheum 2005; 52: 402–411.
Marcora SM,Chester KR, Mittal G et al.: Randomized phase 2 trial of anti-tumor necrosis factor therapy for cachexia in patients with early rheumatoid arthritis. Am J Clin Nutr 2006; 84: 1463–1472.
Masiero S, Bonaldo L, Pigatto M, Lo Nigro A, Ramonda R, Punzi L: Rehabilitation treatment in patients with ankylosing spondylitis stabilized with tumor necrosis factor inhibitor therapy. J Rheumatol 2011; 38: 1335–1342.
Morley JF, Thomas DR, Wilson MM: Cachexia pathophysiology and clinical relevance. Am J Clin Nutr 2006; 83: 735–743.
Paolisso G,Valentini G, Giugliano D et al.: Evidence for peripheral impaired glucose handling in patients with connective tissue disease. Metabolism 1991; 40: 902–907.
Rincon ID, Williams K, Stern MP et al.: High incidence of cardiovascular events in a rheumatoid arthritis cohort not explained by traditional cardiac risk factors, Arthritis Rheum 2001; 44: 2737–2745.
Rudwaleit M, Braun J, Sieper J: Die ASAS Klassifikationskriterien für axiale Spondylarthritis. Z Rheumatol 2009; 68: 591–593.
Sattar N, McCarey DW,Campell H, MvInnes IB: Explaining how „high grad“ systemic Inflammation accelerates vascular risk in rheumatoid arthritis. Circula-tion 2003: 108: 2957–2963.
Schneider M, Lelgemann M, Abholz H-H et al.: DGRh-Leitlinie: Management der frühen rheumatoiden Arthritis. 3. Aufl. Berlin: Springer, 2011, S. 19–21.
Solomon DH, Karlson EW, Rimm EB et al.: Cardiovascular morbidity and mortality in women diagnosed with rheumatoid arthritis. Circulation 2003; 107: 1303–1307.
Stavropoulos-Kalinoglou A, Metsios GS, Veldhuijzen van Zanten JJ, Nightingale P, Kitas GD, Koutedakis Y: Individualised aerobic and resistance exercise training improves cardiorespiratory fitness and reduces cardiovascular risk in patients with rheumatoid arthritis. Ann Rheum Dis 2013; 72: 1819–1825.
Strombeck B, Jacobsson LT: The role of exercise in the rehabilitation of patients with systemic lupus erythematodes and patients with primary Sjögren‘s syndrome. Curr Opin Rheumatol 2007; 19: 197–203.
Van Den Ende CH, Vliet Vlieland TP, Munneke M, Hazes JM: Dynamic exercise therapy in rheumatoid arthritis: a systematic review. Br J Rheumatol 1998; 37: 677–687.
Von Feldt JM, Scalzi LV, Cucchiara AJ et al.: Homocysteine levels and disease duration independently correlate with coronary artery calcification in patients with systemic lupus erythematosus. Arthritis Rheum 2006; 54: 2220–2227.
Yuen HK, Holthaus K, Kamen DL, Sword DO, Breland HL: Using Wii Fit to re-duce fatigue among African American women with systemic lupus erythematodes. Lupus 2011; 20: 1293–1299.
Verfasser
Dr. med. Peter Oswald
Interne Abteilung
BKH Kufstein
Endach 27 – 6330 Kufstein
Österreich
ASU Arbeitsmed Sozialmed Umweltmed 2014; 49: 375–380
Fußnoten
Bezirkskrankenhaus Kufstein, Interne Abteilung (Leiter: Prim. Univ.-Prof. Dr. med. Klaus Gattringer)