Der Einfluss des Metabolischen Syndroms auf zelluläre und molekulare Pathomechanismen in der Osteoarthrose
Die Osteoarthrose (OA) ist epidemiologisch betrachtet eine der bedeutendsten orthopädischen Erkrankungen. Vor dem Hintergrund der demographischen Veränderungen in den Industrieländern wird mit einer Verdoppelung der Prävalenz bis zum Jahre 2020 gerechnet. Das klinische Bild der OA ist gekennzeichnet durch eine episodische Schmerzsymptomatik und körperliche Funktionseinschränkung und kann Symptome einer Inflammation mit rezidivierender Schwellung und Überwärmung der Gelenke aufweisen.
Die OA ist eine multifaktorielle Erkrankung mit einer bislang ungeklärten Ätiologie. Entgegen der ursprünglichen Annahme einer Verschleißerkrankung, bei der der Knorpel im Sinne von „tear and wear“ abgenutzt wird, zeigt die aktuelle Literatur, dass das Gleichgewicht zwischen katabolen und anabolen Mechanismen und die hiermit verbundenen zellulären Pathomechanismen entscheidend zum Prozess der Gelenkdestruktion beitragen. Sowohl in humanen Studien als auch im Tiermodell, wird die Gelenkdegeneration aktiv durch zelluläre und enzymatische Prozesse vorangetrieben.
Adipositas stellt neben Alter und Trauma einen der Hauptrisikofaktoren für das Auftreten und Fortschreiten der OA dar. Dies kann nicht nur durch eine mechanische Überbeanspruchung der Gelenke erklärt werden. Eine Vielzahl von Studien weist darauf hin, dass eine systemische metabolische Komponente zur OA Pathologie beitragen kann. Ein genaueres Verständnis dieser Pathomechanismen ist essentiell, um neue innovative Therapieansätze zu entwickeln, mit denen das Auftreten und Fortschreiten der OA verhindert werden kann.
Schlüsselbegriffe: Osteoarthrose – synoviale Inflammation – Metabolisches Syndrom
The impact of metabolic syndrome on cellular and molecular mechanisms of osteoarthritis
Osteoarthritis (OA) is regarded as one of the most important diseases in epidemiological terms. Its prevalence is expected to double by the year 2020 due to demographic changes in the industrialised nations. The clinical picture of OA is characterised by episodes of pain and funtional limitations. Other symptoms may be inflammation with recurrent swelling and overheated joints.
OA is a multifactorial disorder whose aetiology is as yet unclear. Contrary to the original assumption that the disease is a result of wear and tear, whereby cartilage is worn away, current reference literature shows that the balance between catabolic and anabolic mechanisms and the related cellular pathomechanisms make a key contribution to the process of joint damage. Joint degeneration is actively promoted by cellular and enzymatic processes, both in human studies and the animal model.
Obesity is one of the main risk factors for the occurrence and progress of OA, alongside age and trauma. This cannot be explained simply by excess mechanical stress on the joints. A large number of studies indicate that a systemic metabolic component may contribute to the pathology of OA. A more precise understanding of these pathomechanisms is essential for the development of new and innovative therapeutic approaches that can be used to prevent the occurrence and progress of OA.
Keywords: osteoarthritis – synovial inflammation – metabolic syndrome
ASU Arbeitsmed Sozialmed Umweltmed 2016; 51: –506
Epidemiologie der Osteoarthrose
Die Osteoarthrose (OA) ist epidemiologisch betrachtet eine der bedeutendsten orthopädischen Erkrankungen. Sie ist mit über 40 % die häufigste Erkrankung des muskuloskelettalen Systems und betrifft weltweit über 10 % der adulten Population (Centers for Disease Control and Prevention [CDC] 1998; Dunlop et al. 2001). Vor dem Hintergrund der demografischen Veränderungen in den Industrieländern wird mit einer Verdoppelung der Prävalenz bis zum Jahre 2020 gerechnet (Centers for Disease Control and Prevention [CDC] 1998). In der „Global Burden of Disease 2000 Study“ wurde die OA als die vierthäufigste Diagnose für „total years lost due to disease“ identifiziert (Lopez u. Murray 1998). Klinisch präsentiert sich die OA durch eine episodische Schmerzsymptomatik und eine körperliche Funktionseinschränkung. Die Daten der deutschen Gesundheitsumfrage zeigen, dass die Lebenszeitprävalenz der Arthrose bei Frauen im Jahr 2010 bei ca. 25 % und bei Männern bei ca. 16 % lag (Robert Koch-Institut 2012). Muskuloskelettale Schmerzen durch OA stellen die häufigste Ursache für Arbeitsunfähigkeit dar und führen zu psychosozialer Komorbidität (Kohlmann 2003). Diese Daten zeigen das epidemiologische Ausmaß dieses Gesundheitsproblems.
Ätiologie der Osteoarthrose
Osteoarthrose ist eine heterogene multifaktorielle Erkrankung und kann nach Ätiologie, Symptomatik und radiologischer Darstellung in Subtypen wie primäre und sekundäre Arthrose, Varus- und Valgusgonarthrose, uni- und bikondyläre Arthrose, eingeteilt werden. Es bleibt jedoch unklar, ob diese Subtypen einen einheitlichen Pathomechanismus teilen oder ob sie unterschiedliche zelluläre und molekulare Mechanismen aufweisen. Die Pathophysiologie konnte trotz bekannter biomechanischer, genetischer und molekularer Faktoren bislang nicht ausreichend entschlüsselt werden. Entgegen der ursprünglichen Annahme einer Verschleißerkrankung, im dem der Knorpel im Sinne von „tear and wear“ abgenutzt wird, zeigt die aktuelle Literatur, dass das Gleichgewicht zwischen katabolen und anabolen Mechanismen und die hiermit verbundenen zellulären und molekularen Pathomechanismen entscheidend zum Prozess der Gelenkdestruktion beitragen. Diese Studien zeigen, dass die Gelenkdegeneration aktiv durch zelluläre und enzymatische Prozesse vorangetrieben wird (Long et al. 2008; Nakamura et al. 1999; Hsu et al. 2004; Saito et al. 2002; Ishii et al. 2002; Scanzello et al. 2009; Goekoop et al. 2010; Klein-Wieringa et al. 2011; Yamada et al. 2011; Sohn et al. 2012). Hierbei nimmt der enzymatische Gewebeabbau durch Matrix-Metalloproteinasen (MMP-1, 2, 3, 9, 13) und Aggrekanasen (ADAMTS-1, 4, 5, 7) einen besonderen Stellenwert ein. Diese bauen Proteoglykane und Kollagen Typ II, als die wesentlichen Bestandteile der extrazellulären Matrix, ab. Es konnte gezeigt werden, dass MMP-2 und MMP-13 in erhöhtem Maß in der Synovialflüssigkeit von Patienten mit Gonarthrose freigesetzt werden und dass deren Menge mit der arthroskopisch festgestellten Knorpelschädigung korreliert (Marini et al. 2003). Ebenso konnten erhöhte MMP-1- und MMP-3-Level in der Synovialflüssigkeit von OA-Patienten nachgewiesen werden (Hsieh et al. 2004). Bestätigt wurde dies durch Ex-vivo-Zellkulturen von Synovialmembranproben, die erhöhte Spiegel von MMP-2, MMP-9 und MMP-13 aufwiesen (Tchetverikov et al. 2005). Tierexperimentelle Studien zeigen, dass diese Enzyme einen entscheidenden Stellenwert in dem Prozess der progredienten Gelenkdestruktion einnehmen. So schützen der Verlust von MMPs wie z. B. in MMP-13-Knock-out-Mäusen und genetische Veränderungen in der Knorpelmatrix (Aggrecan) das Gelenk im Mausmodell vor einem Knorpelabbau, trotz einer chirurgischen Induktion und einem Fortbestehen von Gelenkinstabilitäten (Barker et al. 2014; Shen et al. 2011; Lewis et al. 2013).
Zelluläre und molekulare Pathomechanismen in der Osteoarthrose
Obwohl OA als eine Erkrankung des gesamten Gelenks unter Beteiligung des Knorpels, des subchondralen Knochens, der Ligamente und der Synovialmembran verstanden wird, stellt speziell der Verlust des hyalinen Gelenkknorpels die präarthrotische Veränderung dar. Diese führt zu einer Aktivierung von zellulären und molekularen Signalkaskaden und kann den Startpunkt der OA darstellen. Nach initialer Knorpelschädigung, die als Folge von Traumata auftreten kann, kommt es zur Freisetzung von Signalmolekülen aus der Knorpelmatrix, den sog. „damage-associated molecular patterns“ (DAMPs). Hierdurch wird eine inflammatorische Reaktionskaskade unter Bildung proinflammatorischer Zytokine wie IL-1 und TNF-alpha durch Chondrozyten und Synovialzellen in Gang gesetzt. Inflammatorische Zellinfiltrate setzen durch direkten Zellkontakt sowie lösliche Faktoren eine Kaskade in Gang, die über die Aktivierung von MMPs und Aggrekanasen entscheidend zum Knorpel- und Knochenabbau beiträgt (Hsu et al. 2004; Roemer et al. 2011; Heard et al. 2013; Beekhuizen et al. 2013; Vangsness et al. 2011; Furuzawa-Carballeda et al. 2008). Obwohl die OA primär als eine nichtentzündliche Erkrankung angesehen wird, wird diesem inflammatorischen Pathomechanismen im Prozess der progredienten Gelenkdestruktion eine zunehmende Bedeutung beigemessen. Klinisch zeigen bis zu 50 % der OA-Patienten Symptome einer Inflammation mit rezidivierender Schwellung und Überwärmung der Gelenke (Guccione et a. 1994). Es wird vermutet, dass diese Synovialitis eine entscheidende Rolle in der Entwicklung der OA einnimmt. In weiteren aktuellen Studien wurde sowohl in humanen Proben als auch im Tiermodell die Rolle der Inflammation in der Pathogenese der OA weiter untersucht (Klein-Wieringa et al. 2011; Shen et al. 2011). Klinische Studien konnten zeigen, dass der magnetresonanztomographische Nachweis einer Inflammation einen prognostischen Faktor für die Progredienz der OA darstellt (Roemer et al. 2011). Des Weiteren zeigen tierexperimentelle Studien, dass die Modulation der inflammatorischen Kaskaden die Progression einer OA verlangsamen kann (Wang et al. 2011).
Es muss somit von einer größeren Bedeutung der Synovitis und der Balance der inflammatorischen Zellen und Zytokine in dem Prozess der enzymatischen Knorpel- und Knochendestruktion der OA ausgegangen werden, als bisher angenommen wurde. Daneben ist zu berücksichtigen, dass die oben beschriebenen Pathomechanismen zwar im Gelenk stattfinden, eine Anzahl von neuen Arbeiten jedoch darauf hindeuten, dass auch eine systemische Inflammation als Folge von metabolischen Erkrankungen zu der Manifestation und Progression der OA führen kann.
Adipositas
Die Adipositas ist als ein relevanter Risikofaktor für die Inzidenz und Progression der OA seit langem bekannt. Eine Vielzahl von epidemiologischen Studien belegt die Korrelation zwischen Body Mass Index (BMI) und der Inzidenz für OA (Anderson u. Felson 1988). Adipöse Patienten haben demnach ein erhöhtes Risiko, an bilateraler Gonarthrose zu erkranken (Felson et al. 1988; Cooper et al. 2000). Eine schwächere, aber signifikante Korrelation besteht ebenfalls für die Koxarthrose (Cooper et al. 1998; Grotle et al. 2008). Dieser Zusammenhang zwischen einem erhöhten BMI und der OA kann nur teilweise durch eine erhöhte mechanische Belastung der Gelenke erklärt werden. In experimentellen Studien konnte gezeigt werden, dass eine mechanische Belastung von Knorpelgewebe zu einer Freisetzung von proinflammatorischen Zytokinen wie IL-1, TNF-alpha und matrixdegenerierenden Enzymen (MMPs und ADATMS) führt (Chauffier et al. 2012; Gosset et al. 2006, 2008).
Es muss jedoch erwähnt werden, dass die Adipositas nicht nur einen Einfluss auf die OA der gewichttragenden Gelenke hat, sondern auch mit einem bis zu zweifach erhöhtem Risiko für OA der oberen Extremitäten und insbesondere der Fingergelenke assoziiert ist (Cicuttini et al. 1996; Yusuf et al. 2010). Dies lässt vermuten, dass die Adipositas möglicherweise zusätzlich durch einen systemischen Pathomechanismus zur Progression der OA beiträgt. Hierbei spielen die vom Fettgewebe freigesetzten Adipokine (Adiponectin, Leptin, Visfatin) durch ihren Einfluss auf den Lipid- und Kohlenhydratmetabolismus und ihren Einfluss auf inflammatorische Prozesse eine entscheidende Rolle (Conde et al. 2013; Lago et al. 2007). So konnten In-vitro-Studien nachweisen, dass diese Mediatoren zu einer vergleichbaren Aktivierung der Chondrozyten führen, wie mechanische Belastung und proinflammatorische Zytokine (Conde et al. 2013; Gosset et al. 2008).
Adipositas kann des Weiteren zu einer Vielzahl von weiteren Erkrankungen einschließlich Hypertension, Arteriosklerose, Diabetes mellitus und Hyperlipidämie führen.
Die Rolle des Metabolischen Syndroms in der Osteoarthrose
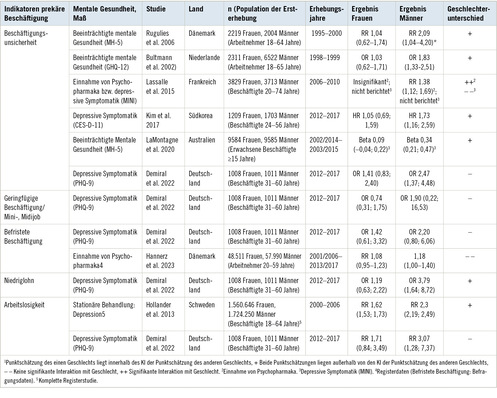
Die Kombination dieser Erkrankungen wird als Metabolisches Syndrom bezeichnet und führt bekanntermaßen zu einer signifikanten Erhöhung des kardiovaskulären Risikos (Day 2007). Der Einfluss des Metabolischen Syndroms und seiner Komponenten auf die OA wird in einigen aktuellen Studien diskutiert. In einer aktuellen Studie des National Health and Nutrition Examination Survey (NHANES) war die Prävalenz des Metabolischen Syndroms in Patienten mit OA auch nach der Adjustierung für Alter und BMI erhöht (Puenpatom u. Victor 2009). Des Weiteren konnte gezeigt werden, dass Adipositas in Kombination mit weiteren Komponenten des Metabolischen Syndroms zu einem signifikant erhöhten Risiko für Gonarthrose führte im Vergleich zu Adipositas allein (Sowers et al. 2009). Ein vergleichbar additiver Effekt für Adipositas, Diabetes und Hypertension wurde für OA der Hand nachgewiesen (Dahaghin et al. 2007).
In einer aktuellen Längsschnittstudie mit einem Nachuntersuchungszeitraum von 20 Jahren bei annähernd 1000 Patienten konnte Diabetes mellitus Typ 2 als ein Risikofaktor für OA unabhängig von Alter und BMI mit einem Hazard Ration von 2,1 (95 %-Konfidenzintervall 1,1–3,8) identifiziert werden (Schett et al. 2013). Die genauen Pathomechanismen sind weitestgehend unbekannt, jedoch kann Diabetes mellitus durch die Bildung von „advanced glycation endproducts“ (AGEs) über eine Veränderung der extrazellulären Matrix und Aktivierung von proinflammatorischen Pathways zur OA Pathogenese beitragen. Möglicherweise besteht nicht nur ein direkter Einfluss von Diabetes mellitus auf die OA-Pathologie, sondern ein zusätzlicher Effekt durch die systemischen Folgen des Diabetes mellitus, insbesondere durch die Arteriosklerose. Studien belegen eine Assoziation zwischen der Hand-OA und Arteriosklerose der Karotiden und Koronargefäße (Jonsson et al. 2009). Bei Patienten mit Gonarthrose oder Koxarthrose konnte eine erhöhte Mortalität durch kardiovaskuläre Erkrankungen festgestellt werden (Nuesch et al. 2011).
Da die Arteriosklerose zu einer signifikanten Beeinträchtigung der Blutversorgung führt, könnte eine resultierende Minderperfusion des subchondralen Knochens mit der Folge einer mangelhaften Versorgung des Knorpels eine relevante Rolle in der Pathogenese der OA spielen (Conaghan et al. 2005). Ob dieser Zusammenhang als Komorbidität zu betrachten ist, oder ursächlich zur OA-Pathophysiologie beiträgt, ist noch Gegenstand der Forschung.
Eine Reihe von Studien unterstreicht weiterhin die Korrelation zwischen Bluthochdruck und Osteoarthrose (Puenpatom u. Victor 2009; Engstrom et al. 2009). In der Chingford-Studie wurde eine signifikante Assoziation zwischen Hypertonie und bilateraler Gonarthrose, auch nach Adjustierung auf Alter und BMI, nachgewiesen (Hart et al. 1995). In einer weiteren Studie (ROAD Study) wurde die Korrelation zwischen Vorliegen und Progression der Gonarthrose und dem Bestehen eines arteriellen Hypertonus auch nach Adjustierung auf eine Reihe von weiteren Risikofaktoren nachgewiesen (Yoshimura et al. 2012).
Dyslipidemie und erhöhte Cholesterinwerte wurden ebenfalls als unabhängige Risikofaktoren für die OA nachgewiesen. In der Chingford-Studie waren erhöhte Serumcholesterinwerte mit Gonarthrose und OA der Hand unabhängig vom BMI assoziiert (Hart et al. 1995). Interessanterweise wiesen Patienten, die erhöhte Cholesterinwerte aufwiesen, aber beschwerdefrei waren, im Verlauf erhöhte subchondrale Läsionen auf (Davies-Tuck et al. 2009).
Stellenwert der Inflammation in der Osteoarthrose
Die Assoziation zwischen dem Metabolischen Syndrom und der Osteoarthrose könnte einerseits durch die einzelnen Komponenten und deren additivem Effekt erklärt werden. Andererseits könnte eine übergeordnete Pathologie zu den Erkrankungen des Metabolischen Syndroms und der OA führen. Eine systemische chronische Inflammation im Rahmen der Adipositas wird in einigen Arbeiten als Ursache für solch eine übergeordnete Pathologie diskutiert.
Obwohl klinisch ca. 50 % der Patienten Zeichen einer synovialen Entzündung aufweisen, wurde die OA lange als eine nichtentzündliche Erkrankung betrachtet. Eine Vielzahl an aktuellen Studien zeigt, dass die synoviale Inflammation nicht ein Begleitsymptom ist, sondern zur Progression der Erkrankung beiträgt. In zwei eigenen Arbeiten wurden die zellulären inflammatorischen Mechanismen in der Pathogenese der OA genauer untersucht. Hierzu wurden in der ersten Studie bei ca. 120 Patienten mit Gonarthrose (Kellgren & Lawrence Stadium I–IV) Proben der Synovialmembran, der Synovialflüssigkeit und des peripheren Blutes analysiert. Die Patientenproben wurden während Arthroskopien (K&L I–II) und endoprothetischen Operationen (uni- und bikondylärer Oberflächenersatz; K&L III–IV) gesammelt (Moradi et al. 2015). In einer zweiten Studie wurden diese Daten mit Proben von Patienten mit rheumatoider Arthritis verglichen (Moradi et al. 2014). Es konnte gezeigt werden, dass in den arthrotischen Gelenken eine signifikante Erhöhung von inflammatorischen Zellen im Vergleich zum peripheren Blut vorliegt und dass zudem ein Ungleichgewicht zugunsten der proinflammatorischen Subpopulation der T-Zellen vorhanden ist. Hierbei waren die Anteile der inflammatorischen T-Zellen, die als Th1- und Th17-Subpopulationen bekannt sind, signifikant höher im Gelenk angereichert als die regulatorischen T-Zellen (Tregs), die eine inflammatorische Immunantwort supprimieren können. Der Vergleich zwischen den verschiedenen Arthrosestadien zeigte, dass sich dieses Inflammationsmuster mit der Progression der OA zunahm. Es sind somit spezifische Mechanismen vorhanden, die Infiltration des Gelenkes mit mononukleären Zellen steuern. Wie diese Infiltration gesteuert wird und was sie triggert, bleibt noch unklar und ist Gegenstand aktueller Untersuchungen.
Aus der rheumatologischen Forschung ist bekannt, dass die Entschlüsselung inflammatorischer Mechanismen einen vielversprechenden Ansatz in der Entwicklung neuer Therapiestrategien darstellt. Sowohl die lokale Inflammation im Gelenk, als auch eine systemische chronische Inflammation könnten in der OA-Pathophysiologie eine entscheidende Rolle spielen.
Trotz der sozioökonomischen Bedeutung dieser Erkrankung sind unsere bisherigen Erkenntnisse über die Mechanismen der Knorpeldegeneration und das Fortschreiten der OA jedoch nur marginal. Die vorliegende Arbeit gibt einen Überblick über aktuelle Denkrichtungen in diesem Bereich. Ein genaueres Verständnis kann helfen, neue innovative Therapieansätze zu entwickeln, um das Auftreten und Fortschreiten der OA zu verhindern. Die weiterführende Analyse der synovialen und systemischen Inflammation in dem Prozess der enzymatischen Knorpeldegeneration könnte in diesem Kontext ein vielversprechender Ansatz sein.
Literatur
Anderson JJ, Felson DT: Factors associated with osteoarthritis of the knee in the first national Health and Nutrition Examination Survey (HANES I). Evidence for an association with overweight, race, and physical demands of work. Am J Epidemiol 1988; 128: 179e89.
Barker T, Rogers VE, Henriksen VT, Aguirre D, Trawick RH, Rasmussen GL, Momberger NG: Serum cytokines are increased and circulating micronutrients are not altered in subjects with early compared to advanced knee osteoarthritis. Cytokine 2014; 68: 133–136.
Beekhuizen M, Gierman LM, van Spil WE, Van Osch GJVM, Huizinga TWJ, Saris DBF, Creemers LB, Zuurmond A-M: An explorative study comparing levels of soluble mediators in control and osteoarthritic synovial fluid. Osteoarthr Cartil 2013; 21: 918–922.
Centers for Disease Control and Prevention (CDC): Prevalence and impact of chronic joint symptoms – seven states, 1996. MMWR Morb Mortal Wkly Rep 1998; 47: 345–351.
Chauffier K, Laiguillon MC, Bougault C et al.: Induction of the chemokine IL-8/Kc by the articular cartilage: possible influence on osteoarthritis. Joint Bone Spine 2012; 79: 604–609.
Cicuttini FM, Baker JR, Spector TD: The association of obesity with osteoarthritis of the hand and knee in women: a twin study. J Rheumatol 1996; 23: 1221e6.
Conaghan PG, Vanharanta H, Dieppe PA: Is progressive osteoarthritis an atheromatous vascular disease? Ann Rheum Dis 2005; 64: 1539e41.
Conde J, Scotece M, Lopez V et al.: Adipokines: novel players in rheumatic diseases. Discov Med 2013; 15: 73–83.
Cooper C, Inskip H, Croft P et al.: Individual risk factors for hip osteoarthritis: obesity, hip injury, and physical activity. Am J Epidemiol 1998; 147: 516–522.
Cooper C, Snow S, McAlindon TE et al.: Risk factors for the inci- dence and progression of radiographic knee osteoarthritis. Arthritis Rheum 2000; 43: 995–1000.
Dahaghin S, Bierma-Zeinstra SM, Koes BW et al.: Do metabolic factors add to the effect of overweight on hand osteoarthritis? The Rotterdam Study. Ann Rheum Dis 2007; 66: 916–920.
Davies-Tuck ML, Hanna F, Davis SR et al.: Total cholesterol and triglycerides are associated with the development of new bone marrow lesions in asymptomatic middle-aged women – a prospective cohort study. Arthritis Res Ther 2009; 11: R181.
Day C: Metabolic syndrome, or What you will: definitions and epidemiology. Diabetes Vasc Dis Res 2007; 4: 32–38.
Dunlop DD, Manheim LM, Song J, Chang RW: Arthritis prevalence and activity limitations in older adults. Arthritis Rheum 2001; 44: 212–221.
Engstrom G, Gerhardsson de Verdier M, Rollof J et al.: C-reactive protein, metabolic syndrome and incidence of severe hip and knee osteoarthritis. A population-based cohort study. Osteoarthritis Cartilage 2009; 17: 168–173.
Felson DT, Anderson JJ, Naimark A et al.: Obesity and knee osteoarthritis. The Framingham Study. Ann Intern Med 1988; 109: 18–24.
Furuzawa-Carballeda J, Macip-Rodríguez PM, Cabral AR: Osteoarthritis and rheumatoid arthritis pannus have similar qualitative metabolic characteristics and pro-inflammatory cytokine response. Clin Exp Rheumatol 2008; 26: 554–560.
Goekoop RJ, Kloppenburg M, Kroon HM, Frölich M, Huizinga TWJ, Westendorp RGJ, Gussekloo J: Low innate production of interleukin-1beta and interleukin-6 is associated with the absence of osteoarthritis in old age. Osteoarthr Cartil 2010; 18: 942–947.
Gosset M, Berenbaum F, Levy A et al.: Mechanical stress and prostaglandin E2 synthesis in cartilage. Biorheology 2008; 45: 301–320.
Gosset M, Berenbaum F, Levy A et al.: Prostaglandin E2 synthesis in cartilage explants under compression: mPGES-1 is a mechanosensitive gene. Arthritis Res Ther 2006; 8: R135.
Gosset M, Berenbaum F, Salvat C et al.: Crucial role of visfatin/pre-B cell colony-enhancing factor in matrix degradation and prostaglandin E2 syn- thesis in chondrocytes: possible influence on osteoarthritis. Arthritis Rheum 2008; 58: 1399–1409.
Grotle M, Hagen KB, Natvig B et al.: Obesity and osteoarthritis in knee, hip and/or hand: an epidemiological study in the general population with 10 years follow-up. BMC Musculoskelet Disord 2008; 9: 132.
Guccione AA, Felson DT, Anderson JJ, Anthony JM, Zhang Y, Wilson PW, Kelly-Hayes M, Wolf PA, Kreger BE, Kannel WB: The effects of specific medical conditions on the functional limitations of elders in the Framingham Study. Am J Public Health 1994; 84: 351–358.
Hart DJ, Doyle DV, Spector TD: Association between metabolic factors and knee osteoarthritis in women: the Chingford Study. J Rheumatol 1995; 22: 1118–1123.
Heard BJ, Fritzler MJ, Wiley JP, McAllister J, Martin L, El-Gabalawy H, Hart DA, Frank CB, Krawetz R: Intraarticular and systemic inflammatory profiles may identify patients with osteoarthritis. J Rheumatol 2013; 40: 1379–1387.
Hsieh Y-S, Yang S-F, Chu S-C, Chen P-N, Chou M-C, Hsu M-C, Lu K-H: Expression changes of gelatinases in human osteoarthritic knees and arthroscopic debridement. Arthroscopy 2004; 20: 482–488.
Hsu Y-H, Hsieh M-S, Liang Y-C, Li C-Y, Sheu M-T, Chou D-T, Chen T-F, Chen C-H: Production of the chemokine eotaxin-1 in osteoarthritis and its role in cartilage degradation. J Cell Biochem 2004; 93: 929–939.
Ishii H, Tanaka H, Katoh K, Nakamura H, Nagashima M, Yoshino S: Characterization of infiltrating T cells and Th1/Th2-type cytokines in the synovium of patients with osteoarthritis. Osteoarthr Cartil 2002; 10: 277–281.
Jonsson H, Helgadottir GP, Aspelund T et al.: Hand osteoarthritis in older women is associated with carotid and coronary atherosclerosis: the AGES Reykjavik study. Ann Rheum Dis 2009; 68: 1696–1700.
Klein-Wieringa IR, Kloppenburg M, Bastiaansen-Jenniskens YM, Yusuf E, Kwekkeboom JC, El-Bannoudi H, Nelissen RGHH, Zuurmond A, Stojanovic-Susulic V, Van Osch GJVM, Toes REM, Ioan-Facsinay A: The infrapatellar fat pad of patients with osteoarthritis has an inflammatory phenotype. Ann Rheum Dis 2011; 70: 851–857.
Kohlmann T: [Musculoskeletal pain in the population]. Schmerz 2003, 17: 405–411.
Lago F, Dieguez C, Gomez-Reino J et al.: The emerging role of adipokines as mediators of inflammation and immune responses. Cytokine Growth Factor Rev 2007; 18: 313–325.
Lewis JS, Furman BD, Zeitler E, Huebner JL, Kraus VB, Guilak F, Olson SA: Genetic and cellular evidence of decreased inflammation associated with reduced incidence of posttraumatic arthritis in MRL/MpJ mice. Arthritis Rheum 2013; 65: 660–670.
Long D, Blake S, Song X-Y, Lark M, Loeser RF: Human articular chondrocytes produce IL-7 and respond to IL-7 with increased production of matrix metalloproteinase-13. Arthritis Res Ther 2008; 10: R23.
Lopez AD, Murray CC: The global burden of disease, 1990–2020. Nat Med 1998; 4:1241–1243.
Marini S, Fasciglione GF, Monteleone G, Maiotti M, Tarantino U, Coletta M: A correlation between knee cartilage degradation observed by arthroscopy and synovial proteinases activities. Clin Biochem 2003; 36: 295–304.
Moradi B, Rosshirt N, Tripel E, Kirsch J, Barié A, Zeifang F et al.: Unicompartmental and bicompartmental knee osteoarthritis show different patterns of mononuclear cell infiltration and cytokine release in the affected joints. Clin Exp Immunol 2015; 180: 143–154.
Moradi B, Schnatzer P, Hagmann S, Rosshirt N, Gotterbarm T, Kretzer JP et al.: CD4+CD25+/highCD127low/-regulatory T cells are enriched in rheumatoid arthritis and osteoarthritis joints – analysis of frequency and phenotype in synovial membrane, synovial fluid and peripheral blood. Arthritis Res Ther 2014; 16: R97.
Nakamura H, Yoshino S, Kato T, Tsuruha J, Nishioka K: T-cell mediated inflammatory pathway in osteoarthritis. Osteoarthr Cartil 1999, 7: 401–402.
Nuesch E, Dieppe P, Reichenbach S et al.: All cause and disease specific mortality in patients with knee or hip osteoarthritis: population based cohort study. BMJ 2011; 342: d1165.
Puenpatom RA, Victor TW: Increased prevalence of metabolic syndrome in individuals with osteoarthritis: an analysis of NHANES III data. Postgrad Med 2009; 121: 9–20.
Robert Koch-Institut: Ergebnisse der Studie „Gesundheit in Deutschland aktuell 2010“. Beiträge zur Gesundheitsberichterstattung des Bundes. Berlin: RKI; 2012.
Roemer FW, Guermazi A, Felson DT, Niu J, Nevitt MC, Crema MD, Lynch JA, Lewis CE, Torner J, Zhang Y: Presence of MRI-detected joint effusion and synovitis increases the risk of cartilage loss in knees without osteoarthritis at 30-month follow-up: the MOST study. Ann Rheum Dis 2011; 70: 1804–1809.
Saito I, Koshino T, Nakashima K, Uesugi M, Saito T: Increased cellular infiltrate in inflammatory synovia of osteoarthritic knees. Osteoarthr Cartil 2002; 10: 156–162.
Scanzello CR, Umoh E, Pessler F, Diaz-Torne C, Miles T, Dicarlo E, Potter HG, Mandl L, Marx R, Rodeo S, Goldring SR, Crow MK: Local cytokine profiles in knee osteoarthritis: elevated synovial fluid interleukin-15 differentiates early from end-stage disease. Osteoarthr Cartil 2009; 17: 1040–1048.
Schett G, Kleyer A, Perricone C et al.: Diabetes is an independent predictor for severe osteoarthritis: results from a longitudinal cohort study. Diabetes Care 2013; 36: 403–409.
Shen P-C, Wu C-L, Jou I-M, Lee C-H, Juan H-Y, Lee P-J, Chen S-H, Hsieh J-L: T helper cells promote disease progression of osteoarthritis by inducing macrophage inflammatory protein-1g. Osteoarthr Cartil 2011; 19: 728–736.
Sohn DH, Sokolove J, Sharpe O, Erhart JC, Chandra PE, Lahey LJ, Lindstrom TM, Hwang I, Boyer KA, Andriacchi TP, Robinson WH: Plasma proteins present in osteoarthritic synovial fluid can stimulate cytokine production via Toll-like receptor 4. Arthritis Res Ther 2012; 14: R7.
Sowers M, Karvonen-Gutierrez CA, Palmieri-Smith R et al.: Knee osteoarthritis in obese women with cardiometabolic clustering. Arthritis Rheum 2009; 61: 1328–1336.
Tchetverikov I, Lohmander LS, Verzijl N, Huizinga TWJ, TeKoppele JM, Hanemaaijer R, DeGroot J: MMP protein and activity levels in synovial fluid from patients with joint injury, inflammatory arthritis, and osteoarthritis. Ann Rheum Dis 2005; 64: 694–698.
Vangsness CT, Burke WS, Narvy SJ, MacPhee RD, Fedenko AN: Human knee synovial fluid cytokines correlated with grade of knee osteoarthritis – a pilot study. Bulletin of the NYU hospital for joint diseases 2011; 69: 122–127.
Wang Q, Rozelle AL, Lepus CM, Scanzello CR, Song JJ, Larsen DM, Crish JF, Bebek G, Ritter SY, Lindstrom TM, Hwang I, Wong HH, Punzi L, Encarnacion A, Shamloo M, Goodman SB, Wyss-Coray T, Goldring SR, Banda NK, Thurman JM, Gobezie R, Crow MK, Holers VM, Lee DM, Robinson WH: Identification of a central role for complement in osteoarthritis. Nat Med 2011; 17: 1674–1679.
Yamada H, Nakashima Y, Okazaki K, Mawatari T, Fukushi J-I, Oyamada A, Fujimura K, Iwamoto Y, Yoshikai Y: Preferential accumulation of activated Th1 cells not only in rheumatoid arthritis but also in osteoarthritis joints. J Rheumatol 2011; 38: 1569–1575.
Yoshimura N, Muraki S, Oka H et al.: Accumulation of metabolic risk factors such as overweight, hypertension, dyslipidaemia, and impaired glucose tolerance raises the risk of occurrence and progression of knee osteoarthritis: a 3-year follow-up of the ROAD study. Osteoarthritis Cartilage 2012; 20: 1217–1226.
Yusuf E, Nelissen RG, Ioan-Facsinay A et al.: Association between weight or body mass index and hand osteoarthritis: a systematic review. Ann Rheum Dis 2010; 69: 761–765.
Für die Verfasser
Priv.-Doz. Dr. med. Babak Moradi
Universitätsklinik Heidelberg
Klinik für Orthopädie und Unfallchirurgie
Schlierbacher Landstraße 200a
69118 Heidelberg
Fußnoten
Klinik für Orthopädie und Unfallchirurgie (Direktor: Prof. Dr. med. Volker Ewerbeck); Universitätsklinikum Heidelberg